TiO2协同增强ZIF-8光催化降解特性研究
2021-04-18杜慧玲冉宏培
徐 行,杜慧玲,杜 娴,冉宏培,吴 亮,李 卓
(西安科技大学材料科学与工程学院,西安 710054)
0 引 言
随着工业的迅猛发展,大量的工业有机废水进入水体环境中,亚甲基蓝(MB)作为有机物废水中降解较为困难的一种物质,不仅会造成严重的环境污染,还会威胁到人类的健康与生存。随着人们对环保意识的提高,对催化剂的要求也越来越高,开发高效、绿色可降解有机废水的光催化剂越来越重要。在金属氧化物半导体纳米材料中,TiO2颗粒由于其无毒无害、催化能力强、化学性质稳定、价格便宜等优点被广泛应用于处理各种有机污染物[1]。有研究表明,锐钛矿相和金红石相TiO2的最优化质量比大致为7 ∶3时,催化活性达到最大[2]。但TiO2也具有比表面积较小、选择性差、吸附效率低和太阳能利用率低等缺点[3],其中光生氧空穴和电子在混晶TiO2表面复合的速度高于分离的速度,因此表面吸附能力和载流子的迁移率较低仍然是影响其光催化性能的主要因素。TiO2通过与MOFs材料复合加快空穴-电子的分离速率和载流子的迁移速率来提高太阳光的利用率,增强催化降解能力。Li等[4]通过多功能逐步自组装策略将可调谐MIL-101(Cr)包覆到空心TiO2纳米粒子上,中空TiO2表面的MIL-101由于其优异的H2S吸附性能提高了光催化活性,在紫外光下将H2S光催化降解为H2SO4。Sheng等[5]在NH2-MIL-125(Ti)的框架内通过原位生长形成非晶态TiO2,以TiO2和NH2-MIL-125(Ti)为光催化剂和助催化剂在可见光下催化降解四环素及苯甲醇。但非晶态和锐钛矿TiO2的空穴-电子复合速率快,无法发挥其光催化性能。
金属有机骨架(MOFs)材料由于其特殊的孔道结构,比表面积较大,具有高的吸附和催化活性。沸石咪唑酯骨架-8(ZIF-8),由Zn2+和2-甲基咪唑构成,其在水溶液中具有高热稳定性和化学稳定性,所以甲基咪唑配体已成为研究非常广泛的催化MOFs材料。ZIF-8通常被选为光催化剂,在紫外光照射下分解有机污染物[6]。然而,ZIF-8的催化效率低于常规半导体光催化剂(如ZnO、TiO2和CdS)的催化效率。
将ZIF-8进行金属离子置换和复合化,是当前提高ZIF-8吸附催化性能的主要途径。为了提高催化效率,ZIF-8被设计为与其他光催化剂结合形成半导体-MOFs的异质结构。包覆型结构是当前研究MOFs材料重要的手段与路径。Chakraborty等[7]将CuO NPs(CuO nanoparticles)通过在ZIF-8表面上原位成核,制备的CuO NPs/ZIF-8纳米复合材料在日光照射下对罗丹明6G(Rh6G)降解表现出有效的光催化活性。含有5%(质量分数)CuO的纳米复合材料对染料降解表现出最高的光催化活性。Hu等[8]以原位生长法合成了ZIF-8/Zn-Al层状双氧化物(LDO)多孔结构,对MB具有较高的吸附能力和良好的光催化降解活性,吸附降解率在58%以上,显著高于ZIF-8和LDO。
本文通过引入锐钛矿和金红石混合相TiO2与ZIF-8构筑异质结构来提升催化降解性能,采用TiO2表面原位生长ZIF-8的方式,制备TiO2@ZIF-8复合材料,拓宽ZIF-8的光响应范围,提升光生电子-空穴的分离速率,加快催化降解效率。
1 实 验
1.1 TiO2@ZIF-8的制备
将30 mL钛酸四丁酯(TBOT)、90 mL乙醇溶液的混合溶液A与5 mL冰醋酸(HAC)、5 mL去离子水与15 mL乙醇溶液的混合溶液B缓慢融合,搅拌均匀,陈化12 h,经烘干、研磨后得到TiO2粉末,725 ℃下烧结得到锐钛矿相(Rutile,质量分数为70.3%)与金红石相(Anatase,质量分数为29.7%)最佳比例的TiO2粉末。将TiO2(质量分数分别为5%、10%、15%)粉末浸入到2.873 5 g的2-甲基咪唑(2MI)溶液中超声,并缓慢滴入1.457 g的Zn(NO3)2·6H2O溶液,持续搅拌使ZIF-8在混晶TiO2表面原位生长制备出包覆型TiO2@ZIF-8复合材料。样品的制备工艺过程如图1所示。
1.2 性能表征
采用FEI Qutanta 450场发射扫描电子显微镜观察混晶TiO2、ZIF-8和TiO2@ZIF-8复合材料的表面形貌。采用日本京都株式会社岛津制作所XRD-6100X射线衍射仪(XRD)对试样进行物相分析。采用西安比朗责任有限公司BL-GHX-V光化学反应仪对试样进行有机染料的紫外-可见光降解实验。采用北京普析通用仪器有限责任公司TU-1810紫外可见分光光度计测试试样降解有机染料的能力。采用热仪器(Netzsch STA 449 F1)以10 ℃/min的加热速率进行热重(TG)分析。使用UV-vis分光光度计(Hitachi U-4100)记录样品的紫外-可见漫反射光谱(DRS),并使用BaSO4作为反射电阻标准。
2 结果与讨论
2.1 TiO2@ZIF-8的元素分析和结构表征
图2(a)为混晶TiO2、ZIF-8及复合材料的XRD谱。混晶TiO2的2θ=25.2°,37.7°,48.1°,55.1°处的衍射峰分别对应于TiO2锐钛矿相的(101),(004),(200)和(211)晶面。同时,2θ=27.4°,36.2°,41.2°,54.3°处的衍射峰分别对应于TiO2金红石相的(110),(101),(111)和(105)晶面[9]。结果证明了通过热处理可以成功制备出锐钛矿和金红石混合相[10]。与混晶TiO2相比,TiO2@ZIF-8在2θ=7.1°,10.2°,12.5°,14.5°,16.2°处的衍射峰分别对应于ZIF-8的(011),(002),(112),(022)和(013)晶面,说明有ZIF-8在TiO2的表面生成[11]。随着混晶TiO2引入量的增加,锐钛矿相和金红石相的衍射峰逐渐增强。锐钛矿相TiO2(101)晶面衍射峰的相对强度随ZIF-8的引入而降低,这可能是因为ZIF-8的引入抑制了TiO2晶粒的生长,影响了TiO2的晶格。同时ZIF-8与TiO2之间发生的相互作用可能是较弱的范德华力或ZIF-8在TiO2晶粒上的物理吸附,这种相互作用减小了TiO2的晶粒尺寸,并导致混合相的形成,从而使锐钛矿相TiO2(101)晶面相对应的衍射峰强度降低,TiO2@ZIF-8中的峰相对于混晶TiO2发生了偏移[12]。
图2(b)为ZIF-8和复合材料的FTIR谱。图中ZIF-8和TiO2@ZIF-8的透射峰主要在400~1 600 cm-1频率之间,因5%TiO2@ZIF-8中TiO2引入量过少,透射峰较纯ZIF-8无明显变化。随着TiO2含量的增加,TiO2@ZIF-8在1 583 cm-1时O-H的峰强逐渐升高。同时在421 cm-1(Zn-N键拉伸)、1 578 cm-1(C=N双键拉伸)、1 420 cm-1和994 cm-1(C-N键拉伸)、1 146 cm-1和1 307 cm-1(咪唑弯曲)处都显示了振动带[13],这些振动带是ZIF-8的典型振动带。在514 cm-1处形成典型的N-Ti-O键[14],表明有TiO2@ZIF-8复合材料生成。
图2(c)为TiO2、ZIF-8及复合材料的TG曲线,表征了TiO2和ZIF-8的热稳定性。在400 ℃之前,TiO2是无定型的;温度从400 ℃升高至550 ℃,TiO2由无定型开始向锐钛矿相结构转变;在550 ℃时,完全转变为锐钛矿相TiO2;在550 ℃之后,晶体结构由锐钛矿相向金红石相转变;并在850 ℃完全转化为金红石相TiO2。550~850 ℃是锐钛矿相和金红石相共存的烧结温度。ZIF-8的晶体结构在450 ℃前保持稳定;温度位于450~500 ℃之间时发生轻微变化,可能是因为释放了少量从空腔和晶体表面吸附的水分。温度位于500~740 ℃之间时,ZIF-8发生了快速分解,这是由于在高温下ZIF-8中的某些元素发生了熔化和降解,引起ZIF-8结构的崩塌、分解。740 ℃之后晶体结构完全消失,转化为ZnO[15]。TiO2和ZIF-8在400 ℃前均表现出优异的热稳定性。TiO2@ZIF-8复合材料在540 ℃开始发生分解,650 ℃以后彻底分解转化为TiO2@ZnO。复合材料的结构分解要早于单一的两种,可归因于其在加热过程中ZIF-8纳米颗粒的重量损失,导致其烧结温度降低[16]。
为了研究TiO2@ZIF-8复合材料的化学组成和状态,进行X射线光电子能谱(XPS)分析,结果如图3所示。TiO2@ZIF-8中主要有Ti、Zn、C、O和N等元素存在。混晶TiO2中和TiO2@ZIF-8的Ti 2p光谱中455.75 eV和461.5 eV处的两个峰分别是Ti 2p3/2和Ti 2p1/2,对应TiO2中的O-Ti-O键和Ti4+[17]。而在458.95 eV和459.3 eV处的两个峰可以归因于Ti 2p1/2,这是低氧化态Ti(Ti3+)的特征[18]。TiO2@ZIF-8中的峰相对混晶TiO2发生了偏移,这是由于ZIF-8的引入导致的。ZIF-8的Zn 2p光谱中1 018.95 eV和1 042.15 eV处的峰以及TiO2@ZIF-8的Zn 2p光谱中1 019.1 eV和1 042.45 eV处的峰分别对应于Zn 2p3/2和Zn 2p1/2,同时Zn 2p3/2中1 018.9 eV、1 019.05 eV 和Zn 2p1/2中1 042.15 eV、1 041.9 eV处分别有两个明显的峰,对应ZIF-8中Zn-O带和Zn-C键[19]。TiO2@ZIF-8由于引入混晶TiO2而导致Zn 2p光谱中的峰相对于纯ZIF-8的峰整体右移。TiO2@ZIF-8的Ti 2p光谱和Zn 2p光谱中峰出现偏移都证明了混晶TiO2和ZIF-8发生了复合。
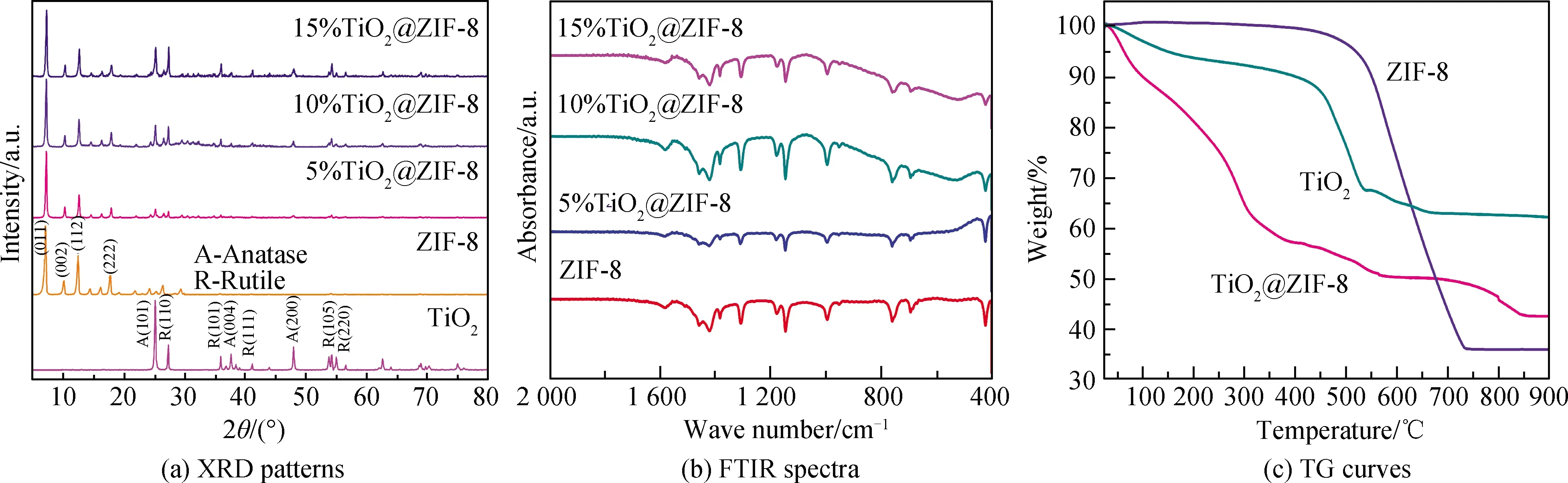
图2 TiO2、ZIF-8及TiO2@ZIF-8复合物的XRD谱、FTIR谱和TG曲线Fig.2 XRD patterns, FTIR spectra and TG curves of TiO2, ZIF-8 and TiO2@ZIF-8 composites
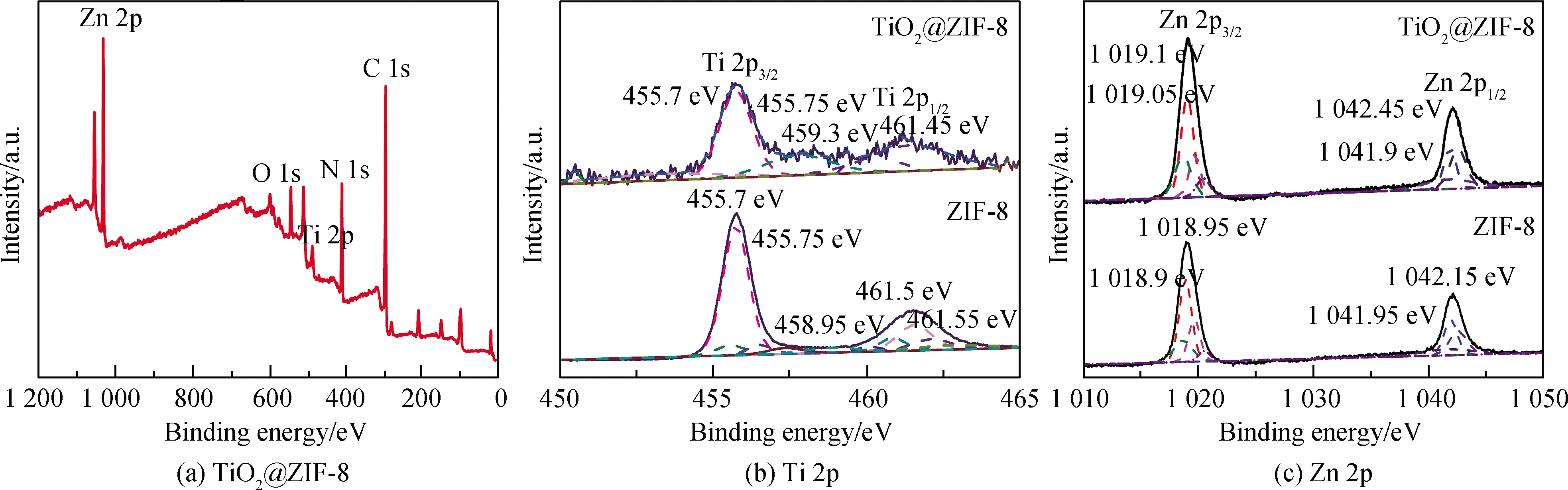
图3 10% TiO2@ZIF-8的XPS谱Fig.3 XPS spectra of 10%TiO2@ZIF-8
2.2 形貌分析
TiO2、ZIF-8和10%TiO2@ZIF-8的SEM照片如图4所示。图4(a)中,混晶TiO2晶粒的平均尺寸在200~300 nm之间,同时半导体光催化剂的粒径越小,比表面积越大,可更好地吸收紫外线并且有效阻止光生电子和空穴的复合, 从而保持较高的光催化活性。图4(b)中,ZIF-8粉末的晶体形貌为规则的菱形十二面体结构,晶体的平均尺寸在50 nm左右,研究发现ZIF-8的粒径普遍在50~100 nm之间[20-23]。图4(c)中ZIF-8(b区)的晶体尺寸小于TiO2(a区)颗粒,锐钛矿相和金红石相的混晶TiO2被晶粒细小的ZIF-8包覆着,明显增强了其对MB分子的吸附面积,表明有TiO2@ZIF-8复合材料生成。

图4 TiO2、ZIF-8和10%TiO2@ZIF-8的SEM照片Fig.4 SEM images of TiO2, ZIF-8 and 10%TiO2@ZIF-8
2.3 光催化性能分析
采用紫外-可见漫反射光谱(DRS)研究了样品的光学性能。图5为ZIF-8、TiO2和10%TiO2@ZIF-8的DRS谱。如图5所示,ZIF-8和10%TiO2@ZIF-8在221.52 nm表现出ZIF-8的本征吸收峰。混晶TiO2和TiO2@ZIF-8在300~400 nm范围内各有一个吸收带,且在336.94 nm处呈现一个TiO2本征吸收峰,可知ZIF-8不能被可见光激发。TiO2@ZIF-8具有与TiO2相似的吸光度范围,并且在吸光度为427.56 nm波长以下的强度逐渐增加。TiO2@ZIF-8在吸光度255 nm范围以下与ZIF-8类似。因为TiO2对紫外光有很好的吸收,所以TiO2@ZIF-8对紫外光有较强的吸收作用,相比于ZIF-8,有效提高了427.56 nm以下的紫外吸收度。
用Tauc plot法估算禁带宽度Eg,即紫外-可见光谱反演(αhν)2与吸收光能量hν的关系曲线,公式为[24]:
(αhν)2=C(hν-Eg)n
(1)
式中:α为吸收系数;C为常数;hν为光子能量;n为与跃迁概率有关的常数,n=1/2、2分别对应间接带隙和直接带隙。(αhν)2与hν的关系将给出样品的禁带宽度,最后通过曲线的线性区域测量外推切线的x轴截距来确定Eg值[14]。
降低样品的Eg值有助于提高光催化效率。ZIF-8通过复合混晶TiO2,禁带宽度降低,吸光波长范围增加,对亚甲基蓝的光催化能力提高,催化效果变好。本文采用溶胶-凝胶法制备的TiO2的禁带宽度为3.046 9 eV。Das等[25]采用水热法制备纳米TiO2的禁带宽度为3.23 eV;Islam等[26]采用热喷雾热解法制备了TiO2薄膜样品的禁带宽度为3.11 eV;Nagaraj等[27]采用光子诱导法(PIM)制备的纳米TiO2的禁带宽度为3.09 eV。与其他方法相比,溶胶-凝胶法更能符合预期效果。Zhang等[14]通过声化学法制备了TiO2@ZIF-8复合材料,其中ZIF-8、TiO2、TiO2@ZIF-8的禁带宽度分别为5.18 eV、3.28 eV和3.28 eV。本文采用溶剂法制备的ZIF-8、10%TiO2@ZIF-8的禁带宽度分别为5.115 7 eV和3.131 3 eV,较前者具有较低的禁带宽度以及较好的催化效果。与纯ZIF-8相比,混晶TiO2的加入使复合材料的带隙值略有下降。带隙减小取决于粒子大小、光学性质和表面形貌等因素,这些因素都会影响光子的穿透[12]。当ZIF-8和混晶TiO2复合时,形成了一个分层的多孔结构。因为ZIF-8的尺寸很小,使得TiO2@ZIF-8材料表面粗糙。光子很容易从粗糙的表面反射出去,因为它们不容易反射到较深的表面。因此,光子在这些多孔表面的停留时间相对较长。入射光子散射在粗糙表面上的损失率最小,从而增加了光的吸收,减小了带隙。另一方面,在电子层面,因为TiO2和ZIF-8异质结构形成时,可能会形成陷阱,使复合材料结构产生一个新的带隙,即带隙变窄[28-29]。其次,通过物相分析发现,TiO2和ZIF-8之间界面异质结形成,可能会形成陷阱,导致TiO2中的Ti4+取代ZIF-8中的Zn2+,从而使复合材料的带隙降低。
10%TiO2@ZIF-8复合材料的催化性能通过MB的降解进行评价,图6为MB的光催化降解实验及反应速率图。MB溶液特定波长λ=655 nm。MB的降解率计算公式[24]:
η=C0-CC0×100%
(2)
式中:η为MB的降解率,%;C0为MB的初始浓度,mg/L;C为不同时间段MB的浓度,mg/L。
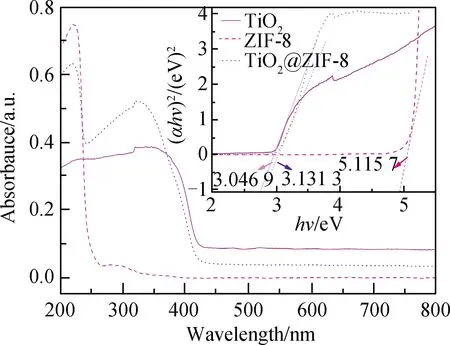
图5 ZIF-8、TiO2和10%TiO2@ZIF-8的DRS谱Fig.5 DRS spectra of ZIF-8, TiO2 and 10%TiO2@ZIF-8
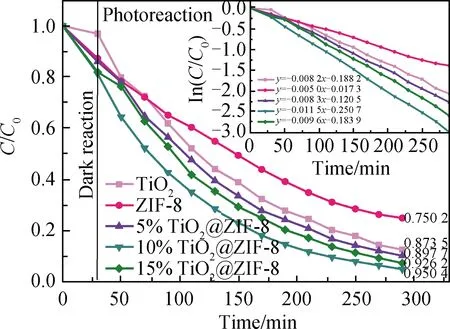
图6 MB的光催化降解实验及反应速率图Fig.6 Photocatalytic degradation experiment and reaction rate of MB
暗反应条件下,混晶TiO2只发生微量吸附,而ZIF-8和10%TiO2@ZIF-8发生了较大的吸附,这是因为ZIF-8是多孔结构,具有较好的吸附性能,能对MB进行吸附。当在紫外光下时,TiO2@ZIF-8杂化体系中的混晶TiO2被激发。混晶中由于少量金红石相的存在,在相界面处电荷从锐钛矿相向金红石相快速转移,使激发的电子-空穴对的寿命增加,电荷的重组率降低,从而显著提高感光能力[15]。ZIF-8有机框架材料孔道中均匀分布的Zn/ZnOx纳米异质结可以作为活化位点,且较大的比表面积提供了更多的活化位点,促进了MB的催化降解。
紫外光源下照射290 min时,计算得到5%、10%、15%TiO2@ZIF-8对MB的催化降解率分别为89.77%、95.04%和92.62%。混晶TiO2和纯ZIF-8的催化降解率分别为87.35%和75.02%。10%TiO2@ZIF-8对MB的降解率是纯ZIF-8的1.27倍。同时MB降解遵循一级动力学模型。与混晶TiO2相比,复合材料对MB的催化降解更有效。
TiO2@ZIF-8复合材料结合了混晶TiO2电子-空穴对寿命较长、复合率较低的特性和ZIF-8高的比表面积,裸露的高活性与选择性的Zn/ZnOx异质结界面,表现出协同效应,构成立体催化降解复合体系。复合材料的催化降解性能指标与混晶TiO2纳米颗粒和纯ZIF-8相比,有一定程度的提高,在紫外光下更活跃。ZIF-8晶体的孔隙多,具有较好的吸附性,增加了对载流子的俘获数量,提高了表面电荷迁移速率,可以使MB分子快速接近位于包覆内的TiO2,促进催化降解过程的进行[30]。同时,TiO2@ZIF-8复合材料具有的孔道结构使光照与催化剂表面、催化剂表面与MB目标分子的接触也更加充分, 从而也有效促进了MB有机废水的降解[31]。
为了进一步研究制备的复合材料的催化性能,假设所有的反应动力学都是一阶反应[24]:
lnCC0=kt
(3)
式中:C0、C分别是MB的初始浓度和每个时间段实际浓度;k为速率常数;t为反应时间,min。
ZIF-8、TiO2和10%TiO2@ZIF-8复合材料降解MB的反应符合一阶线性动力学模型。其中10%TiO2@ZIF-8的线性相关性最好,符合y=-0.011 5x-0.250 7线性函数,相关系数R2=0.983 2。光催化反应的降解效率取决于光生电子-空穴的复合率。增加载流子的俘获数量或提高表面电荷迁移速率能够抑制电荷载流子复合,增加光催化反应的量子效率。5%、10%、15%TiO2@ZIF-8的反应速率(0.008 3 min-1、0.011 5 min-1、0.009 6 min-1)均高于纯ZIF-8的0.005 0 min-1和TiO2的0.008 2 min-1。10%TiO2@ZIF-8的反应速率最快,是纯ZIF-8的2.3倍。这是由于在混晶TiO2表面原位生长了ZIF-8,形成包覆型TiO2@ZIF-8复合材料,利用ZIF-8较大的比表面积和大量孔道中的Zn/ZnOx纳米异质结作为活化位点,促进了其对载流子数量的俘获,提高了反应速率。所以TiO2@ZIF-8复合材料比TiO2具有催化降解MB更有效的效果。
图7为TiO2@ZIF-8复合材料吸附MB的循环重复性能图。当复合材料吸附MB时,重复使用5次后仍具有较好的MB吸附性能,其吸附降解率仍然还有85.15%,说明复合材料具有较好的循环稳定性。
MB在TiO2@ZIF-8复合材料上光催化降解的反应机理如图8所示。单个ZIF-8对亚甲基蓝吸附作用很小。而ZIF-8的高比表面积增加了TiO2的分散性,增强了TiO2的吸光能力。同时,ZIF-8中互连的三维多孔网络有利于MB分子的扩散和光的穿透。TiO2是纳米复合催化剂上MB光催化氧化的活性中心,在光照射下,MB分子不仅可以快速且容易地扩散到ZIF-8的孔隙中,也可以吸附在ZIF-8有机框架材料孔道中的Zn/ZnOx纳米异质结活化位点上。由于半导体特性,ZIF-8和TiO2都可以被紫外光激发。因此,与纯TiO2和ZIF-8相比,TiO2@ZIF-8复合材料配合良好,具有优异的催化活性。此外,还证明了一种可能的界面电子转移行为。在紫外光照射下,TiO2@ZIF-8复合材料可以激发并生成TiO2和ZIF-8电子-空穴对。有报道称ZIF-8的导带为-0.45 eV[32],比TiO2(-0.5 eV)[33]的导带水平更正[34]。因此TiO2的导带(CB)上的光诱导电子转移到ZIF-8的CB上,参与ZIF-8发生的光还原过程,将HSO-5转化为SO-4和OH-。同时,ZIF-8激发产生的空穴(h+)注入TiO2的价带(VB)中,H2O+h+→·OH+H+,C16H18ClN3S+·OH→CO2+H2O。在空间电荷区内部的静电势有利于光生载流子的分离,从而使电子-空穴复合率显著降低[35],提高了催化降解效率。
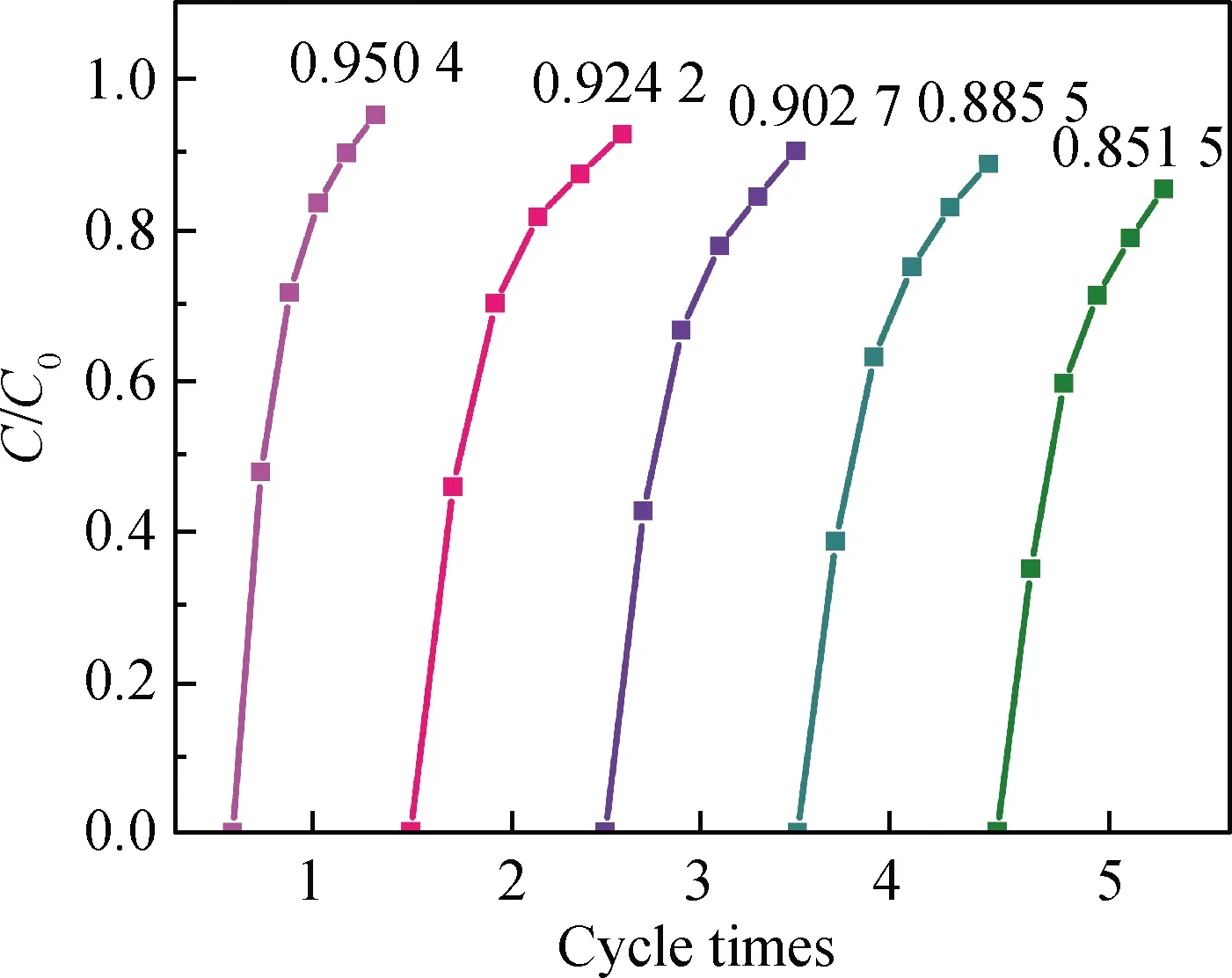
图7 复合材料吸附MB的循环稳定性能图Fig.7 Cyclic stability of MB adsorbed by composite materials
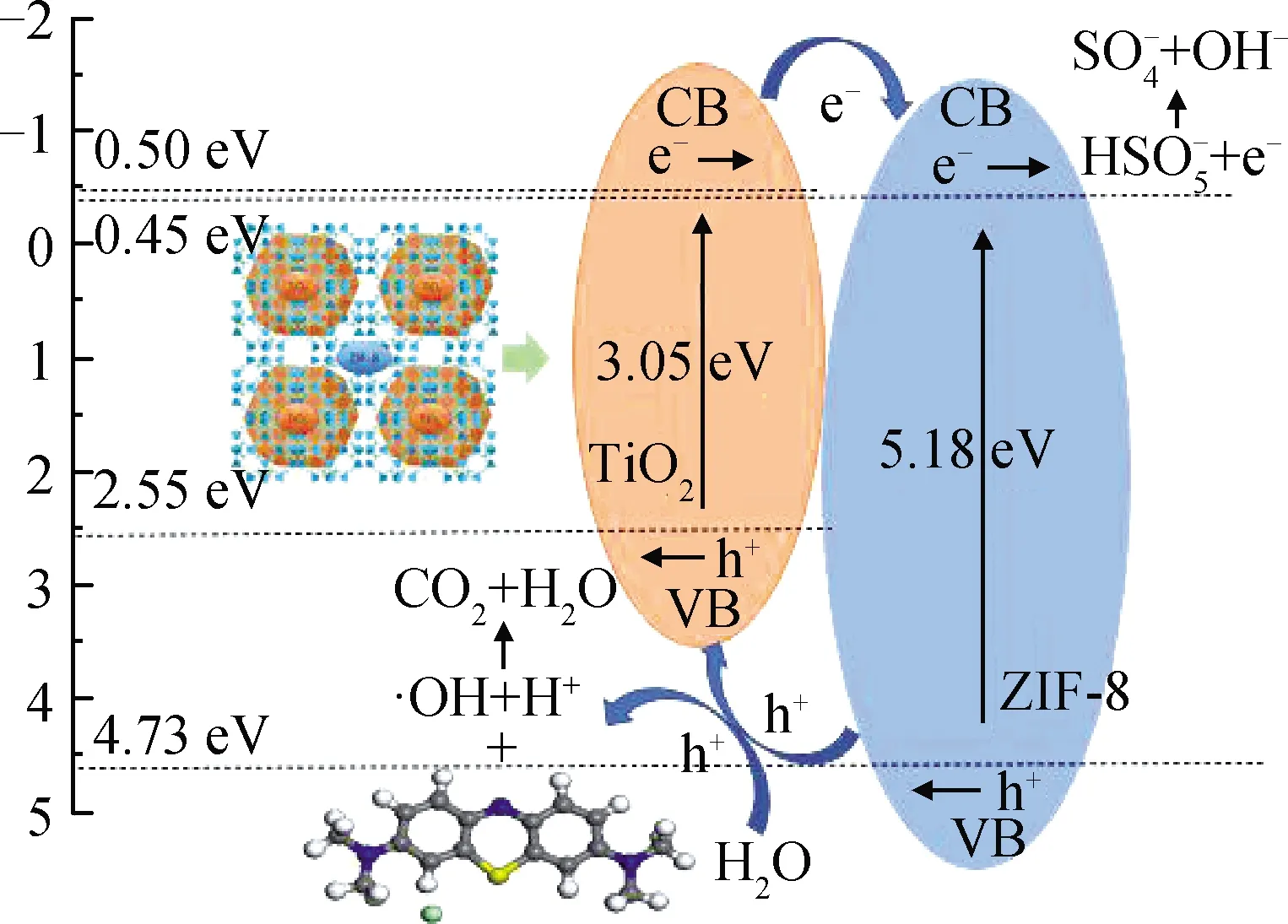
图8 MB在TiO2@ZIF-8复合材料上光催化降解的反应机理Fig.8 Reaction mechanism for the photocatalytic degradation of MB on the TiO2@ZIF-8 composite
3 结 论
(1)通过溶胶-凝胶法结合溶剂法制备了TiO2@ZIF-8复合材料。混晶TiO2与大量裸露的高活性与选择性的Zn/ZnOx异质结界面产生协同效应,构成立体催化降解复合体系。使吸光度波长从ZIF-8的221.52 nm增加到427.56 nm,有效地增强了紫外光区域的光捕获。
(2)10%TiO2@ZIF-8的降解率最高,反应速率最快,分别为95.04%和0.011 5 min-1。TiO2@ZIF-8复合材料具有比TiO2和纯ZIF-8更为优异的降解活性。
(3)TiO2@ZIF-8复合后,使禁带宽度由ZIF-8的5.115 7 eV降至3.131 3 eV,这是由于复合材料界面处电子和空穴的相互转移,导致其空间电荷区内部产生静电势促进光生载流子分离,降低电子-空穴复合率,从而增强了自身的催化性能。
