FM19G11体外增敏替莫唑胺对MGMT阳性恶性胶质瘤细胞系的作用机制
2021-04-17方黄毅尤朝国章钟鼎况统帅盛汉松
方黄毅,尤朝国,庞 晨,章钟鼎,张 哲,况统帅,盛汉松
(1.温州医科大学 第二临床医学院,浙江 温州 325035;温州医科大学附属第二医院 2.耳鼻咽喉科; 3.神经外科,浙江 温州 325027)
恶性胶质瘤(malignant glioma)是一类发病率较高的常见肿瘤,约占所有原发性脑肿瘤的45%,可严重影响患者脑组织功能[1]。新型烷化剂——替莫唑胺(temozolomide,TMZ)是临床上的一线化疗药物,但在化疗过程中出现化疗不敏感的现象[2]。研究报道限制TMZ临床疗效的多数原因是胶质瘤细胞内MGMT的活性,MGMT是一种DNA修复酶,能够逆转TMZ的疗效[3]。研究证实参与MGMT基因转录及蛋白翻译的调控机制主要包括NF-κB、P53和SP1等介导的信号通路[4]。低氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)是在低氧细胞的细胞核提取物中发现的一种DNA结合蛋白。在恶性胶质瘤的研究中,少量研究报道了HIF-1α的靶向抑制剂FM19G11可以降低肿瘤细胞中MGMT的表达[5]。上述研究表明FM19G11通过抑制HIF-1α可能能够克服MGMT介导的TMZ耐药。本研究选取了前期研究发现的MGMT阳性的人源性恶性胶质瘤细胞系T98G[5],主要探讨FM19G11对TMZ诱导T98G细胞的药物敏感性的影响。
1 材料与方法
1.1 材料
1.1.1 研究对象:人源性恶性胶质瘤细胞系T98G(中国科学院上海生命科学院研究院生物化学与细胞生物学研究所)。
1.1.2 主要试剂:DMEM培养基、双抗、胎牛血清、胰蛋白酶(含EDTA)(Gibco公司);FM19G11(Sigma-Aldrich公司);一抗(Abcam公司);二抗(上海碧云天生物技术有限公司);RT-qPCR引物(上海生工生物技术公司合成);反转录PCR试剂盒、real-time PCR 试剂盒(TaKaRa公司)。
1.2 方法
1.2.1 细胞的培养传代:将T98G细胞按要求进行复苏后接种于含10%小牛血清的DMEM培养基(37 ℃、5% CO2培养箱)培养,当细胞增殖至70%~80%汇合时,收集处于对数增殖期的细胞进行传代,根据细胞的数量以及增殖状态进行1∶2或者1∶3传代培养。每次细胞实验操作前使用锥虫蓝染色法观察细胞活力,确定细胞活力在98%以上。
1.2.2 CCK-8法检测细胞增殖活性:将T98G细胞以5×103个/孔的细胞数接种于96孔培养板,每孔100 μL,每组设6个复孔,边缘孔用PBS液填充。置于37 ℃、5% CO2恒温培养箱内培养24 h后,对细胞进行换液,分别加入终浓度为0.5 μmol/L FM19G11、200 μmol/L TMZ、0.5 μmol/L FM19G11+200 μmol/L TMZ。分别培养24、48 和72 h后,每孔加入10 μL CCK-8试剂。避光继续孵育1~4 h后,然后弃除培养基。使用酶标仪测定各孔于450 nm波长处的吸光度值。
1.2.3 细胞克隆形成实验观察细胞增殖:将T98G细胞以每孔500个细胞分别接种含1 mL 10%胎牛血清的DMEM培养液的6孔板中。孵育24 h贴壁后,按“1.2.2”分组加入药物处理,每3~4 d换液。当肉眼能看到点点的克隆群时,终止培养。弃去上清液,用PBS浸洗2次。加4%多聚甲醛(每孔1 mL)固定15 min。弃除固定液,加1 mL结晶紫染色液染色10~15 min,流水冲洗,干燥后拍照。在低倍镜下计数大于50个细胞的克隆数。
1.2.4 Hoechst 33258染色法检测细胞凋亡形态变化:把预先高温高压灭菌消毒过的小圆玻片放入24孔板中,将T98G细胞接种于孔内,置于恒温培养箱中贴壁培养12 h;细胞爬片后,吸去培养液后按“1.2.2”的分组加入药物处理24 h,按照荧光染色试剂盒说明书逐步进行操作。
1.2.5 RT-qPCR检测细胞中HIF-1α、EPO和VEGF的mRNA表达:收集0、0.5、1和2 μmol/L FM19G11处理24 h的T98G细胞,采用Trizol法提取各组细胞的总RNA。根据试剂盒说明书制备cDNA,以cDNA为模板配置RT-PCR反应体系。引物设计与合成:HIF-1α的正向引物为5′-GTCTGA GGGGACAGGAGGAT-3′,反向引物为5′-CTCCTCA GGTGGCTTGTCAG-3′;VEGF的正向引物为5′-TA TGTTTGACTGCTGTGGACTTGA-3′,反向引物为5′-CAGGGATGGGTTTGTCGTGT-3′;EPO正向引物为5′-TTACCAGCTCGAAGGTGAATCAAGA-3′,反向引物为5′-GCGTCCAGGAGCACTACTTCATTG-3′;内参GAPDH正向引物为5′-TGGACTCCACGACGTACTC AG-3′,反向引物为5′-CGGGAAGCTTGTCATCAATG GAA-3′。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 15 s,循环40次。进行荧光定量PCR扩增后,得到相应的Ct值,计算各组目的基因和内参基因的表达量。使用2-ΔΔCt方法计算相应的目的基因的相对表达量。
1.2.6 Western blot检测细胞中HIF-1α、EPO、VEGF、MGMT和NF-κB P65蛋白表达水平:收集0、0.5、1和2 μmol/L FM19G11处理24 h的T98G细胞,PBS 洗涤3次, RIPA 裂解液在冰盒上裂解10 min,提取蛋白, 12 000 r/min离心15 min, 吸取上清液备用。BCA法测量总蛋白浓度, 蛋白样品经SDS-PAGE凝胶电泳约2 h后, 湿法转膜1.5 h,转膜完成后5%脱脂牛奶中封闭,封闭完成后洗膜,然后使用HIF-1α、EPO、VEGF、MGMT和NF-κB P65相应一抗4 ℃孵育过夜,孵育完成后洗膜,用二抗的封闭液室温孵育1 h,洗膜,最后ECL显色, 照相并分析结果。
1.3 统计学分析
2 结果
2.1 FM19G11联合TMZ处理抑制T98G细胞增殖
FM19G11单独处理对T98G细胞并无增殖抑制作用。200 μmol/L TMZ处理T98G细胞有抑制作用,但并非十分敏感。0.5 μmol/L FM19G11和200 μmol/L TMZ联合对恶性胶质瘤T98G细胞有强烈的抑制作用(P<0.05,n=6)(图1A)。细胞克隆形成实验进一步证实这一现象(P<0.05,n=3)(图1B)。
2.2 恶性胶质瘤T98G细胞经FM19G11、TMZ分别单独处理及二者联合处理发生凋亡性形态改变
联合处理组瘤细胞的凋亡性改变较TMZ单独处理组更加明显(图2)。此外,Hoechst33258细胞核染色从另一方面说明了这一现象(图2),联合处理组的T98G细胞的细胞核折光度明显增加,部分细胞核出现分叶状改变,少数细胞核已经发生裂解(凋亡小体)。
2.3 FM19G11抑制T98G细胞内HIF-1α及其下游基因的表达
不同浓度FM19G11处理后T98G细胞内HIF-1α,VEGF和EPO的mRNA(图3A)和蛋白(图3B)表达均呈剂量-效应关系,显著低于对照组(均P<0.05)。
2.4 FM19G11抑制T98G细胞内MGMT和NF-κB信号通路的表达
不同浓度FM19G11处理后T98G细胞内MGMT和NF-κB P65的蛋白表达呈剂量-效应关系,均低于正常对照组(P<0.05)(图4)。
2.5 FM19G11和TMZ联合处理对T98G细胞内MGMT和NF-κB信号通路的调控作用
与对照组相比,FM19G11显著降低了T98G细胞内MGMT的表达(10.4%±3.6%)(P<0.05),而TMZ上调了T98G细胞内MGMT的表达(24.8%±2.4%)(P<0.05),FM19G11和TMZ的联合处理显著降低MGMT的表达(60.4%±4.3%)(P<0.05)。此外,FM19G11不仅单独作用能明显下调NF-κB p65亚基的表达水平(32.3%±3.3%)(P<0.05),在它与TMZ联合作用之后,这种下调作用仍然十分显著(62.7%±3.5%)(P<0.05)(图5)。
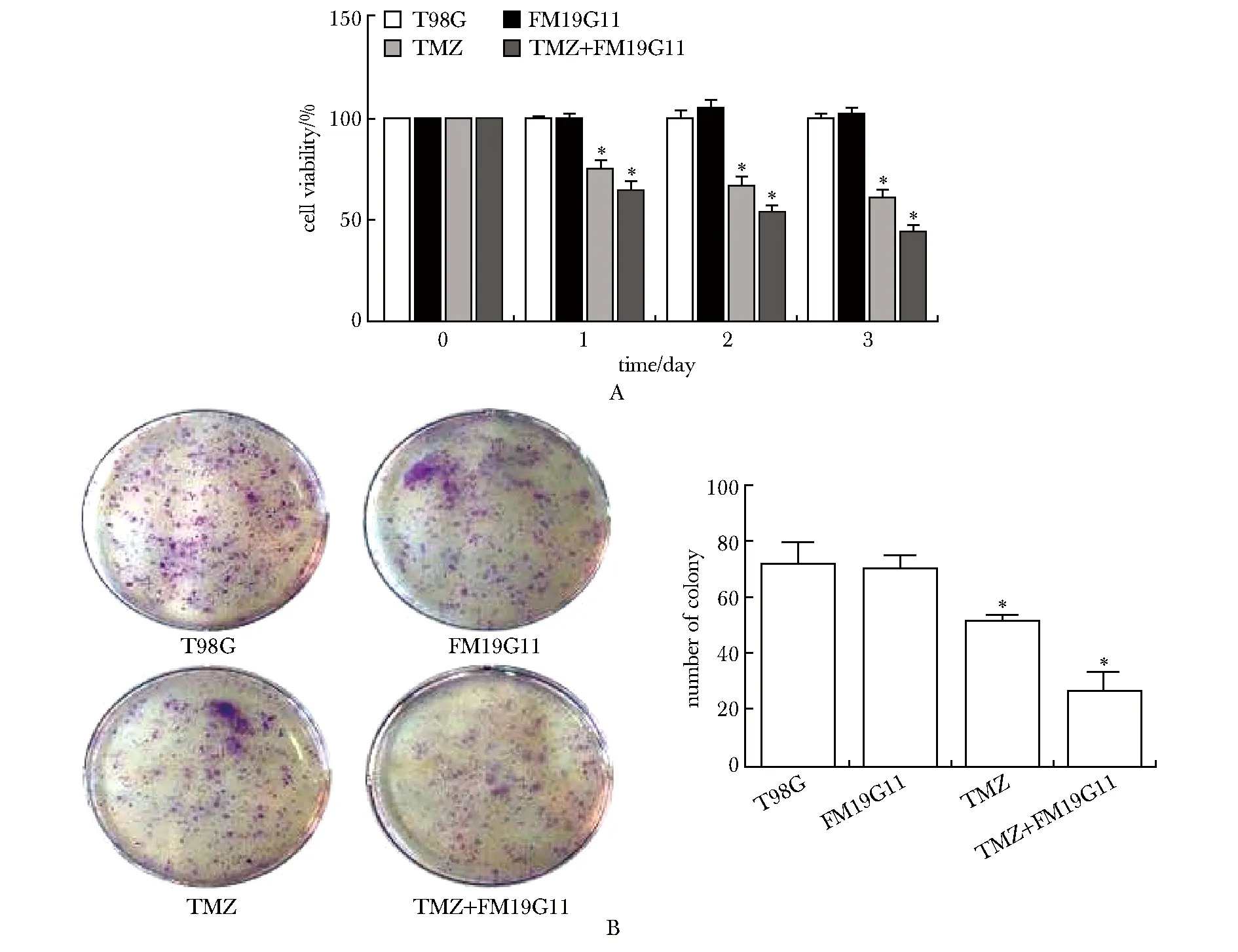
A.CCK-8 assay; B.cell clone formation assay; *P<0.05 compared with T98G group图1 FM19G11和TMZ对T98G细胞增殖的影响Fig 1 Effects of FM19G11 and TMZ on proliferation of T98G
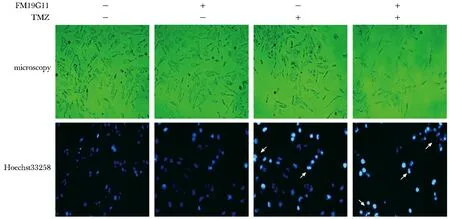
图2 FM19G11和TMZ处理对T98G 细胞凋亡的影响Fig 2 Effects of FM19G11 and TMZ on apoptosis of T98G cells(×200)

A.RT-qPCR; B.Western blot; *P<0.05 compared with 0 μmol/L FM19G11 group图3 FM19G11对T98G细胞中HIF-1α、VEGF和EPO表达的影响Fig 3 Effect of FM19G11 on the expression of HIF-1α, VEGF and EPO in T98G
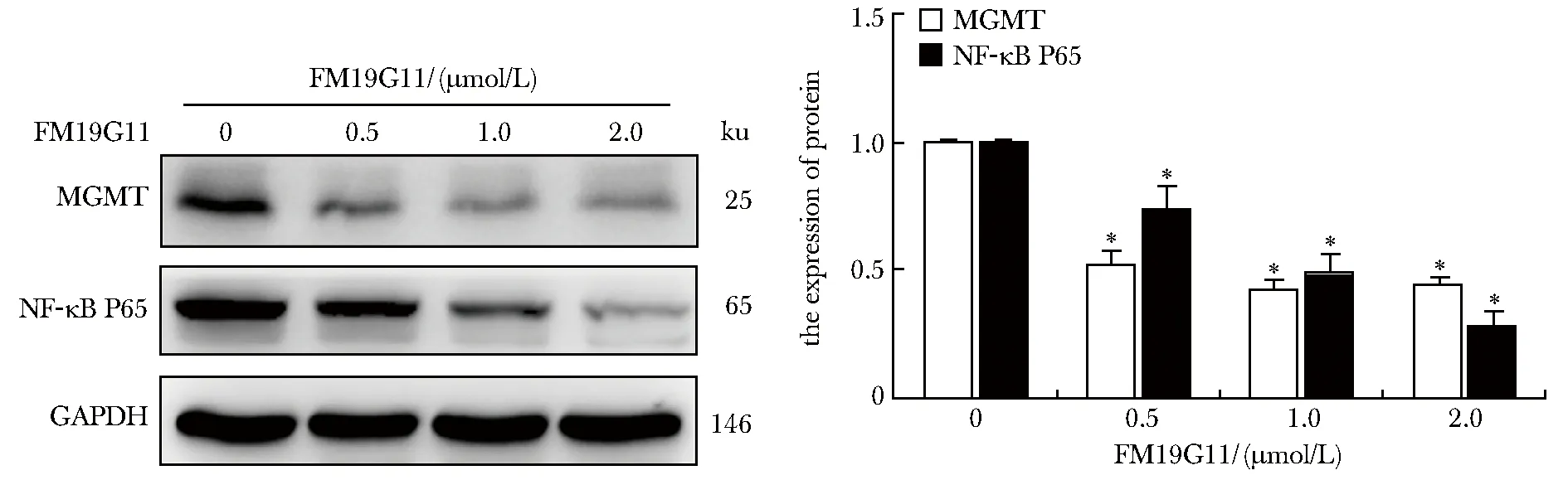
*P<0.05 compared with 0 μmol/L FM19G11图4 FM19G11对T98G细胞中MGMT和NF-ΚB P65蛋白表达的影响Fig 4 Effect of FM19G11 on the expression of MGMT and NF-κB P65 proteins in T98G
3 讨论
新型烷化剂TMZ是治疗恶性胶质瘤的化疗药物之一,但在治疗过程中发现部分患者对TMZ并不敏感。TMZ主要通过甲基化DNA中的核苷酸位点,导致不可修复的DNA损伤,从而使细胞周期阻滞和诱导细胞发生凋亡。MGMT是细胞中一种主要修复由各种烷化剂造成的细胞DNA损伤的酶,能够特定的移除O6-甲基鸟嘌呤上的甲基团从而逆转TMZ的效果[6]。近期少数研究表明,在恶性胶质瘤细胞、垂体腺瘤细胞等恶性肿瘤中发现抑制HIF-1α可以降低MGMT的表达[7-8]。
HIF-1α是低氧条件下广泛存在于人体细胞中的一种转录因子。研究证实肿瘤中氧浓度较低,HIF-1α在许多肿瘤中大量表达,对肿瘤的生长、血管形成、转移、 凋亡及耐药皆有影响[9-10]。少数研究发现抑制HIF-1α可以降低MGMT的表达。通过肿瘤内注射小干扰RNA(siRNA)破坏HIF-1α的作用,导致动物体内移植的人脑胶质瘤体积缩小[11]。 HIF-1α抑制剂2-甲氧基雌二醇(2-ME)在缺氧条件下能够下调MGMT表达[7]。 但是,2-ME具有较大细胞毒性,限制了进一步的临床研究。FM19G11是一种新型HIF-1α抑制剂,在较低浓度时能够起到药物作用而无细胞毒性[5]。本研究发现在MGMT表达阳性的T98G细胞中,FM19G11通过靶向抑制HIF-1α的表达,进而降低MGMT的表达。此外,HIF-1α下游与肿瘤细胞增殖相关的基因VEGF和EPO表达也受到抑制。相对于TMZ单独处理,FM19G11和TMZ的联合处理对T98G细胞具有更加显著的抑制增殖和诱导凋亡的作用。
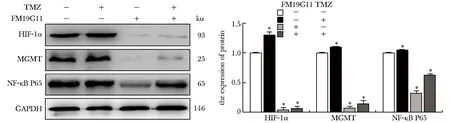
*P<0.05 compared with 0 μmol/L FM19G11+0 μmol/L TMZ图5 FM19G11和TMZ对T98G细胞内HIF-1α、MGMT和NF-κB P65蛋白表达的影响
NF-κB蛋白广泛存在于机体细胞中, 是一类能与多基因启动子部位的κB 位点特异结合并促进转录的DNA结合蛋白总称。有研究表明在健康人脑组织细胞中仅存在无活化的NF-κB蛋白表达, 而在胶质瘤细胞中则可以检测到活化的NF-κB蛋白[12]。在恶性胶质瘤研究的报道中,NF-κB可以诱导MGMT蛋白的表达, 导致细胞株对烷化剂耐药[13],本研究发现FM19G11处理T98G细胞后,降低了NF-κB蛋白表达,这说明NF-κB信号通路可能参与FM19G11对MGMT的调节作用。
综上所述,FM19G11主要通过靶向抑制HIF-1α的表达下调MGMT的表达水平,从而增强恶性胶质瘤细胞系T98G对TMZ的药物敏感性。此外,NF-κB信号通路也参与FM19G11对MGMT的调控,但是NF-κB信号通路如何参与HIF-1α对MGMT的调控以及它们之间的相互关系并不清楚,值得深入探讨。
