膜联蛋白A1减轻1型糖尿病小鼠微血管并发症
2021-04-17边芳,李宁,李奇,李康,金雯
边 芳,李 宁,李 奇,李 康,金 雯
(1.陕西省友谊医院 内分泌科, 陕西 西安 710068; 西安交通大学第一附属医院 2.神经外科;3.肿瘤外科, 陕西 西安 710061; 4.陕西省人民医院 妇科, 陕西 西安 710068)
1型糖尿病(type 1 diabetes, T1D)是一种多发生在儿童和青少年的自身免疫性疾病[1]。与糖尿病有关的微血管并发症可严重影响患者的预后[2]。1型糖尿病肾病(type 1 diabetic nephropathy, T1DN)占T1D所有死亡人数的21%,而包括糖尿病性心肌病在内的心血管疾病占T1D所有死亡人数的44%[3]。上述两种病理学特征都包括局部炎性反应、内皮功能障碍、相关细胞存活途径受损等[4]。膜联蛋白A1(annexin A1,ANXA1)是多基因膜联蛋白家族成员,具有抗感染和促分解活性[5]。ANXA1的表达水平在许多疾病中均发生改变[6]。其他研究者采用人重组ANXA1(human recombinant annexin A1, hrANXA1)或其N端肽(Ac2-26)治疗多种疾病的实验模型,均取得较好的治疗效果[7-8]。然而,目前尚不清楚ANXA1在治疗T1D中的潜在应用价值。因此,本研究旨在调查ANXA1在T1D患者中的表达水平,并考察ANXA1在T1D动物模型中对微血管并发症(糖尿病性心肌病和糖尿病性肾病)的干预效果。
1 材料与方法
1.1 材料
1.1.1 患者资料:30位健康体检者、30例T1D患者和30例T1DN患者。排除患有恶性肿瘤、严重心血管病等疾病病史、精神类疾病、具有沟通障碍、病例资料不全的患者。3组受试者男女各半。健康体检者年龄为7~20岁,平均(16.2±4.6)岁;1型糖尿病患者年龄为7~21岁,平均(16.7±4.2)岁;T1DN患者年龄为8~24岁,平均(16.9±5.1)岁。3组受试者的性别和年龄无差异。检测受试者的空腹血糖(FBG)水平。本研究已通过本院伦理委员会的审查(伦理审批号:SYY-SJW1810-005),所有受试者或其监护人均签署研究知情同意书。
1.1.2 动物及试剂:SPF级10周龄野生型(WT)雄性C57BL/6小鼠体质量为22~27 g [陕西省人民医院实验动物中心(SYXK(陕)2016-006)]。链脲佐菌素(STZ,Sigma Aldrich公司);人重组ANXA1(hrANXA1)(武汉艾美捷科技有限公司);胰岛素、尿白蛋白和ANXA1 ELISA试剂盒、天狼星红染色试剂盒、所有抗体(Abcam公司);periodic-acid-schiffs (PAS)染色试剂盒(北京索莱宝科技有限公司);组织裂解缓冲液(Roche公司);BCA试剂盒和超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 受试者血浆ANXA1和CRP水平的检测:通过ELISA检测受试者血浆ANXA1和C反应蛋白(C-reactive protein, CRP)水平,检测方法严格按照ELISA试剂盒说明书进行。
1.2.2 动物的分组及处理:将小鼠随机分为假手术组(sham组,静脉注射等体积0.9 mol/L柠檬酸盐缓冲液)、模型组(model组,静脉注射100 mg/kg的链脲佐菌素溶液,STZ溶解在0.9 mol/L柠檬酸盐缓冲液中,共注射5 d)、人重组ANXA1治疗组(hrANXA1组,将hrANXA1加入到含有140 mmol/L 氯化钠的混合液中,调节pH为7.4,hrANXA1为10 μg/mL。每只小鼠每天腹腔注射100 μL hrANXA1溶液(1 μg),连续治疗8周,每组10只。
1.2.3 口服葡萄糖耐量试验(oral glucose tolerance test, OGTT):在测试前小鼠禁食18 h,检测小鼠的空腹血糖(fasting blood glucose, FBG)水平。然后灌胃葡萄糖溶液(1 g/kg),分别在给药前后每隔15 min通过尾静脉穿刺测量血糖。
1.2.4 心脏功能的评估:给药完成后将小鼠仰卧固定,使用小动物超声成像系统Vevo770记录胸骨旁短轴切面M型超声心动图图像。获取胸骨旁短轴切面M型超声图像。超声测量指标包括EF和FS。
1.2.5 血液和尿液的生化分析:Au400全自动血液生物化学分析仪检查血清尿素和肌酐水平。使用ELISA试剂盒测量血清胰岛素和尿白蛋白水平。
1.2.6 ELISA检测ANXA1含量:通过ELISA试剂盒测定小鼠血清、小鼠心脏和肾脏的蛋白裂解物中ANXA1的浓度。
1.2.7 组织学检测肾脏:将肾脏在10%中性缓冲的甲醛中固定48 h,然后用梯度乙醇脱水。将组织包埋在石蜡中并切成4 μm厚的切片。然后用periodic-acid-schiffs (PAS)染色试剂盒或天狼星红染色试剂盒对组织进行染色,染色方法严格按照生产商说明书进行。
1.2.8 Western blot检测Akt、p38、JNK和ERK1/2蛋白:将小鼠心脏和肾脏组织加入含有蛋白酶抑制剂的裂解缓冲液中裂解。然后用BCA试剂盒测定蛋白质浓度。在SDS-PAGE上分离样品并转移至PVDF膜,5%脱脂牛奶封闭1 h。将膜在4 ℃下与以下一抗过夜孵育:蛋白激酶B(Akt)/p-Akt Ser473、p38/p-p38、c-Jun氨基末端激酶(JNK)/p-JNK、细胞外信号调节激酶(ERK1/2)/p-ERK1/2 Thr202/Tyr204和GAPDH。然后将膜用PBST洗涤3次,将膜在室温下与山羊抗兔二抗孵育1 h。通过超敏ECL化学发光试剂盒进行显影。GAPDH作为内部对照并用于蛋白相对表达量的计算。
1.3 统计学分析
2 结果
2.1 T1D患者的血浆ANXA1和CRP水平
FBG与ANXA1和CRP的交互作用不显著(P<0.05)。与健康体检者相比,T1D患者血浆ANXA1的水平显著降低,而空腹血糖(FBG)和CRP水平显著升高(P<0.05)。并且,T1DN患者的血浆ANXA1水平显著低于T1D患者,而FBG和CRP水平显著高于T1D患者(P<0.05)(表1)。
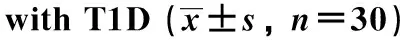
表1 T1D患者的血浆ANXA1和CRP水平
2.2 模型小鼠的口服葡萄糖耐量试验(OGTT)AUC值和血清胰岛素水平
FBG与OGTT AUC(F=159.341,P<0.001)和血清胰岛素(F=347.941,P<0.001)的交互作用显著。通过回归分析对血糖进行校正后,与假手术组相比,模型组FBG和OGTT的AUC值显著升高,而血清胰岛素水平显著降低(P<0.05)。hrANXA1治疗组的FBG和OGTT的AUC值显著降低,而血清胰岛素水平显著升高(P<0.05)(表2)。

表2 小鼠的OGTT AUC值和血清胰岛素水平
2.3 模型小鼠的左室射血分数(ejection fraction, EF)和左室短轴缩短率(fraction shortening, FS)
FBG与EF(F=175.691,P<0.001)和FS(F=441.886,P<0.001)的交互作用显著。通过回归分析对血糖进行校正后,与假手术组相比,模型组的EF和FS值均显著降低(P<0.05)。hrANXA1治疗组的EF和FS值相较于模型组均显著升高(P<0.05)(表3)。
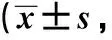
表3 小鼠的EF和FS测量
2.4 模型小鼠的血清尿白蛋白与肌酐比值(ACR)和尿素水平
FBG与ACR(F=212.769,P<0.001)和尿素(F=41.466,P<0.001)的交互作用显著。通过回归分析对血糖进行校正后,与假手术组相比,模型组的血清尿白蛋白与肌酐的比值(ACR)和尿素水平均显著升高(P<0.05)。hrANXA1治疗组的血清ACR和尿素水平较模型组均显著降低(P<0.05)(表4)。

表4 小鼠的血清ACR和尿素水平
2.5 模型小鼠的血清、心脏和肾脏ANXA1水平
FBG与血清ANXA1(F=1637.528,P<0.001)、心脏ANXA1(F=318.354,P<0.001)和肾脏ANXA1(F=112.144,P<0.001)的交互作用显著。通过回归分析对血糖进行校正后,与假手术组相比,模型组血清、心脏和肾脏中ANXA1水平均显著降低。hrANXA1治疗组的血清、心脏和肾脏ANXA1水平均显著高于模型组(P<0.05)(表5)。

表5 小鼠的血清、心脏和肾脏ANXA1水平
2.6 模型小鼠肾脏组织学改变
模型组肾脏组织间隙和脉管系统周围胶原蛋白显著增加,模型组肾脏表现出近曲肾小管细胞扩张,近曲肾小管细胞的S1-S2区段血管变性程度明显增加,肾小球扩大。而hrANXA1治疗组的肾脏组织病理改变明显减轻(P<0.05)(图1)。
2.7 模型小鼠心脏和肾脏组织中Akt、p38、JNK和ERK1/2信号通路的活化情况
与假手术组相比,模型组心脏和肾脏组织中Akt磷酸化水平显著降低,而MAPK的3个亚族(p38、JNK和ERK1/2)的磷酸化水平均显著升高(P<0.05)(图2)。与模型组比较,hrANXA1治疗组的心脏和肾脏组织中Akt磷酸化水平显著升高,而p38、JNK和ERK1/2的磷酸化水平均显著降低(P<0.05)(图3)。
3 讨论
ANXA1参与调节许多细胞生命活动,包括细胞增殖、分化、迁移、凋亡和信号传导等。近年来,发现ANXA1参与心脏病、脑梗死和动脉粥样硬化等多种疾病。糖尿病及肾功能不全患者中ANXA1的表达水平降低,并且其可调节糖尿病肾病的进展。本研究发现ANXA1的表达水平在T1D患者中降低,并且伴有肾病患者的ANXA1水平更低。此外,T1D患者的血浆CRP升高。已知CRP升高与心肌梗死、卒中和冠心病的不良结局密切相关,并且CRP升高也是T1D患者病情恶化的常见标志。另外,T1D小鼠模型小鼠血清、心脏和肾脏中的ANXA1水平都降低,与T1D患者的变化一致。其他研究者发现外源性人重组ANXA1(hrANXA1)和Ac2-26肽(ANXA1的N端功能片段)在治疗非酒精性脂肪性肝炎和动脉粥样硬化中具有良好效果[7-8]。本研究中,小鼠经过hrANXA1治疗后,血清、心脏和肾脏ANXA1水平均显著提高。

图1 小鼠肾脏组织天狼星红染色和PAS染色Fig 1 Sirius red staining and PAS staining of mouse kidney tissue
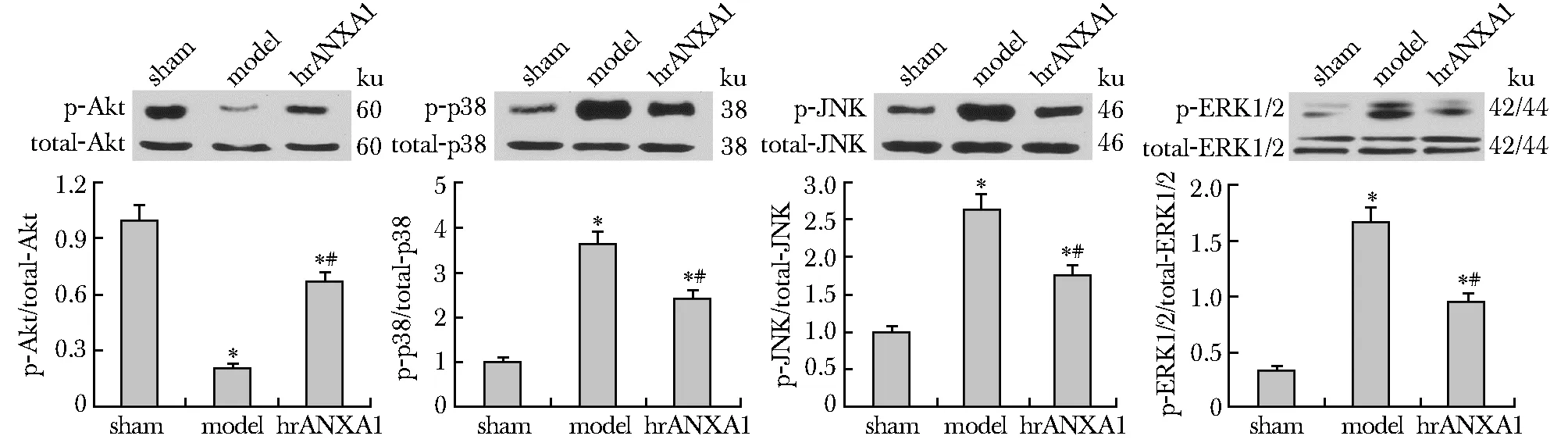
*P<0.05 compared with sham group; #P<0.05 compared with model group图2 小鼠心脏中Akt、p38、JNK和ERK1/2信号通路的磷酸化情况Fig 2 Phosphorylation of Akt, p38, JNK and ERK1/2 signaling pathways in mouse heart n=10)
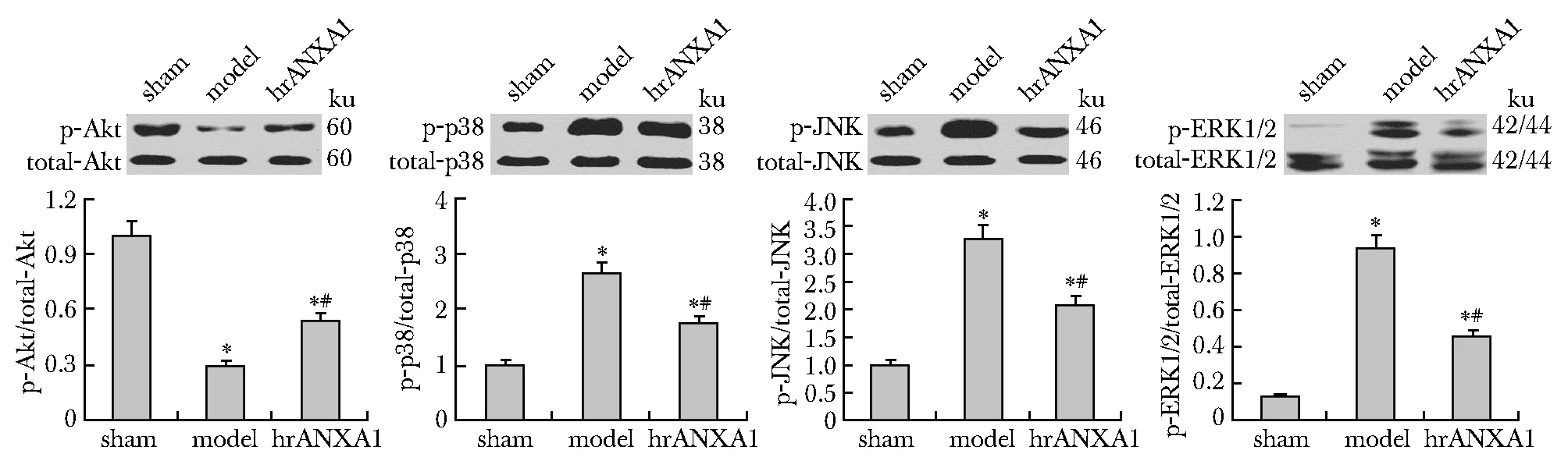
*P<0.05 compared with sham group; #P<0.05 compared with model group图3 小鼠肾脏中Akt、p38、JNK和ERK1/2信号通路的磷酸化情况Fig 3 Phosphorylation of Akt, p38, JNK and ERK1/2 signaling pathways in mouse kidney n=10)
有学者发现外源性ANXA1预培养胰岛可增强葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion, GSIS),此外,使用ANXA1进行胰岛预培养可增加糖尿病小鼠的血糖调节能力[9]。本研究中,经hrANXA1治疗后,小鼠的OGTT AUC值显著降低,而血清胰岛素水平显著升高。说明外源性hrANXA1对胰岛功能具有一定的促进作用。
高血糖症会导致促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号的活化,并引起心脏和肾脏肥大和纤维化[10]。MAPK信号通路的激活可促进组织和器官中的炎性反应和纤维化。抑制MAPKs可减少啮齿动物中由T1D引起的微血管并发症[11]。本研究发现,经hrANXA1治疗后,T1D小鼠心脏和肾脏组织中MAPK的3个亚族(p38、JNK和ERK1/2)的磷酸化水平均显著降低。因此,推测这些已知的促炎性和纤维化信号通路的过度激活是T1D的关键驱动因素。用hrANXA1治疗T1D小鼠可通过抑制MAPK信号来减轻高血糖、炎性反应、纤维化引起的器官功能障碍。
Akt是磷酸肌醇3激酶(phosphatidylinositol 3-kinase, PI3K)信号传导途径的成员。胰岛素信号通过IRS-1调节PI3K活性,PI3K可以激活Akt从而控制炎性反应[12]。多项研究证实,Akt生存途径的激活可减少器官损伤。此外,激活Akt可以有效减少心脏和肾脏组织坏死[13]。本研究发现,经hrANXA1治疗后,小鼠心脏和肾脏组织中Akt磷酸化水平显著升高。说明外源性hrANXA1可通过激活Akt生存途径来保护T1D小鼠的心脏和肾脏。
总之,本研究表明T1D患者血浆中ANXA1水平降低。外源性hrANXA1治疗对T1D小鼠心脏和肾脏的保护作用与抑制MAPK信号通路和激活Akt生存途径有关。
