X线对秀丽隐杆线虫DNA损伤修复基因表达的影响
2021-04-17陈利娜
陈利娜,刘 志,张 超
(1.南方医科大学 基础医学院 生化与分子生物学教研室,广东 广州 510515; 2.南方医院 超声科,广东 广州 510000;3.湘南学院 基础医学院,湖南 郴州 423000)
放射治疗(radiotherapy)常用于肿瘤治疗,然而电离辐射在杀伤肿瘤细胞时也会损伤正常组织和细胞,提高肿瘤细胞对辐射的敏感性是提高肿瘤细胞杀伤效率和减少健康细胞损伤的关键。电离辐射(ionizing radiation)是一种有效的DNA损伤因子,可导致细胞生物损伤[1]。众多基因和通路可影响肿瘤放疗效果,研究与DNA损伤密切相关的基因是寻找放疗靶基因的方法之一。
秀丽隐杆线虫(caenorhabditis elegans,C.elegans)有许多高度保守的与人类癌相关的基因和通路,且对电离辐射表现出较高的敏感性,是一种理想的电离辐射研究模型[2]。本研究采用X线照射秀丽隐杆线虫,检测DNA损伤修复相关基因的表达,以及线虫死亡率、生育力变化,探讨辐射损伤修复的分子机制,为寻找放疗潜在靶点提供理论依据。
1 材料与方法
1.1 材料
野生型秀丽隐杆线虫N2、大肠杆菌OP50(华南农业大学赠予);NGM培养基、M9缓冲液按照参考文献[3]配制而成,RNAiso Plus试剂、反转录试剂和SYBR®PCR试剂盒(TaKaRa公司);PCR引物(广州嘉吉生物科技有限公司)。
1.2 方法
1.2.1 秀丽隐杆线虫的培养及计数:取50条产卵期秀丽隐杆线虫接种至培养有大肠杆菌菌株OP50的NGM琼脂平板,于20 ℃培养箱中培养2~3 h,挑走母虫后继续培养24 h。线虫计数采用稀释法:M9缓冲液冲洗收集培养皿中线虫至离心管,稀释50倍,62 ℃水浴1 min后混匀,取1 mL线虫悬液至画好方格的35 mm的培养皿,在体式显微镜下放大100倍对线虫计数,计数重复3次,取平均值,再乘以稀释倍数即为线虫总数。
1.2.2 秀丽隐杆线虫的电离辐射:线虫计数后将线虫悬液离心使线虫沉淀,弃去上清,加入相应体积的M9缓冲液,使得线虫悬液的浓度为5 000条/200 μL。在含有OP50的NGM培养基中加入5 000条线虫(200 μL),培养48 h后成虫繁殖到约80 000条时进行辐射。使用日立MBR-1520R型X线辐射装置(Hitachi Co., LTD)调节辐射强度为20 Gy/min,并增加滤片使照射场强均一。辐照时敞口垂直于束流方向放置,置于正对着束流方向的培养基表面分别照射10 min和20 min,累计辐射剂量分别为200 Gy和400 Gy。实验重复3次。
1.2.3 实时荧光定量PCR检测基因表达:RNAiso Plus试剂提取线虫总RNA,反转录试剂盒将合格的总RNA反向转录成第一链cDNA。使用SYBR®PCR试剂盒在ABI公司7500型实时PCR扩增仪上进行实时qPCR。内部参照基因采用gpd-1。用于PCR的基因和引物见表1。2-ΔΔCt值反映基因相对表达量。实验重复3次。

表1 PCR引物序列Table 1 PCR primer sequences
1.2.4 秀丽隐杆线虫死亡率和繁殖力的检测:线虫经200 Gy X线照射后2 h内取约5 000条线虫(200 μL)转移至加有400 μmol/L 5-氟脱氧尿苷(FUDR)的NGM培养基,以抑制卵的孵出。继续培养2 d后对活线虫计数。线虫死亡率计算公式如下:[Δ存活数/存活数(辐射前)]×100。线虫经200 Gy X线照射后2 h内取约5 000条线虫(200 μL)转移至新NGM培养基,培养2 d后对活的子代幼虫计数,反映线虫的繁殖力。线虫计数时,于体式显微镜下观察其形态和运动情况,呈正弦曲线样运动的线虫为活线虫;丧失运动能力, 咽泵停止运动,多次碰触无反应的线虫为死亡的线虫。
1.2.5 辐射相关基因相互作用网络的分析:将辐射后表达差异基因导入蛋白质相互作用关系数据库STRING (https://string-db.org/),并选择种类为C.elegans,分析各基因编码蛋白之间的相互作用及关键节点蛋白质。
1.3 统计学分析
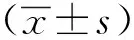
2 结果
2.1 X线影响秀丽隐杆线虫多个基因的表达
X线照射后12个基因(ced-3、ced-4、ced-9、egl-1、cep-1、rad-51、age-1、daf-2、daf-16、ctl-1、clk-1和spe-26)表达量增加,2个基因(mev-1、hsp-12.2)表达量减少。多组比较结果显示,400 Gy组中有8个基因(ced-3、ced-4、ced-9、rad-51、age-1、daf-2、ctl-1、spe-26)的表达明显高于200 Gy组。实验组的4个基因(ced-4、cep-1、rad-51、daf-2)表达量明显高于对照组。200 Gy组基因mRNA表达量的倍数变化如下:ced-4(2.861±0.243)、cep-1(5.540±1.889)、rad-51(5.530±0.647)、daf-2(4.453±0.686)。400 Gy组数据如下:ced-4(9.644±1.022)、cep-1(10.140±1.150)、rad-51(19.017±2.627)、daf-2(8.948±0.907)(图1)。
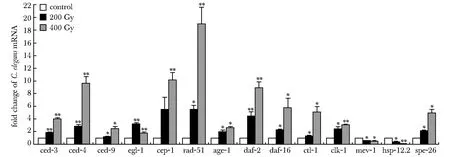
2.2 X线导致秀丽隐杆线虫死亡率增加、繁殖力下降
与对照组相比,200 Gy组的线虫存活率明显下降。200 Gy X线导致线虫77.23%死亡率(图2A)。对照组培养2 d后平均产生线虫后代数是200 Gy组的2.90倍(图2B)。
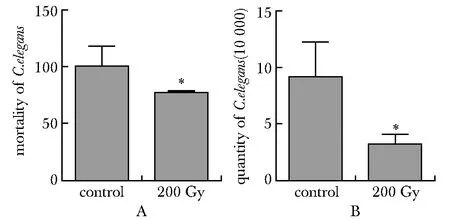
2.3 秀丽隐杆线虫辐射相关基因的相互作用
12个基因之间具有相互作用,并显著分为两组作用密切的基因群。其中,age-1、daf-16和ced-9分别为两组基因的中心节点。daf-16和cep-1为两组基因的关联基因(图3)。
3 讨论
电离辐射可促进细胞周期阻滞和DNA修复,诱导细胞凋亡。在真核细胞中产生特定生物效应所需的电离辐射剂量与细胞基因组含有基因数的多少成反比,秀丽隐杆线虫模型用于研究电离辐射特性时所需的剂量远大于哺乳动物[4]。本研究中X线辐射线虫的半致死剂量为200 Gy[5],故辐射剂量定为200 Gy和400 Gy。
Expression levels, relative to gpd-1( a type of housekeeping gene ), were determined by quantitative real time RT-PCR; *P<0.05,**P<0.01 compared with controls
A.mortality; B.fertility;*P<0.05 compared with controls图2 X线对秀丽隐杆线虫的影响Fig 2 Effect of X-ray on n=6)
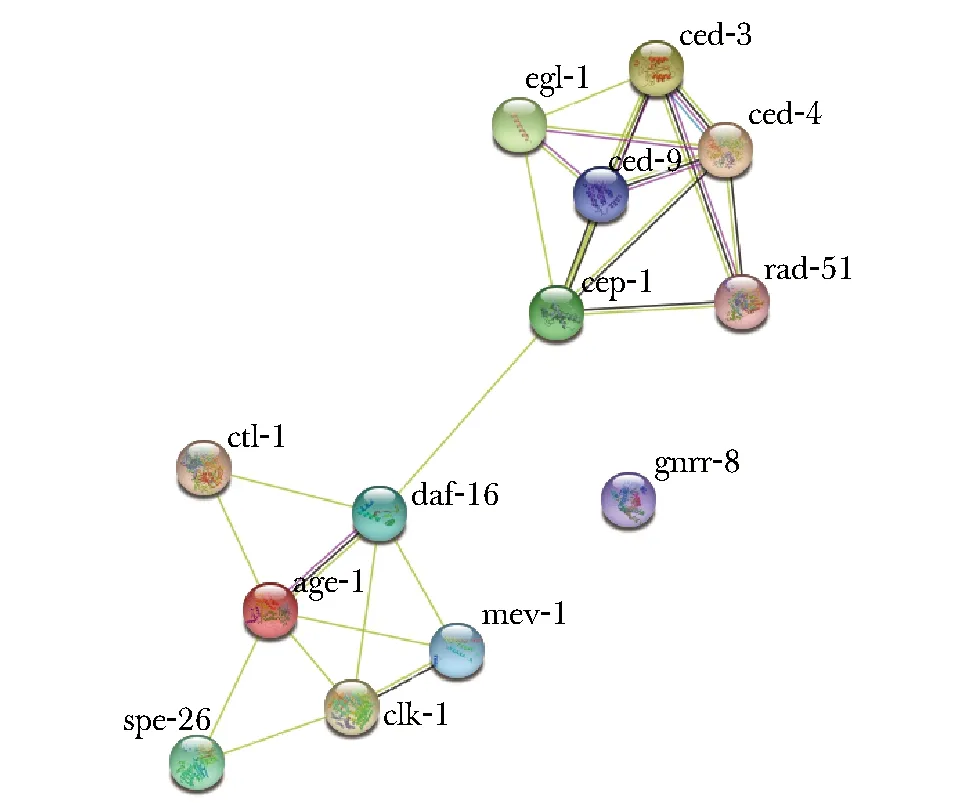
图3 辐射相关基因的蛋白相互作用图Fig 3 Protein interaction of radiation related genes
egl-1可使ced-9失活,从而拮抗apaf-1同源基因ced-4激活caspase同源基因ced-3的能力。此外,p53同源基因cep-1可以激活egl-1和ced-13的转录。因此,cep1、egl-1、ced-3、ced-4和ced-9等基因的相互作用形成了调控秀丽线虫程序性细胞死亡和DNA损伤诱导的生殖细胞死亡的核心凋亡通路[6-8]。本研究中,线虫辐射后存活数减少,凋亡相关基因ced-3、ced-4、cep-1表达量显著增加,且随辐射剂量增加而大幅度增加。基因相互作用分析结果显示,cep-1、ced-4、rad-51关联密切。提示这3个基因对电离辐射敏感度高,可能是X线诱导细胞凋亡的核心基因。
进化生物学表明,繁殖需要付出降低寿命的成本,线虫延长寿命基因的改变会导致生育能力下降[9-10]。mev-1突变体使秀丽隐杆线虫平均寿命缩短30%,age-1、clk-1和spe-26、hsp-12.2的突变体,可改变秀丽隐杆线虫的年龄特异性死亡率和生育率[11-12],胰岛素信号通路可提高秀丽隐杆线虫的繁殖力[13]。daf-2是一种类似于胰岛素受体的基因,调节秀丽隐杆线虫的寿命和滞育。daf-16可加强线虫生殖细胞损伤的适应。daf-2和daf-16都是胰岛素信号通路的重要成员,对秀丽隐杆线虫的繁殖力起关键作用[14]。本研究中,经辐射处理后的线虫成活率较低,经过2 d培养后产生线虫的后代总数较少,说明200 Gy X线导致秀丽隐杆线虫的死亡率较高,生育力较低。结合辐射后线虫基因表达的变化,推测X线致使daf-2和daf-16异常高表达,从而抑制胰岛素信号通路,降低线虫生殖质量,抑制线虫繁殖。X线可显著提高线虫daf-2、age-1、clk-1、spe-26的表达,从而改变线虫的死亡率和生育能力。
综上所述,X线可影响秀丽隐杆线虫多个DNA损伤修复基因的表达,并导致线虫死亡率增加、繁殖力下降。age-1、cep-1、ced-4、rad-51和daf-2等基因对X线敏感,可能成为潜在的放疗靶点。
