普罗布考经Nrf2/Gpx4途径抑制铁死亡保护H9C2心肌细胞*
2021-04-17钟桂玲李文祥李仕来朱继金
钟桂玲,李文祥,王 贺,陈 丰,李仕来△,朱继金△
(广西医科大学第一附属医院 1.心血管内科;3.急诊科,南宁 530021;2.山东大学齐鲁医学院,济南 250012)
铁死亡是细胞死亡的一种独特的调节机制,由Dixon等[1]于2012年在《cell》杂志上首次提出。铁死亡与其他形式的细胞死亡形式不同,它不依赖于caspase,典型特征是铁依赖的脂质活性氧(ROS)的增加以及线粒体形态的改变。缺血性心脏病(ICM)多发生于冠心病的晚期阶段,具有发病率高、死亡率高的特点,再灌注治疗目前仍然是治疗ICM的唯一有效治疗方法。缺血后再灌注治疗,可以增加缺血心肌的血液供应,但会导致再灌注后心肌组织损伤和氧化应激升高而引起的心率失常[2]。铁死亡参与许多疾病的病理生理过程,在肿瘤和多种器官发生缺血再灌注损伤(I/R)时广泛存在[3],尤其是心脏I/R[4]。核因子E2相关因子2(Nrf2)和谷胱甘肽过氧化物酶4(Gpx4)是铁死亡的关键调节因子,Nrf2 及Gpx4的下调会引起细胞内氧化和抗氧化系统失衡,导致胞内ROS 增多,造成细胞死亡[5]。铁死亡诱导剂RSL3 可通过抑制Gpx4 的表达导致脂质过氧化物及脂质ROS 的积累,进而引起H9C2 心肌细胞发生铁死亡[6]。因此,可以通过升高Nrf2或Gpx4的蛋白表达来维持细胞内的氧化还原稳态,从而抑制铁死亡。
研究表明,亲脂性抗氧化剂能够抑制铁依赖的脂质过氧化物及脂质ROS 的积累,包括维生素E、Ferrostatin-1、Liproxstatin-1 和可能有效的生物活性多酚[7]。普罗布考(probucol)是一种有效的抗氧化剂,临床上用于降低血清胆固醇,根据probucol的这些特点,本研究旨在探讨probucol抑制RSL3诱导的H9C2心肌细胞铁死亡的有效性及其可能的作用机制。
1 材料与方法
1.1 主要药物和试剂 H9C2大鼠心肌细胞购于武汉普诺赛生物技术有限公司,probucol(sellck S2119),RSL3(sellck S8155),澳洲胎牛血清FBS(HyClone 30087.02),DMEM 培养基(HyClone SH30243),CCK8 试剂盒(碧云天),ROS 检测试剂盒(碧云天S0033S),Anti-Gpx4 antibody(Abcamab125066 1 ∶10 000),Anti-Nrf2 antibody(Abcamab92946 1 ∶1 000),Anti-GAPDH antibody(CST2118S 1∶1 000),Anti-rabbit IgG,HRP-linked antibody(CST 7074S 1∶3 000)。
1.2 细胞培养 将H9C2心肌细胞培养于含10%胎牛血清和1%青霉素-链霉素溶液的高糖DMEM完全培养基内,放入5% CO2,37 ℃细胞培养箱中孵育。每天观察细胞的数量与形态,当细胞增殖至合适数量时,进行细胞传代。
1.3 实验分组和细胞活性检测 测定RSL3的半数抑制浓度(IC50):将对数生长期的H9C2 细胞接种于96孔板中,每孔1×104个细胞。铺板24 h后,每组设置3 个复孔,设9组,分别为DMSO组、RSL3(0.195 μmol/L、0.39 μmol/L、0.78 μmol/L、1.56 μmol/L、3.125 μmol/L、6.25 μmol/L、12.5 μmol/L、25 μmol/L)组,加RSL3后在培养箱中培养12 h后,使用多通道移液器吸走旧培养基,每孔加入100 μL 含有10 μL CCK8 溶液的培养基。放入5%CO2培养箱中37 ℃培养2 h,用酶标仪测定OD 值,通过GraphPad Prism 8.0 软件分析数据,测定RSL3 的IC50。摸索probucol的最佳干预浓度,同上方法细胞铺板后24 h,设10组,分别为DMSO组、RSL3(IC50)组、RSL3(IC50)+probucol(0.78 μmol/L、1.56 μmol/L、3.13 μmol/L、6.25 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L)组。在培养箱中培养12 h 后,用同样的方法测定细胞活性,筛选出probucol 的最佳干预浓度。使用RSL3的IC50和probucol的最佳干预浓度,处于对数生长期的H9C2 心肌细胞随机分为 4组:对照组(DMSO组)、RSL3(IC50)组、RSL3(IC50)+probucol(最佳干预浓度)组、probucol(最佳干预浓度)组。
1.4 细胞内ROS流式检测 将对数生长期的H9C2细胞接种于6孔板中,每孔5×105个细胞,每组设置3个复孔,接种24 h 后加入RSL3 与probucol 共处理,培养12 h后,在显微镜下观察细胞的形态特征。吸掉原来培养基,PBS 清 洗1 次,加 入10 μmol/L DCFH-DA 荧光探针,37 ℃孵育20 min,弃去上清,用不含EDTA的胰酶把细胞消化下来转移到离心管中,1 000 g,4 ℃离心5 min,弃上清,PBS 清洗2 次,最后用PBS 重悬,放入冰盒避光,利用流式细胞仪定量ROS水平。
1.5 Western blotting 试验检测各蛋白含量 RIPA裂解液及蛋白酶抑制剂(PMSF)按100∶1 的体积配置细胞裂解液,随后将裂解液加入6 孔板中以充分裂解细胞。蛋白样品用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到聚偏二氟乙烯(PVDF)膜上。转膜完成后,将PVDF 膜置于5%脱脂牛奶中,常温下封闭1 h。然后,加入一抗(Anti-GAPDH antibody,1∶1 000),置于4 ℃冰箱孵育过夜。回收一抗,用TBST 清洗3 次,5 min/次。常温下二抗(Anti-rabbit IgG,HRP-linked antibody,1∶3 000)孵育1 h,用TBST 清洗3 次,8 min/次。将配制的ECL 化学发光液滴至PVDF 膜表面,于凝胶成像分析系统中曝光及采集图像。使用Image J 软件分析蛋白条带灰度值。
1.6 统计学方法 采用GraphPad Prism 8.0 软件对数据进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,若方差齐,进一步采用Bonferroni 法进行两两比较;若方差不齐,采用Kruska-Wallis H秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 probucol抑制RSL3诱导的H9C2心肌细胞铁死亡 用浓度梯度的RSL3处理H9C2心肌细胞12 h,根据细胞活性结果,计算出RSL3 的IC50 为1.406 μmol/L(图1A)。DMSO组、RSL3(IC50)组、RSL3(IC50)+probucol(0.78 μmol/L、1.56 μmol/L、3.13 μmol/L、6.25 μmol/L、12.5 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L)组的细胞存活率分别为(100±4.21)%、(45.63±3.11)%、(40.69±2.68)%、(42.72±6.30)%、(52.71±3.41)%、(58.81±2.62)%、(75.74±2.16)%、(90.74±3.38)%、(96.95±2.61)%、(97.45±4.57)%。当probucol 浓度为50 μmol/L 时,与DMSO组比较,差异无统计学意义(P>0.05),见图1B、图1C。因此,probucol 的最佳干预浓度为50 μmol/L。
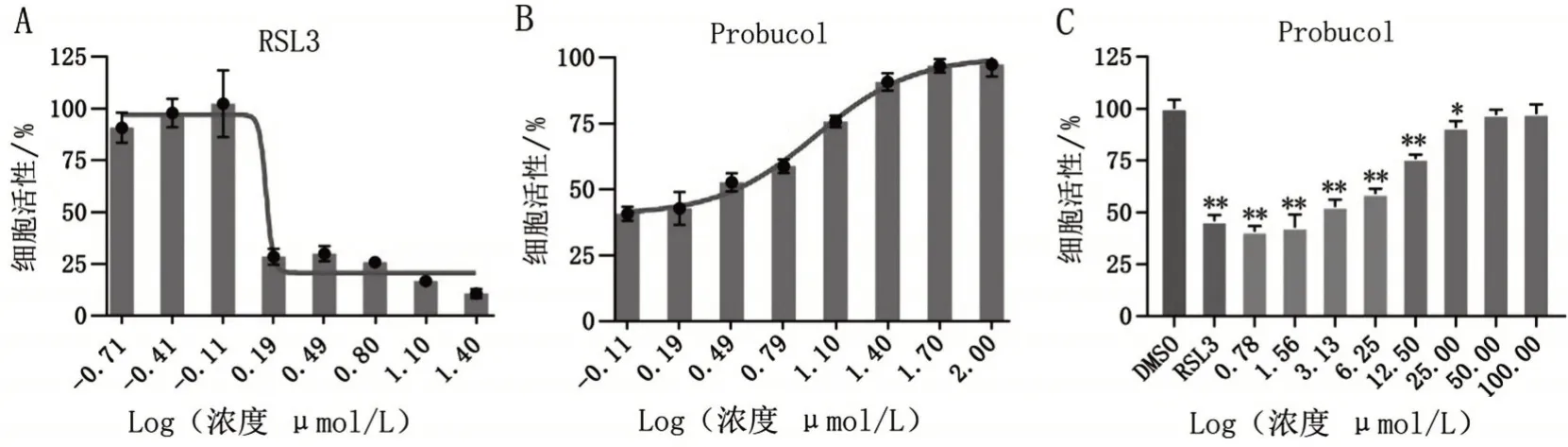
图1 CCK8检测H9C2大鼠心肌细胞活性
2.2 probucol改善H9C2细胞形态结构 光镜下观察细胞形态,DMSO组细胞形态呈梭型,长势良好,贴壁性好,折光度强;RSL3组的细胞皱缩、贴壁性差,折光度减弱;RSL3+probucol组细胞状态明显改善,与DMSO组细胞形态基本相似;与DMSO组相比,probucol组的细胞形态无明显变化,见图2。
2.3 probucol 降低胞内ROS 的产生 DMSO组和probucol组细胞内的ROS 浓度比较,差异无统计学意义(P>0.05);与DMSO组比较,RSL3组细胞内ROS 升高(P<0.05);与RSL3组比较,RSL3+probucol组细胞内ROS 明显下降(P<0.05)。结果表明,probucol 可降低细胞内ROS 的产生,减轻细胞内氧化应激反应(表1、图3)。
2.4 probucol通过升高Nrf2、Gpx4蛋白水平保护心肌细胞免受RSL3 诱导的铁死亡 与DMSO组相比,RSL3组Nrf2和Gpx4蛋白的表达降低,probucol组Gpx4 蛋白的表达升高(P<0.05);与RSL3组相比,RSL3+probucol组Nrf2、Gpx4 蛋白的表达水平显著升高(P<0.05)。值得注意的是,单加probucol也能升高细胞内的Gpx4蛋白的表达水平,见图4。

图2 光镜下观察H9C2大鼠心肌细胞形态(100×)
表1 probucol治疗后各组细胞内ROS的产生情况 %,
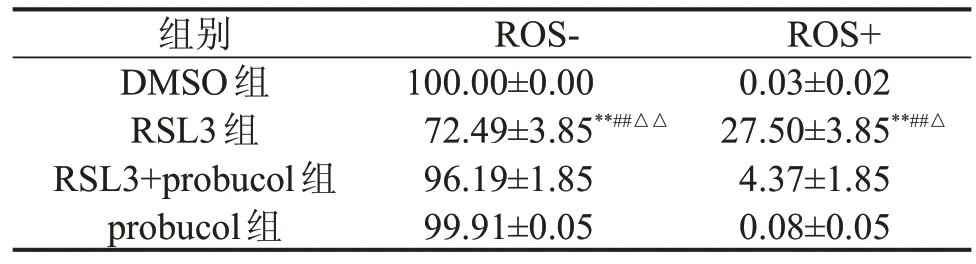
表1 probucol治疗后各组细胞内ROS的产生情况 %,
与DMSO组比较,**P<0.001;与RSL3+probucol组比较,##P<0.001;与probucol组比较,△△P<0.001,△P<0.05。
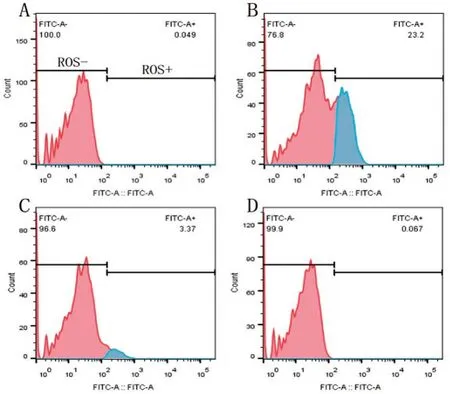
图3 流式细胞仪检测H9C2大鼠心肌细胞ROS的含量
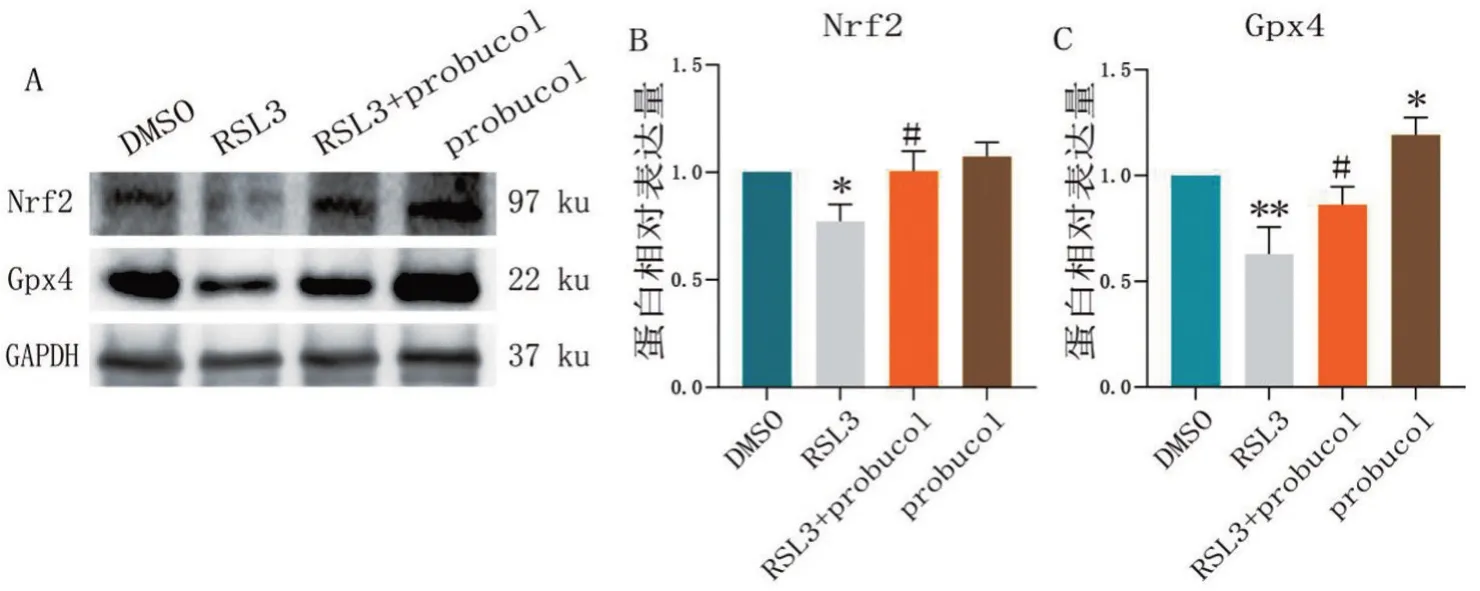
图4 各组Nrf2、Gpx4的蛋白表达情况
3 讨论
心肌I/R指部分或完全阻塞的冠状动脉重新获得再通时,缺血心肌恢复正常灌注,但其组织损伤反而呈进行性加重的病理过程。经典的I/R损伤发生了离子堆积、线粒体膜损伤、ROS形成、内皮功能障碍、血小板聚集、免疫激活、细胞凋亡和自噬等多种病理生理过程,这些病理过程导致心肌组织的结构和功能发生改变[8-9]。近期研究发现,铁死亡在I/R中也发挥着重要作用,Baba等[10]首次证实在活体I/R期间,心肌细胞和非心肌细胞发生铁死亡,抑制I/R期间心肌细胞反生铁死亡,可以有效的减少梗死面积和心肌损伤的血清标记物,改善心脏重构[9]。
铁死亡在形态、生化、基因表达方面不同于传统的凋亡、坏死、自噬。铁死亡的形态特征为线粒体缩小、膜密度增高及线粒体嵴减少或消失,分子特征为细胞内的铁过载及脂质ROS 的积累[1,11]。目前,铁死亡发生机制涉及铁代谢、脂质代谢及System Xc--GSH-GPX4等抗氧化途径,各途径之间的失衡会破坏胞内氧化还原的稳态,产生过量的脂质过氧化物及脂质ROS,从而诱发铁死亡[12]。RSL3是一种铁死亡诱导剂,可直接抑制Gpx4表达,降低Gpx4含量,导致大量的脂质过氧化物和ROS 产生,从而引起细胞铁死亡[13]。因此,本研究采用了RSL3诱导H9C2大鼠心肌细胞发生铁死亡的体外模型。
probucol是一种有效的抗氧化剂,从结构上看,probucol 有14 个亲脂性甲基且结构对称,具有强脂溶性的特点,可以有效穿越细胞膜进入胞内。分子中的2 个抗氧化活性基团-酚羟基,不仅抗氧化能力强,而且与自由基结合后形成不可逆的联苯醌可以有效的抗脂质氧化[14]。probucol 作为一种成熟的临床用药,多年来被用作抗动脉粥样硬化药物[15-16],表现出良好的安全性,有利于新适应证的临床转化。最近,有人研究probucol 的类似物RC363 和RC574 能够有效的抑制铁死亡,低剂量(3 μmol/L)的probucol在HT22细胞中无法抵抗铁死亡,但可以显著增加GPX 酶活性以及小幅度的增加GPX1 的含量[17],不影响脂蛋白谱并保护低密度脂蛋白的氧化修饰,且抑制脂质过氧化[16]。在本研究中,低剂量的probucol无法抑制RSL3诱导的铁死亡,但是随着probucol 浓度的增加,H9C2 心肌细胞的活性也增加,当probucol 浓度为50 μmol/L 时,细胞形态显著改善。且单独给予H9C2 心肌细胞probucol 处理时并不影响细胞形态。在RSL3 处理中同时加入probucol治疗可以减少H9C2心肌细胞中ROS的产生,减轻细胞内的氧化应激,这与先前的研究结果一致,probucol能有效的抗氧化[16,18]。
Zhou 等[19]的研究表明,probucol 可以通过激活Nrf2 信号通路,抑制脊髓损伤后的氧化应激,抑制细胞凋亡。研究显示,probucol 可以抑制高糖条件下细胞内ROS 的产生,提示probucol 可能通过上调Nrf2 减轻糖尿病视网膜神经元变性[18,20]。Nrf2 是一种转录调节因子,到目前为止,几乎所有与铁死亡相关的基因都直接或间接受到Nrf2的转录调控,包括谷胱甘肽调节基因、NADPH 的生成以及铁调节基因[21],已被证明在ICM 的治疗和铁死亡的调节中起关键作用[22-23]。Gpx4 是Nrf2 的下游靶点,许多完整的谷胱甘肽合成和代谢相关酶都在Nrf2 的调控下,包括谷氨酸半胱氨酸连接酶(GCLC/GCLM)的催化和调节亚基(GCLC/GCLM)、谷胱甘肽合成酶(GSS)和胱氨酸/谷氨酸转运体XCT(SLC7A11)的一个亚基。此外,许多Nrf2靶基因参与阻止脂质过氧化的形成和铁死亡的进展,以及一些参与Nrf2信号通路的蛋白本身也是脂质过氧化的直接靶点[24]。本研究结果显示,50 μmol/L 的probucol 可以保护H9C2 大鼠心肌细胞免受RSL3 诱导的铁死亡,probucol 可以升高RSL3 处理后的Gpx4 蛋白水平(P<0.05),这可能是probucol 通过Nrf2 信号通路影响Gpx4 的水平保护心肌细胞。而且单独给予probucol 也能增加H9C2 细胞内的Gpx4 蛋白水平,这是否使probucol 能成为心梗患者的预防用药,增强机体的抗氧化能力,值得进一步研究。
综上所述,probucol 可能通过上调Nrf2、Gpx4的表达来拯救H9C2 心肌细胞的细胞活性,降低细胞内ROS 的产生,从而减低细胞氧化应激,提高其自身的抗氧化能力。然而,铁死亡在心脏I/R 中是多环节构成、多因素参与的复杂过程,probucol是否存在其他方面的机制抑制铁死亡,有待进一步研究。
