乳腺癌液实性区表观扩散系数与分子亚型及免疫组化因子的相关性研究*
2021-04-17李红学刘军杰邓文娟苏丹柯
赵 阳 ,李红学,刘军杰,王 琛,康 巍,邓文娟,苏丹柯
(广西医科大学附属肿瘤医院 1.医学影像中心;2.超声科,南宁 530021)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率呈上升之势[1]。其肿瘤相关致死率仅次于肺癌,高居第二位[2]。在乳腺癌的诊疗过程中,除了其鉴别诊断外,进一步对乳腺癌分子亚型、免疫组化因子的确切评估,与乳腺癌放化疗、内分泌、靶向等治疗方案的确定密切相关,同时对患者预后结局的判断也是至关重要的一环。基于Ki-67、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)、雌激素受体(estrogen receptor,ER)、孕激素受体(progestogerone receptor,PR)不同免疫组化因子的表达情况,乳腺癌可分为Luminal A、Luminal B、HER-2过表达以及三阴性,其中Luminal B依据HER-2 表达情况又可进一步细分为Luminal B1、Luminal B2。术前对乳腺癌各种免疫组化因子的诊断主要依赖于活检穿刺,由于穿刺位置的不准确、穿刺组织的不足,在一定程度上会造成使得穿刺结果存在误差;此外,活检穿刺属于有创性操作,现实操作中需考虑到患者的接受度。磁共振成像是乳腺癌较为常规的影像学检查方案,其软组织分辨率较高,且能进行功能学及多参数成像,故而能以宏观影像学表现反映微观病理变化,无创、动态获取更多的诊断信息[3]。扩散加权成像(diffusion weighted imaging,DWI)作为磁共振在乳腺检查上的常用序列,其机制在于能够反映活体组织内水分子的扩散受限情况,并以表观扩散系数(apparent diffusion coefficient,ADC)进行量化分析。DWI 对乳腺癌分子亚型的评估已见诸文献报道,然而其ADC值的测量避开病变液性区域,或纳入整个瘤灶分析,缺乏对瘤灶液性区域ADC 值的单独考虑[4-6]。瘤灶液性区是提示乳腺癌生物学浸润性的重要征象[7],还与其较高的病理级别[8]、淋巴结转移[9]及术后复发[10]密切相关;此外,此类乳腺癌患者新辅助化疗效果较差[11]。有鉴于此,本研究在既往研究的基础上[4-6],进一步探讨液性区ADC值以及液性区与实性区ADC比值对诊断乳腺癌分子亚型的价值,并分析不同ADC值与乳腺癌免疫组化分子的相关性,以期为临床提供更多的参考依据。
1 对象与方法
1.1 研究对象 选取2017年1月至2019年12月广西医科大学附属肿瘤医院诊治的乳腺癌患者进行回顾性分析。纳入标准:(1)患者行MRI检查时,未接受放化疗;(2)3.0T MRI 检查存在液实性区影像学表现(液性区为T2 高信号,增强无强化的区域);(3)病理确诊乳腺癌,并有Ki-67、ER、PR、HER-2 完整资料可进行亚组分型。排除标准:(1)合并其他恶性肿瘤或远处转移;(2)影像学资料治疗欠佳或出现缺失;(3)MR检查与手术时间超过15 d。共计入组乳腺癌患者60例,均为女性,年龄29~86 岁,平均(49.10±11.25)岁。
1.2 方法
1.2.1 MRI检查参数 采用GE 3.0 T超导型磁共振扫描仪(GE Discovery 750w)和8通道乳腺专用相控阵线圈。检查时,患者取俯卧位,双乳自然下垂。检查序列包括:T1WI-GRE序列(TR/TE 640/7.6 ms,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm)、T2WI-FSE IDEAL 序列(TR/TE 6 800/85 ms,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm)、VIBRANT-DCE(TR/TE 4.5/2.1 ms,FOV 36 cm×36 cm,层厚4 mm,层间距1 mm)、DWI(TR/TE 5 000/92.6 ms,FOV 32 cm×32 cm,层厚4 mm,层间距1 mm,b 值0 s/mm2、1 000 s/mm2)。
1.2.2 ADC值测量 ADC值的测量在机器配套的后处理工作站(GE AW 4.6)进行。液性区ADC 值,依据常规T1WI、T2WI 以及DCE 序列,选取液性区(长T1、长T2,DCE 无强化)最大层面,并加上其上下两个层面,在3 个层面内各勾画3 个感兴趣区域(region of interest,ROI),取9 个ROI 的均值作为液性区ADC 值(ADC液性区);同理,在实性区获取实性区ADC 值(ADC实性区);最后,计算两者的比值(ADC比值=),见图1。以上操作均由两名具备5年以上乳腺影像诊断经验的放射科医师共同阅片,结果存在疑义时,经商讨达成一致。
1.3 病理检查
病理科医师半定量判定免疫组化结果:ER、PR阳性是指任何核染色阳性。HER2 阳性为>10%的癌细胞膜完整的染色。Ki-67阳性为阳性细胞核的比例>1%。依据免疫组化检测结果判定分子亚型。肿瘤分子亚型分为Luminal A 型[ER+和(或)PR+、HER2-、Ki-67<14%],Luminal B1 型[ER 和(或)PR+、HER2-、Ki-67≥14%或PR≤20%],Luminal B2 型[ER 和(或)PR+、HER2+、Ki-67 任何状态],HER-2 过表达型(ER-、PR-、HER2+)及三阴性型(ER-、PR-、HER2-)。
1.4 统计学方法 采用R 语言(https://www.r-project.org/)进行数据统计学分析。计量资料以均数±标准差()表示,组间比较采用方差分析,两两比较采用LSD-t检验,采用“DescrTab2”程序包对乳腺癌分子亚型间不同ADC 值进行单因素分析,以“ggplot”程序包绘制分子亚型间不同ADC 值分布的小提琴图。采用Spearman 秩相关分析不同ADC 值与Ki-67、ER、PR以及HER-2的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 不同乳腺癌分子亚型ADC值比较 在60例乳腺癌患者中,Luminal B1 型27例,年龄(46.22±10.03)岁;Luminal B2 型15例,年龄(49.87±11.38) 岁;HER-2 过表达型11例,年龄(51.73±6.53) 岁;三阴性型7例,年龄(54.43±18.73)岁。各分子亚型年龄比较,差异无统计学意义(F=1.360,P=0.264)。在4 种分子亚型中,ADC液性区的组间比较,差异无统计学意义(P>0.05);而ADC实性区及ADC 比值组间比较,差异有统计学意义(P<0.05)。Luminal B1 的ADC实性区低于Luminal B2、HER-2 过表达;Luminal B1 的ADC 比值高于Luminal B2、HER-2过表达,见表1、图2。
表1 乳腺癌分子亚型不同ADC值的组间比较
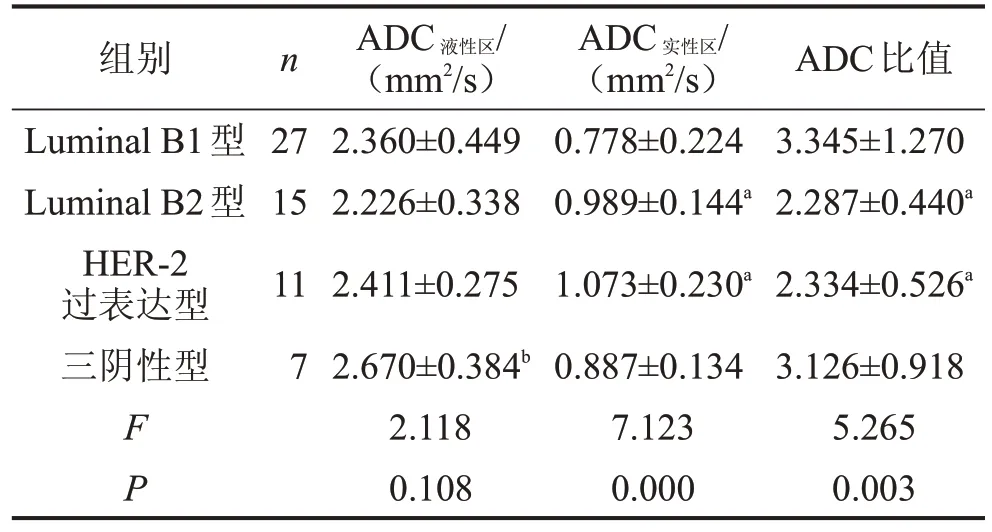
表1 乳腺癌分子亚型不同ADC值的组间比较
与Luminal B1 型比较,aP<0.05;与Luminal B2 型比较,bP<0.05。
2.2 不同ADC值与乳腺癌不同免疫组化因子的相关性 ADC液性区与Ki-67 呈弱正相关关系(r=0.343,P=0.007),与HER-2呈弱负相关关系(r=-0.262,P=0.043),与ER 呈弱负相关关系(r=-0.343,P=0.007)。ADC实性区与Ki-67呈弱负相关关系(r=-0.329,P=0.010),与HER-2 呈弱正相关关系(r=0.391,P=0.002),与PR呈弱负相关关系(r=-0.298,P=0.021)。ADC 比值与Ki67 呈中度正相关关系(r=0.453,P<0.001),与HER-2呈中度负相关关系(r=-0.449,P<0.001),表2。
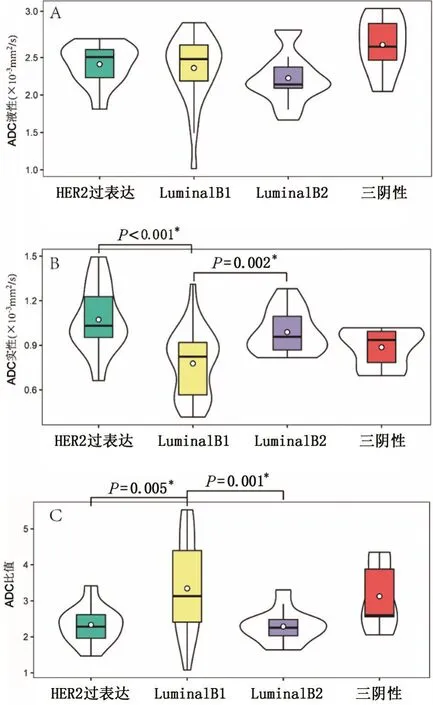
图2 乳腺癌分子亚型中不同ADC值比较(小提琴图)
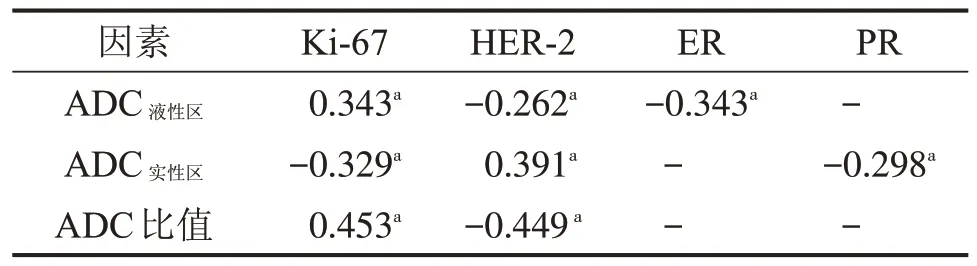
表2 不同ADC值与乳腺癌不同免疫组化因子的相关性rs
3 讨论
不同分子亚型乳腺癌的生物学行为及预后结局存在迥然差异,Luminal A预后相对较好,复发、转移率相对较低[12-13];Luminal B恶性程度较Luminal A高,复发率及肿瘤特异性死亡率高[14-15];HER-2过表达复发、转移率均高于Luminal型,对曲妥珠单抗获益显著[13,16]。三阴性乳腺癌相比于其他分子亚型侵袭性高、预后差[13]。有鉴于此,也就为ADC 值的鉴别诊断提供了病理学基础。本研究发现,在4 个不同分子亚型中,ADC实性区以及ADC 比值不全相同,但ADC液性区的组间比较,差异无统计学意义(P>0.05)。具体而言:(1)ADC实性区在HER-2过表达型、Luminal B2 型、三阴性型、Luminal B1 型中逐渐降低,与既往研究接近,均表现为HER-2 过表达ADC值最高[17-19]。(2)ADC 比值在Luminal B1 型、三阴性型、HER-2 过表达型、Luminal B2 型中逐渐降低。ADC实性区、ADC 比值在4 种不同分子亚型间存在差异,可能是由于不同乳腺癌分子亚型在组织病理学分型、分级的不同,造成瘤灶细胞密度、细胞间隙以及细胞核质比不同所致。但多重比较显示,二者仅在Luminal B1 型与Luminal B2 型、HER-2过表达型间比较,差异有统计学意义(P<0.05),即通过ADC实性区、ADC比值尚难以对不同分子亚型进行一一鉴别,与本研究机构既往发表文献相接近[4],可能与分子分型的决定因素较多,部分因素之间对组织结构的作用相反有关。(3)ADC液性区在三阴性型、HER-2过表达型、Luminal B1型、Luminal B2型中逐渐降低,即Lunimal 型较非Luminal 型ADC液性区值高,但差异无统计学意义(P>0.05)。这种趋势可能由于非Luminal 型侵袭性较高,出现彻底坏死的概率较高有关[20],但组间差异无统计学意义,笔者推测这可能与瘤灶液性区病理学改变较实性区稍弱有关。
为进一步探明不同ADC 值对鉴别乳腺癌分子亚型的更深层次原因,本研究对不同ADC值与免疫组化因子ER、PR 以及Ki-67、HER-2 进行了相关性分析。结果显示,ADC实性区与Ki-67、HER-2、PR存在一定的相关性,ADC液性区与Ki-67、HER-2、ER 存在一定的相关性;ADC比值与Ki-67、HER-2相关性较单一ADC液性区与ADC实性区更高。ER和PR是细胞内的类固醇激素受体蛋白,是指导内分泌治疗的重要预后指标。本研究ADC实性区与PR 呈弱负相关关系(P<0.05),可能是因为PR 的过度表达影响ER 通路,通过抑制血管生成途径,造成细胞膜通透性不同程度改变,引起实性区ADC值降低[11]。ADC液性区与ER 呈弱负相关关系(P<0.05),即ER 阴性者ADC液性区值高,其原因可能在于:ER 的阴性表达与肿瘤的过强侵袭力密切相关,更容易出现坏死液化[22],且其彻底坏死的概率较ER阳性者高。
Ki-67 是细胞增殖指数,其表达水平的高低可以反映肿瘤的增殖活性,Ki-67 指数高代表细胞增殖活性高,既往研究指出,存在坏死区的乳腺癌较无坏死区者Ki-67表达水平高[21-22]。本研究发现,与Ki-67 的相关性中,ADC液性区呈弱正相关关系,ADC实性区呈弱负相关关系,ADC比值呈中度正相关关系(P<0.05),其原因可能在于:(1)由于肿瘤血供分布特点,瘤灶中央较周边更容易出现缺氧情况,即瘤灶中央到外周缺氧严重程度呈现由高到低的梯度改变,而缺氧是导致坏死液化区出现的重要因素。Ki-67 表达水平低者较高者增殖活性低,引起缺氧程度较弱,坏死液化不够彻底,增强无强化区边缘难以代表肿瘤真实边界,该区域可能存在肉眼无法观察到的微癌灶。因此,ADC液性区值较Ki-67高表达者低。(2)高侵袭力的乳腺癌,Ki-67指数较高,实性区细胞致密度高,细胞外间隙窄,ADC实性区值低。(3)ADC 比值较单一的ADC液性区、ADC实性区相关性更高,原因可能为液实性区有各自的病理基础,ADC比值较单一ADC值更充分的体现了肿瘤异质性并且标化、放大了单一参数的相关性。
HER-2 为原癌基因,其过表达可潜在激活EGFR 信号通路,造成新生血管、血管密度及血流量增加,促进细胞增殖,也是造成化疗、内分泌治疗耐药性的重要因素。本研究结果显示,ADC液性区、ADC实性区、ADC比值与HER-2表达相关性分别为弱负相关关系、弱正相关关系、中度负相关关系(P<0.05)。原因可能为:(1)HER-2促血管生成,HER-2阴性者较阳性者新生血管少,瘤灶供血不足导致显著缺氧、坏死,ADC液性区值高。(2)HER-2阳性者新生血管多,血流量高,且由于血管幼稚管壁不连续,导致细胞外间隙增宽,ADC实性区值高。(3)ADC比值扩大化了ADC液性区、ADC实性区的相反趋势,因此其相关度更高。
综上所述,ADC实性区与ADC比值对乳腺癌不同分子亚型判断有一定参考意义。ADC实性区、ADC液性区以及ADC比值与Ki-67、ER、PR以及HER-2不同免疫组化因子分别存在相关性,其中ADC比值相关性更高。本研究存在一定的局限性,首先,属于单中心回顾性研究,可能存在选择或回忆偏倚;其次,由于Luminal A 液化坏死少见,未能对该类别乳腺癌进行入组研究;最后,病例数目较少,有待在进一步的研究中扩展,以获取更多的研究成果。
