神经节苷脂预处理对布比卡因诱导N2a细胞焦亡的影响及其机制
2021-04-16刘丹刘敬臣
刘丹,刘敬臣
广西医科大学第一附属医院,广西南宁530021
布比卡因是一种经典的酰胺类局麻药,具有起效快、术后镇痛作用强等特点,常被应用于局部阻滞麻醉中。研究[1]发现,布比卡因具有潜在的神经毒性作用,会诱发神经细胞的毒性损伤,从而引起多种神经功能并发症。神经节苷脂(GM-1)广泛存在于哺乳类动物细胞膜中,尤其在神经细胞膜中含量丰富,具有中和神经毒性物质对膜的毒性、清除自由基的功能,因而有保护神经细胞、促进神经元细胞轴突生长和突触形成的作用[2]。体内外模型研究[3-4]发现,GM-1能有效抑制神经细胞凋亡,改善神经功能,证实GM-1 对急性脊髓损伤、神经细胞毒性具有一定的神经保护及治疗作用。目前关于布比卡因在细胞程序性死亡方面的文献报道广泛,大部分都集中于凋亡机制方面[5],但是细胞凋亡并不能完全解释局麻药神经毒性及其伴随的炎症反应,而有关布比卡因诱导神经元细胞是否发生焦亡,以及GM-1 预处理能否通过调节焦亡通路减轻布比卡因对N2a细胞损伤,目前相关研究甚少。2019年12月—2020年10 月,本研究观察了GM-1 预处理对布比卡因诱导N2a细胞焦亡的影响,并探讨其机制。
1 材料与方法
1.1 细胞及试剂 N2a 细胞购自中国科学院上海细胞库,布比卡因粉末购自美国Sigma 公司,GM-1溶液购自捷特公司,MEM 培养基、澳洲胎牛血清购自美国Gibco 公司,CCK-8 试剂盒购自日本同仁公司,GSDMD抗体购自美国Santa Cruz公司,NLRP3抗体、Caspase-1 抗体购自美国 Noves 公司,GAPDH 抗体购自美国CST 公司,TUNEL 试剂盒购自美仑公司,Caspase-1 活性检测试剂盒购自索莱宝公司,乳酸脱氢酶(LDH)测定试剂盒购自南京建成生物工程研究所。
1.2 GM-1 预处理及细胞分组 N2a 细胞用10%胎牛血清加1%双抗的MEM 培养基中,于37 ℃、5% CO2清洁培养箱中培养,每2 天更换一次新鲜培养液。待细胞生长密度达85%以上,用0.25%胰酶进行消化、传代后,接种于新培养瓶中进行后续相关实验。取对数生长期N2a细胞随机分为3组:布比卡因组(B 组)加入终浓度为900 μmol/L的布比卡因培养24 h,GM-1预处理组(G+B组)加入5 μmol/L GM-1预处理24 h后再加入900 μmol/L的布比卡因继续培养24 h,对照组(C组)不加入GM-1或布比卡因。
1.3 各组细胞形态观察 ①取各组细胞接种于6孔板,每孔随机选择3 个以上的视野,用200 倍倒置相差显微镜观察各组细胞形态。②取各组细胞接种于 6 孔板,3% 戊二醛固 2 h,PBS 浸泡清洗 3 次,每次10 min,四氧化锇固定 1 h,PBS 浸泡清洗 3 次,每次10 min,梯度乙醇浸泡脱水,放入真空干燥器中抽真空干燥,IB3 离子溅射仪喷镀后放入扫描电镜观察各组细胞形态。
1.4 各组细胞活力测算 采用CCK-8 法。取各组细胞,以3×104/mL接种于96孔培养板,每孔加100 μL细胞悬液,在37 ℃、5% CO2条件细胞培养箱下培养24 h,加入 10 μL CCK-8 试剂,恒温培养箱避光孵育1 h 后,以空白孔为空白组,使用酶标仪于450 nm 处测定其吸光度值,计算细胞存活率,以细胞存活率表示细胞活力。细胞存活率(%)=(各组吸光度值−空白组吸光度值)/(对照组吸光度值−空白组吸光度值)×100%。实验重复3次,取平均值。
1.5 各组细胞凋亡率测算 采用TUNEL 染色试验。取各组细胞接种于12 孔板,药物作用24 h 后,用4%多聚甲醛固定30 min,PBS 洗涤3 次,以0.3%Triton X-100 室温通透 5 min,按照 TUNEL 试剂盒说明书进行操作,37 ℃条件下与TUNEL反应混合液避光孵育1 h,PBS 润洗3 次,用抗荧光衰减封片剂封片,荧光显微镜下观察并计数TUNEL 染色阳性细胞数及细胞总数,计算TUNEL染色阳性细胞率,以TU⁃NEL 染色阳性细胞率表示细胞凋亡率。TUNEL 染色阳性细胞率(%)=TUNEL 染色阳性细胞数/细胞总数×100%。
1.6 各组细胞中LDH 含量测算 采用LDH 释放实验。LDH 含量能够有效地反映细胞膜的完整性与否,可用于定量检测细胞毒性,常用来评估细胞受损程度。取各组细胞,PBS 清洗2遍,加入100 μL 的裂解液置于冰上裂解10 min,2 500 r/min 离心10 min后取上清,按照LDH 测定试剂盒说明书操作步骤,使用酶标仪于490 nm 处检测各组吸光度值,计算各组细胞中LDH 含量。细胞中LDH 含量(U/L)=(各组吸光度值−对照组吸光度值)/(标准管吸光度值−空白管吸光度值)×标准品浓度(2 mmol/L)。实验重复3次,取平均值。
1.7 各组细胞中天冬氨酰特异性半胱氨酰蛋白酶1(Caspase-1)活性测算 采用Caspase-1 活性实验。取各组细胞,经胰酶消化收集后,1 500 r/min 离心5 min,加入裂解液重悬细胞沉淀,冰浴裂解15 min,4 ℃条件下12 000 r/min 离心10 min,取细胞上清液用Bradford法进行蛋白定量。在96孔板中将反应缓冲液 60 μL、细胞裂解上清液 50 μL 和 Caspase-1 底物5 μL混合,37 ℃孵育2 h,应用酶标仪读取405 nm处的吸光度值,在相同条件下获得标准曲线,以对照组细胞Caspase-1 活性作为100%,根据标准曲线计算各组细胞中Caspase-1活性。
1.8 各组细胞焦亡相关蛋白细胞炎症小体活化蛋白质-gasdermin D(GSDMD)、NOD 样受体蛋白3(NL⁃RP3)和Caspase-1 蛋白检测 采用Western blotting法。取对数生长期N2a 细胞,用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液提取细胞总蛋白,超声裂解,4 ℃条件下12 000 r/min 离心,吸取上清,加入蛋白上样缓冲液混匀,煮沸变性后分装−80 ℃备用,BCA 法进行蛋白定量。每组取20 μg 蛋白在10%SDS-PAGE 胶上电泳,后转移至 PVDF 膜,用 5%BSA加入 GSDMD、NLRP3 和 Caspase-1 抗体(稀释比1∶1 000),孵育,4 ℃摇床过夜,洗膜后加入辣根过氧化物酶标记的二抗体IgG(1∶3 000),室温摇床孵育60 min,洗膜后加入化学发光试剂,应用胶片曝光显影后扫描分析,用Image J 软件测定灰度值,以目的条带与内参条带灰度值的比值表示目的蛋白的相对表达量。
1.9 统计学方法 采用SPSS22.0 统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较用LSD-t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞形态变化 ①倒置相差显微镜下,C组细胞胞体形态多样且饱满、形态规则、周围有光晕、网状分布;B 组细胞皱缩变圆,突触明显变短甚至消失,细胞膜通透性增高、破裂;G+B组细胞生长状态良好,胞浆丰富,细胞间排列密集,交织成网状。②扫描电镜下,C 组细胞呈圆形,细胞膜完整且光滑;B 组细胞形态异常,胞体明显肿胀,细胞间紧密连接结构消失,细胞突触折断、消失,失去了细胞膜的完整性,其胞膜上形成了大小不等的微孔,产生凋亡小体样的细胞突起囊泡;G+B组细胞损伤形态明显减轻,数量也更多,未见细胞膜的完整性丧失及微孔形成,细胞间联系紧密。详见图1。

图1 各组细胞形态变化
2.2 各组细胞活力比较 C、B、G + B 组细胞活力分 别 为 100.00%、51.24% ± 3.71%、68.36% ±1.83%,组间相比,P均<0.05。
2.3 各组细胞凋亡率比较 C、B、G + B 组细胞凋亡率分别为 2.54% ± 0.46%、74.36% ± 2.35%、58.63%±4.62%,组间相比,P均<0.05。
2.4 各组细胞中LDH 含量比较 C、B、G + B 组细胞中 LDH 含量分别为(75.36 ± 9.28)、(583.56 ±10.39)、(274.07 ± 6.54)U/L,组间相比,P均<0.05。
2.5 各组细胞中Caspase-1 活性比较 C、B、G + B组细胞中Caspase-1活性分别为100%、436%±104%、258% ±46%,组间相比,P均<0.05。
2.6 各组细胞中 GSDMD、NLRP3、Caspase-1 蛋白相对表达量比较 各组细胞中GSDMD、NLRP3、Caspase-1 蛋白相对表达量比较见表1。由表1 可知,与 C 组相比,B 组细胞中 GSDMD、NLRP3、Cas⁃pase-1 蛋白相对表达量均升高(P均<0.05);与B 组相比,G + B 组细胞中 GSDMD、NLRP3、Caspase-1 蛋白相对表达量均降低(P均<0.05)。
表1 各组细胞中GSDMD、NLRP3、Caspase-1蛋白相对表达量比较(>)
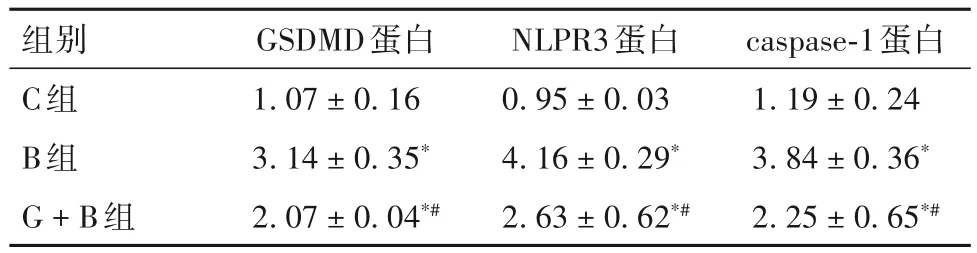
表1 各组细胞中GSDMD、NLRP3、Caspase-1蛋白相对表达量比较(>)
注:与C组相比,*P<0.05;与B组相比,#P<0.05。
组别C组B组G+B组caspase-1蛋白1.19±0.24 3.84±0.36*2.25±0.65*#GSDMD蛋白1.07±0.16 3.14±0.35*2.07±0.04*#NLPR3蛋白0.95±0.03 4.16±0.29*2.63±0.62*#
3 讨论
近年来,局麻药神经毒性机制及防治一直是研究热点所在,N2a 细胞经一定浓度布比卡因诱导的神经细胞损伤已被广泛用于神经毒性的体外模型[6]。我们前期通过细胞层面研究[7]发现,GM-1 预处理显著降低布比卡因诱导N2a 细胞的Caspase-3蛋白表达,抑制布比卡因产生的神经毒性,从而发挥神经保护作用。近年来,GM-1及其神经保护作用受到越来越多的关注。众多研究[8]表明,GM-1 通过影响神经系统的发育、促进神经细胞轴突的生长与再生发挥神经保护作用。本研究主要在体外模型、分子层面上探究GM-1 对布比卡因产生的神经细胞焦亡的影响,并对其机制进行进一步探讨。
研究[9]表明,细胞程序性死亡既可出现在正常生理情况下,也出现在机体受到刺激或损伤时的非正常生理状态中,其主要方式有凋亡、自噬及焦亡3种死亡方式,在细胞生命各项活动中发挥重要的作用。细胞焦亡是近年来提出的程序性细胞死亡形式,兼有坏死与凋亡的形态学特征,表现为细胞核浓缩和染色质DNA 断裂,细胞膜形成孔洞并且胞膜破裂,胞质内容物释放并引起强烈的炎症反应[10]。最新研究[11]发现,细胞焦亡是由 GSDMD 介导调控的一种新型程序性细胞死亡形式,为细胞死亡补充了新的概念,可分为依赖Caspase-1 的经典途径及Cas⁃pase-4、5、11 的非经典途径。Caspase-1 是细胞焦亡过程中已明确激活的经典因子。内外源性刺激因素通过不同途径激活炎性小体从而活化Caspase-1,造成细胞膜穿孔,增加膜的通透性,使得细胞内容物从孔道漏出以及IL-1β、IL-18等促炎因子成熟和释放,进而引发一系列强烈的炎症反应[12]。NLRP3 是一种被广泛研究的炎症小体,属于细胞质内模式识别受体,可被多种不同的信号系统参与激活,通过与ASC结合募集Caspase-1前体并产生活性的Caspase-1,一方面说明了焦亡的出现,另一方面也提示了炎症反应的发生[13]。目前有研究[14]发现,细胞焦亡主要依靠炎症小体激活Caspase 家族部分蛋白,使其激活、切割GSDMD 蛋白,活化的GSDMD 蛋白转位至细胞膜,形成膜孔,胞质外流,最终导致细胞满破裂、死亡。因此,本研究检测通过GSDMD 蛋白、NLRP3 为代表的炎症小体以及Caspase-1 为代表的Caspase 家族等作为焦亡发生的指标。
本研究中结果显示,布比卡因处理N2a细胞24 h明显降低细胞存活率,从形态学角度观察TUNEL染色阳性细胞率显著增加,扫描电镜中发现布比卡因处理N2a 细胞产生焦亡小体,细胞膜形成大小不等的孔道,细胞通透性增高,细胞内容物LDH 等释放到细胞外增多,以及GSDMD、NLRP3 和Caspase-1蛋白的产生进一步确认焦亡的发生,证实了其对N2a 细胞的神经毒性作用,从分子层面分析活化Caspase-1 含量增加,焦亡相关蛋白GSDMD、NLRP3和Caspase-1蛋白相对表达量均明显上调,这些结果提示布比卡因诱导N2a细胞发生焦亡。
本研究发现,GM-1可能通过作用于细胞膜上的受体,抑制布比卡因诱导的焦亡的作用,减少LDH的释放,从而减轻细胞损伤。在本实验中,GM-1 对N2a 细胞预处理24 h,显著降低TUNEL 染色阳性细胞率,明显减少LDH的释放以及活化的Caspase-1的产生,可部分逆转布比卡因诱导N2a 细胞损伤形态变化,减少焦亡小孔的形成,从而降低细胞焦亡的发生,有效抑制 GSDMD、NLRP3 和 Caspase-1 蛋白的表达来减少N2a细胞的死亡,从而减轻细胞损伤,降低布比卡因的神经毒性作用,抑制细胞焦亡的进展过程,提示可能与其神经保护作用有关。
本研究还存在一定的局限性。首先,虽然发现了布比卡因可诱导N2a 细胞焦亡相关蛋白的表达,但未能在组织层面提供更进一步的证据。其次,布比卡因诱导N2a细胞损伤可能存在多种机制共同参与调控,不同的死亡模式之间并非完全孤立,在某种情况下极有可能向另一种完成转化,本研究没有进一步的深入,有待未来研究继续探讨。
综上所述,本研究深入细胞水平证实GM-1 抑制N2a 细胞发生细胞焦亡的分子机制,减轻布比卡因引起的神经毒性,改善减轻神经细胞焦亡和炎性病变,其机制可能与激活GSDMD-NLRP3-Caspase-1信号途径有关。本研究不仅为GM-1 在临床神经保护作用方面的应用提供更加有利的理论依据,也为局麻药神经毒性研究在细胞死亡机制中寻求更多可能的治疗靶点提供新思路。
