非布索坦灌胃对百草枯诱导的大鼠肺损伤改善作用及其机制
2021-04-16何钢张力王天轶
何钢,张力,王天轶
解放军联勤保障部队980医院/白求恩国际和平医院,河北石家庄050000
百草枯是一种快速有效的除草剂,广泛用于杂草的控制。然而,由于自杀或者意外接触百草枯后,百草枯导致的人类中毒和死亡的发生率越来越高。百草枯进入人体后主要积聚在肺组织中,通过氧化应激和脂质过氧化反应,引发肺泡炎、水肿、炎性细胞浸润和胶原沉积等肺损伤,并最终导致呼吸衰竭和肺纤维化[1-3]。百草枯在生物转化过程中不仅产生超氧化物自由基,而且还诱导黄嘌呤氧化酶活性(XO)发生变化,催化黄嘌呤和次黄嘌呤在肺组织中转化为尿酸和超氧自由基[4],尿酸能增强晚期糖基化终产物(RAGE)受体的表达,而超氧自由基则会产生过度的细胞氧化应激,导致抗氧化剂的消耗、脂质过氧化和组织损伤坏死[5]。尽管已有研究报道一些抗氧化剂和抗炎药对百草枯所致肺损伤的保护作用,但至今还没有一种有效的抗百草枯毒性的解毒剂。非布索坦是一种有效的选择性XO 抑制剂,用于治疗痛风,同时也具有抗氧化和抗炎作用[7]。相关研究[6]报道,雷帕霉素通过抑制NF-κB p65活性和刺激Nrf2 信号通路来改善百草枯所致肺毒性。但尚未有非布索坦对于百草枯致大鼠肺毒性改善作用的报道。2019 年 11 月 5 日—2020 年 10 月 29 日,本研究观察了非布索坦灌胃对百草枯诱导大鼠肺损伤的改善作用,并探讨其机制。
1 材料与方法
1.1 非布索坦、大鼠、试剂及仪器 非布索坦购自武汉博士德生物工程有限公司。清洁级的Wistar成年雄性大鼠21 只,体质量(183 ± 16)g,购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2020-1008。百草枯购自英国捷利康有限公司,PI3K、Akt 和β-catenin 兔抗鼠多克隆抗体购自美国CST 公司,RNA 提取试剂购自美国Promega 公司,LDH、XO、SOD、TAC、MDA、羟脯氨酸比色试剂盒购自上海玉博生物科技有限公司,大鼠sRAGE、MMP-9、IL-8 和VEGF 特异性单克隆抗体购自南京建成生物工程研究所,动物实验器械购自上海医用精密仪器厂,AP310电子天平购自北京市医疗设备厂,高速低温离心机购自德国贺利氏公司。
1.2 动物分组、百草枯灌胃及非布索坦给予方法21 只大鼠随机分为3 组,每组7 只,分别为对照组、百草枯组、百草枯+非布索坦组。百草枯组和百草枯+非布索坦组给予50 mg/kg 百草枯1 mL 一次性灌胃染毒。百草枯+非布索坦组在染毒24 h 后,每天5 mg/kg 非布索坦灌胃治疗,连续灌胃14 d;对照组、百草枯组每天灌胃等体积生理盐水。各组大鼠灌胃14 d 后处死,立即分离肺组织和心脏。心脏取血,3 000 r/min 离心30 min,分离血清后−70 ℃冰箱中保存。
1.3 各组大鼠肺组织病理观察 采用苏木素-伊红(HE)染色法。将肺组织脱水、透明、浸蜡、包埋,然后切成5 μm 切片,放入水箱中展片,待组织充分舒展后,用载玻片取出肺组织,进行HE 染色处理,常规脱蜡,盐酸乙醇分化,苏木精染色5 min,1%盐酸酒精分化,1%氨水返蓝,0.5%伊红染色5 min,用水冲洗,随后70%、80%、90%、95%、100%梯度乙醇脱色,二甲苯透明,然后树胶封片,光镜下观察肺组织病理变化。
1.4 各组大鼠肺毒性标志物血清乳酸脱氢酶(LDH)、可溶性糖基化终产物受体(sRAGE)检测①采用比色法检测血清LDH。取血清样品,使用LDH 活性检测试剂盒检测LDH。②采用ELISA 法检测血清sRAGE。取血清样品,严格按ELISA 试剂盒说明进行操作,将大鼠sRAGE 特异性单克隆抗体预涂于微板上,将标准品和标本移入孔中,并固定抗体结合sRAGE,向孔中加入底物溶液,然后用酶标仪测量sRAGE。
1.5 各组大鼠肺组织中氧化应激标志物黄嘌呤氧化酶(XO)、超氧化物歧化酶(SOD)、总抗氧化能力(TAC)、丙二醛(MDA)、羟脯氨酸检测 采用比色法。取血清样品,常温静置30 min,3 000 r/min 离心20 min,分离血清放于EP 管中,采用比色法检测XO、SOD、TAC、MDA、羟脯氨酸。
1.6 各组大鼠肺组织中PI3K、Akt、β-catenin、基质金属蛋白酶-9(MMP-9)、白介素-8(IL-8)、血管内皮生长因子(VEGF)检测 ①采用Western blotting 法检测大鼠肺组织中PI3K、Akt、β-catenin 蛋白。取肺组织样品,离心分离匀浆,收集上清液,并根据BCA蛋白检测试剂盒测定总蛋白浓度,蛋白质样品在8%聚丙烯酰胺凝胶上电泳并转移到硝酸纤维素膜上,在封闭液中孵育1 h,然后用TBST 冲洗10 min,分别加入相应一抗,在4 ℃下孵育过夜,TBST 洗膜后,与辣根过氧化物酶标记抗兔IgG 抗体在室温下1∶25 000稀释孵育1 h,ECL发光,以β-actin为内参,采用Image J 软件分析目的蛋白相对表达量。②采用双抗体夹心ELISA 法检测大鼠肺组织中MMP-9、IL-8、VEGF。取血清样品,所有操作严格按ELISA试剂盒说明进行,将大鼠MMP-9、IL-8 和VEGF 特异性单克隆抗体预涂于微板上,将标准品和标本移入孔中,并固定抗体结合MMP-9、IL-8 和VEGF,向孔中加入底物溶液,然后用酶标仪测量。
1.7 统计学方法 采用Graph Pad Prism V7.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较使用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织变化 各组大鼠肺组织变化见图1。由图1 可见,对照组大鼠肺泡结构正常,无上皮损伤;百草枯组大鼠肺组织呈现出严重的多元化恶化情况,出现重度纤维组织增生、混合炎性细胞浸润和肺水肿情况;百草枯+非布索坦组大鼠肺组织中呈现中度纤维组织增生和炎性细胞浸润情况。
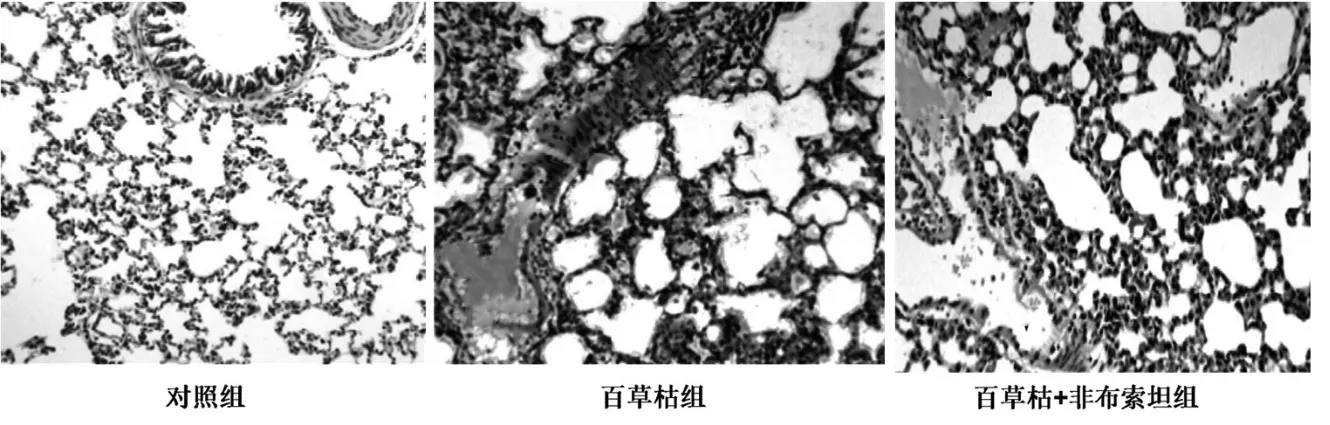
图1 各组大鼠肺组织病理变化(×100)
2.2 各组大鼠肺毒性标志物血清LDH、sRAGE水平比较 各组大鼠肺毒性标志物血清LDH、sRAGE 水平比较见表1。由表1可知,与对照组相比,百草枯组血清LDH水平显著升高、sRAGE水平显著降低(P均<0.05);与百草枯组相比,百草枯+非布索坦组LDH水平显著降低、sRAGE水平显著升高(P均<0.05)。
表1 各组大鼠肺毒性标志物血清LDH、sRAGE水平比较(>)

表1 各组大鼠肺毒性标志物血清LDH、sRAGE水平比较(>)
注:与对照组相比,*P<0.05;与百草枯组相比,#P<0.05。
组别对照组百草枯组百草枯+非布索坦组sRAGE(ng/mL)28.36±4.93 13.37±2.19*22.76±4.05#n 7 7 7 LDH(U/mL)179.57±11.29 591.74±86.57*227.81±26.73#
2.3 各组大鼠肺组织中氧化应激标志物XO、SOD、TAC、MDA、羟脯氨酸水平比较 各组大鼠肺组织中氧化应激标志物XO、SOD、TAC、MDA、羟脯氨酸水平比较见表2。由表2 可知,与对照组相比,百草枯组XO、MDA、羟脯氨酸水平均显著升高(P均<0.05),SOD、TAC 水平均显著降低(P均<0.05);与百草枯组相比,百草枯+ 非布索坦组XO、MDA、羟脯氨酸水平均显著降低(P均<0.05),SOD、TAC 水平均显著升高(P均<0.05)。
2.4 各组大鼠肺组织中 PI3K、Akt、β-catenin 蛋白相对表达量和MMP-9、IL-8、VEGF 水平比较 各组大鼠肺组织中PI3K、Akt、β-catenin 蛋白相对表达量和 MMP-9、IL-8、VEGF 水平比较见表 3。由表3 可知,与对照组相比,百草枯组大鼠肺组织中PI3K、Akt、β-catenin 蛋白相对表达量和 MMP-9、IL-8、VEGF 水平均显著升高(P均<0.05);与百草枯组相比,百草枯+ 非布索坦组大鼠肺组织中PI3K、Akt、β-catenin 蛋白相对表达量和 MMP-9、IL-8、VEGF 水平均显著降低(P均<0.05)。
表2 各组大鼠肺组织中氧化应激标志物XO、SOD、TAC、MDA、羟脯氨酸水平比较()

表2 各组大鼠肺组织中氧化应激标志物XO、SOD、TAC、MDA、羟脯氨酸水平比较()
注:与对照组相比,*P<0.05;与百草枯组相比,#P<0.05。
组别对照组百草枯组百草枯+非布索坦组羟脯氨酸(ng/mg)22.59±2.73 39.52±4.69*26.32±2.76#n 7 7 7 XO(U/mg)42.36± 4.12 102.18±10.92*65.78± 6.82#SOD(U/mg)2.35±0.27 1.36±0.21*2.62±0.29#TAC(nmol/mg)35.68±3.69 16.47±1.89*29.73±3.32#MDA(nmol/mg)3.89±0.37 12.82±1.41*7.42±0.91#
表3 各组大鼠肺组织中PI3K、Akt、β-catenin蛋白相对表达量和MMP-9、IL-8、VEGF水平比较()
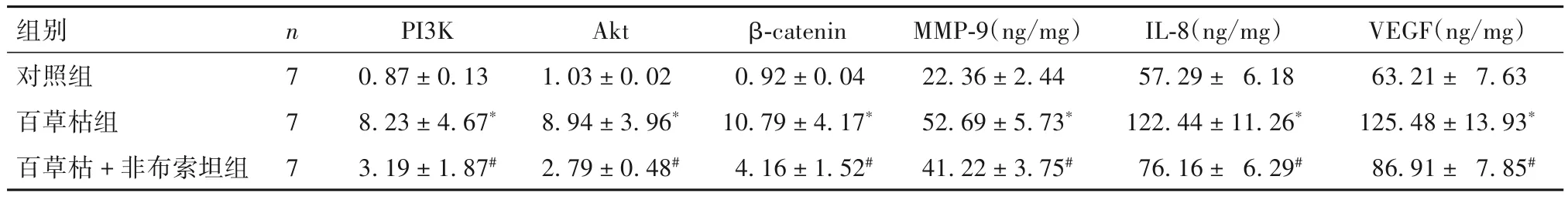
表3 各组大鼠肺组织中PI3K、Akt、β-catenin蛋白相对表达量和MMP-9、IL-8、VEGF水平比较()
注:与对照组相比,*P<0.05;与百草枯组相比,#P<0.05。
组别对照组百草枯组百草枯+非布索坦组VEGF(ng/mg)63.21± 7.63 125.48±13.93*86.91± 7.85#n 7 7 7 PI3K 0.87±0.13 8.23±4.67*3.19±1.87#Akt 1.03±0.02 8.94±3.96*2.79±0.48#β-catenin 0.92±0.04 10.79±4.17*4.16±1.52#MMP-9(ng/mg)22.36±2.44 52.69±5.73*41.22±3.75#IL-8(ng/mg)57.29± 6.18 122.44±11.26*76.16± 6.29#
3 讨论
肺部为百草枯中毒的主要靶器官,也是导致死亡的主要原因[8]。百草枯的肺毒性早期表现为急性肺泡炎性改变,后期表现为不可逆的肺间质纤维化,最终导致呼吸衰竭而死亡。肺纤维化是百草枯致肺毒性的最终结局,百草枯能够增加肺组织中氧化应激标记物的含量,还能使LDH活性增强和sRAGE水平受到抑制。百草枯对肺毒性类似的作用,此前已有相关报道[9]。细胞内酶如LDH的渗漏增强及其血清活性的增加被认为是暴露于自由基后组织坏死的标志[10]。血清中sRAGE 被认为是急性肺损伤和肺部炎症的生物标志物[11]。sRAGE 可与循环促炎分子结合,从而阻止其与跨膜RAGE结合和激活,最终抑制RAGE 途径及其下游炎症反应[12]。本研究中,非布索坦对血清LDH 和sRAGE 的抑制作用可能与非布索坦对百草枯所致肺损伤的改善作用有关。
百草枯能增加肺组织中氧化应激标志物的含量,促使 XO 活性增强、SOD 活性降低、TAC 能力降低。百草枯诱导XO 活性的增强可能导致黄嘌呤和氧过度转化为超氧自由基。我们的研究结果表明,百草枯对SOD 活性有抑制作用,最终导致超氧化物自由基的积累。累积的超氧化物自由基可与肺组织相互作用,增强脂质过度氧化,降低TAC 能力,并刺激炎症细胞因子的形成。羟基脯氨酸是胶原的主要成分,本研究中羟脯氨酸含量的升高可能是肺纤维化的早期标志。非布索坦是一种XO 抑制剂,对百草枯诱导的大鼠肺组织氧化应激具有保护作用[13],主要表现在大鼠血清中LDH 活性降低和氧化还原状态的重新平衡。在本研究中,非布索坦抑制XO活性,干扰百草枯诱导的超氧化物自由基累积,从而使SOD 活性正常化,抑制脂质过氧化,提高TAC 能力,这反过来又抑制了氧化应激诱导的炎症和纤维化。
百草枯激活RAGE 可启动一系列细胞内的信号通路,包括PI3K/Akt 信号通路。Akt 可以通过直接磷酸化或与Wnt 通路交叉激活β-catenin,Akt 激活后,Wnt/β-catenin 信号通路下调。相关研究[14]证明,Wnt/β-catenin 信号通路参与了组织损伤后的纤维化组织修复。因此,我们推测非布索坦在对百草枯诱导的肺部炎症中的保护作用可能是通过抑制PI3K/Akt 途径及其下游分子实现的。此外,百草枯诱导肺组织MMP-9 含量升高可能与β-catenin 表达增强有关。β-catenin是一种靶向金属蛋白酶表达的转录因子,MMP-9 是由活化的中性粒细胞或巨噬细胞释放出来的,能够消化弹性蛋白、胶原蛋白和其他结构蛋白,从而破坏基底膜和细胞外基质,导致肺泡毛细血管通透性增加、渗出、肺泡损伤[15]。MMP-9主要在肺纤维化的早期增加,在肺部炎症迁移到肺组织中起重要作用,MMP-9 还可促进TGF-β 和TNF-α 的释放,加速肺纤维化[16]。非布索坦对百草枯所致肺损伤的抗炎作用可能部分通过抑制百草枯诱导的氧化应激,从而减轻自由基介导的内皮损伤和血管通透性。此外,非布索坦还可抑制PI3K/Akt通路及β-catenin 来消除百草枯对肺组织中MMP-9 含量的刺激作用,从而保护肺泡的完整性。百草枯大鼠肺组织炎症介质、IL-8 和VEGF 含量的增加可能与PI3K/Akt通路的增强有关。IL-8是一种有效的中性粒细胞激活剂和趋化因子,在肺部炎症、肺泡炎、成纤维细胞迁移和肺纤维化中起重要作用[17]。非布索坦降低肺组织IL-8 水平可能与抑制β-catenin 表达有关。VEGF 是一种具有多种作用的细胞因子,它通常在肺泡和支气管上皮中表达,被认为是内皮细胞损伤的标志物[18]。VEGF 控制内皮细胞增殖和存活、血管通透性、血管生成和单核细胞募集,通过诱导NF-κB促进炎症反应[19]。百草枯在急性肺损伤中可诱导VEGF 大量释放,增加血管通透性,允许炎性细胞浸润到肺组织,导致过度损坏。研究[20]显示,阻止内皮细胞损伤的药物可以降低VEGF 的浓度,降低血管通透性。百草枯上调β-catenin 可能参与了下游分子VEGF的诱导,说明β-catenin激活与VEGF表达上调之间存在关系。
综上所述,百草枯可通过提高XO 活性、增强氧化应激、激活 PI3K/Akt 通路、β-catenin 和一系列炎症介质,从而诱发肺毒性;非布索坦通过下调RAGE、PI3K/Akt 通路、β-catenin 表达和抑制下游炎性反应,达到改善百草枯所致肺损伤的作用。
