胰腺癌患者血清外泌体酪氨酸蛋白激酶受体EphA2蛋白表达变化及其意义
2021-04-16魏倩李泽冯红蕾
魏倩,李泽,冯红蕾
天津医科大学肿瘤医院/国家肿瘤临床医学研究中心/天津市肿瘤防治重点实验室/天津市恶性肿瘤临床医学研究中心,天津300060
胰腺癌是一类恶性程度很高的消化道肿瘤,全球的五年生存率仅为4%,是世界癌症相关死亡的第四大主要原因[1]。由于其早期的隐匿性和高侵袭性,大部分患者在发现的时候已经处于晚期,失去了手术及治疗的机会[2]。随着现代医疗技术的发展,治疗手段在不断的提高,但对化疗药物的耐药性使得大部分胰腺癌患者预后依然较差[3]。因此,加强相关研究并寻找新型标志物和药物载体对胰腺癌的早期诊断和临床疗效至关重要。外泌体是一类由细胞分泌的40~150 nm 的微小囊泡,可以携带大量的功能性物质如核酸、miRNA 和蛋白,参与肿瘤的发生发展过程和各种生理信息传递[4]。已经有大量的文献[5]报道血液中的外泌体在临床诊断和治疗上的重要意义。我们的前期研究发现,外泌体携带的酪氨酸蛋白激酶受体EphA2 蛋白可以提高胰腺癌细胞的侵袭、迁移能力及耐药能力[6-7],但是在血液中的功能作用及相关性研究较少。本研究观察了胰腺癌患者血清外泌体EphA2 蛋白表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选取天津医科大学肿瘤医院2016年10 月—2017 年10 月收治并诊断为胰腺癌的患者105 例,记为胰腺癌组。胰腺癌组患者中,105 例男60 例、女 45 例,年龄(52.5 ± 10.4)岁,肿瘤 TNM 分期Ⅰ期+Ⅱ期35 例、Ⅲ期+Ⅳ期70 例,有酗酒史者21例,有长期吸烟史者45 例,有淋巴结转移者76 例。患者纳入标准:①均经术后病理检查确诊为胰腺癌;②均为首次诊断,未进行过放疗或化疗;③患者不存在胰腺癌以外的其他原发恶性肿瘤;④患者临床病理资料完整并接受随访。排除标准:①患有其他原发的消化系统肿瘤;②患者临床资料不全。另选取同期体检健康者70例,记为健康组,其中男37例、女33 例,年龄(46.4 ± 7.8)岁。两组基本资料具有可比性。本研究通过天津医科大学肿瘤医院伦理委员会批准,患者及家属签署知情同意书。
1.2 两组血清外泌体EphA2 蛋白检测及分析 采用酶联免疫法。收集胰腺癌患者术前和健康者的新鲜血清,在−80 ℃冰箱中保存,禁止反复冻融。取 250 μL 血清,3 000 g 离心 5 min,去掉沉淀,然后加入63 μL 外泌体试剂纯化液,混匀后4 ℃静置30~60 min,4 ℃条件下1 500 g 离心30 min,弃掉上清,将沉淀物用100 μL PBS溶解。在96孔板中加入100 μL 的抗 EphA2 血清抗体,过夜孵育,清洗之后封闭1 h,随后加入待检血清标本、标准液和阴性对照,在室温下孵育2.5 h 后清洗液清洗三次,然后加入检测抗体,室温孵育2 h,之后加入链霉亲和素溶液并孵育45 min,冲洗三次后加入显色剂显色30 min,终止液终止,使用680 型酶标仪在450 nm 处测定吸光度值,以吸光度值表示血清外泌体EphA2蛋白的表达水平。以胰腺癌患者血清外泌体EphA2蛋白表达水平中位数为临界值,将105 例胰腺癌患者分为EphA2蛋白高表达者、EphA2蛋白低表达者,分析血清外泌体EphA2 蛋白表达水平与胰腺癌患者临床病理参数的关系。
1.3 胰腺癌患者随访及预后分析 自患者出院起,每1~3个月随访一次,随访时间3~36个月,随访至终止时间或患者死亡,随访时间截至2020 年10 月。以胰腺癌患者血清外泌体EphA2 蛋白表达水平中位数为临界值,将随访资料完整的胰腺癌患者分为EphA2 蛋白高表达组、EphA2 蛋白低表达组,采用Kaplan-Meier 生存分析法分析血清外泌体EphA2 蛋白表达水平与胰腺癌患者预后的关系。
1.4 统计学方法 采用SPSS20.0 和GraphPad Prism Software 5.0 统计软件。计量资料以表示,比较用t检验;计数资料比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清外泌体EphA2 蛋白表达水平比较胰腺癌组、健康组血清外泌体EphA2 蛋白表达水平分别为(1 956 ± 216)ng/L、(474 ± 51)ng/L,两组相比,P<0.05。
2.2 血清外泌体EphA2 蛋白表达水平与胰腺癌患者临床病理参数之间的关系 血清外泌体EphA2蛋白表达水平与胰腺癌患者临床病理参数之间的关系见表1。由表1可知,血清外泌体EphA2蛋白表达水平与胰腺癌TNM 分期、淋巴结转移有关(P均<0.05),与患者的性别、年龄、吸烟史、酗酒史无关(P均>0.05)。
2.3 血清外泌体EphA2 蛋白表达水平与胰腺癌患者预后的关系 105例患者中100例随访成功,随访3 年内共有73 例患者死亡,3 年总生存率为27.0%。其中,EphA2 蛋白高表达组 47 例、EphA2 蛋白低表达组53 例。EphA2 蛋白高表达组、EphA2 蛋白低表达组胰腺癌患者的生存曲线见图1。Kaplan-Meier生存分析结果显示,EphA2 蛋白高表达组3 年生存率为 14.9%(7/47),EphA2 蛋白低表达组 3 年生存率为37.7%(20/53),两组患者3 年生存率相比,P<0.05。
3 讨论
胰腺癌是一种病死率相对较高的癌症,治疗内容主要包括手术、放疗和化疗等传统手段[8-9]。由于其早期症状不明显及高侵袭转移性,使得疾病的进展迅速,大部分胰腺癌患者在诊断时已经转移进入晚期[10]。近年来,在临床诊断上糖类抗原19-9 成为胰腺癌最常见的血清生物标志物,但其敏感性和特异性相对较差[11-12]。而由于胰腺癌患者对放化疗的高耐药性,使得患者的预后效果也差强人意[13]。因此,为了加强胰腺癌的诊断水平和预后评估,我们试图寻找和评估新的无创性生物标志物。
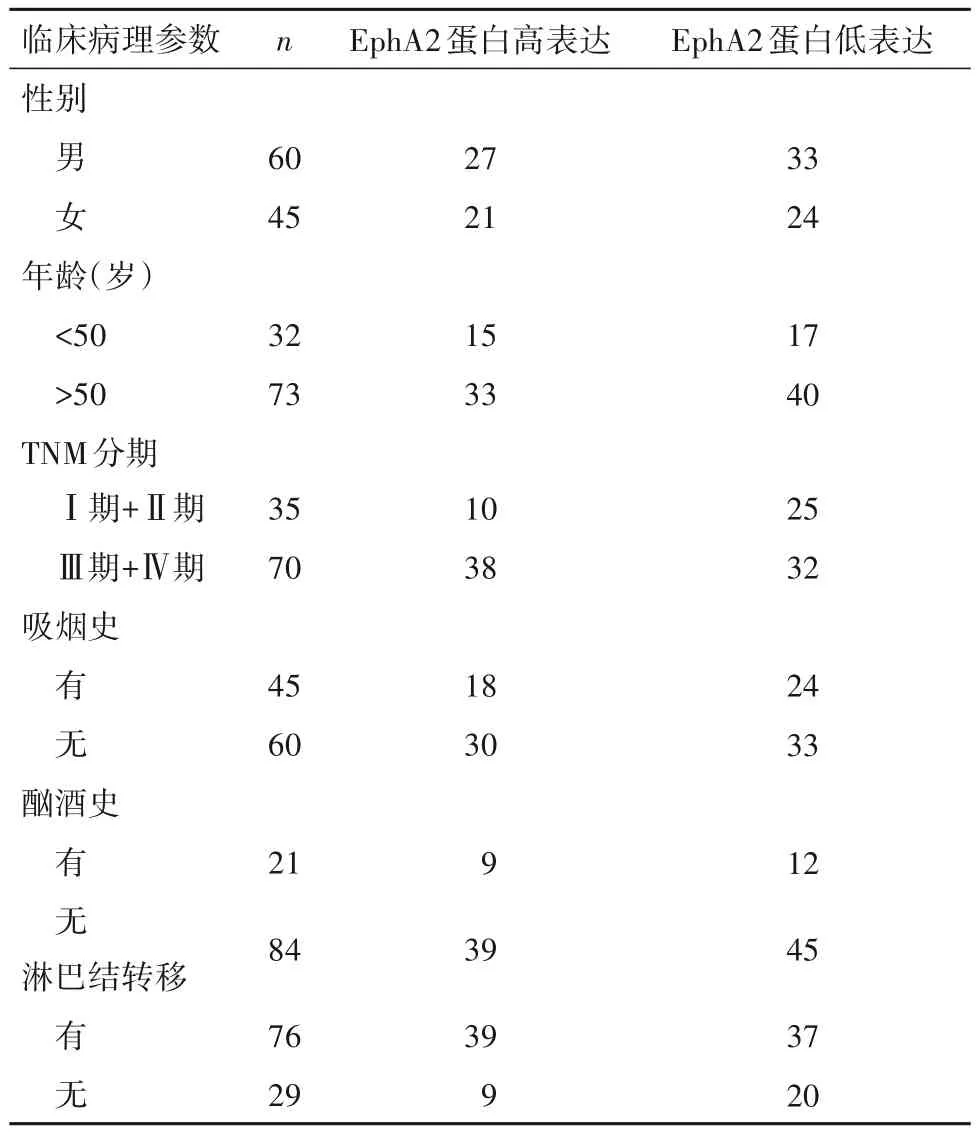
表1 血清外泌体EphA2蛋白表达水平与胰腺癌患者临床病理参数之间的关系(例)

图1 EphA2蛋白高表达组、EphA2蛋白低表达组胰腺癌患者的生存曲线
近年来,越来越多的研究证实外泌体在细胞环境中发挥了十分重要的作用。这种分子囊泡的双层结构和高浓度的脂质成分,决定了其在细胞外环境中的稳定性,并构成了外泌体转运的结构基础[14]。外泌体作为载体携带大量功能性物质(如核酸、miR⁃NA 和蛋白)参与了机体的各项生理和病理过程,包括新血管生成、细胞分化、免疫应答和肿瘤侵袭等等[15-16]。在肿瘤的发生发展及诊疗过程中,外泌体介导细胞间信息通讯并影响细胞与肿瘤微环境间的关系。目前,外泌体在肿瘤治疗中的临床应用主要包括早期检测、预后评估、免疫系统刺激剂以及靶向药物的载体运输[17-18]。随着对液体活检的可测性了解的增加,新型肿瘤标志物诊断和预后的开发已经成为肿瘤治疗一个广泛的研究领域。外泌体所含有的原始细胞的特定分子和其稳定性及丰富性,使得其作为其新的标志物在联合检测和预后监测中发挥出巨大的优势。例如,最近研究表明glypican-1蛋白是一种新的有潜力用于胰腺癌诊断的生物标志物,它通常在癌细胞中富集。同样,在胰腺癌患者的血清中检测到了外泌体蛋白glypican-1,具有极高的特异性和敏感性,可以用来区分健康人、良性疾病患者和早晚期胰腺癌患者[19]。除此之外,研究报道细胞骨架相关蛋白4(CKAP4)与分泌性蛋白DKK1 在胰腺导管腺癌中的同时表达与患者预后不良相关,提示其可能成为胰腺癌治疗的生物标志物和分子靶标[20]。
EphA2 蛋白已经证实在乳腺癌、卵巢癌及肺癌等多种癌症中都高表达,发挥癌基因的功能[21-23]。它通过促进细胞增殖和侵袭,在癌症的进展和转移中起着重要作用。同样,分子研究证实EphA2 的过度表达会增加体外胰腺癌细胞系的迁移侵袭力和对吉西他滨的耐药性,而诱导EphA2 基因的敲除则有相反的效果。EphA2 siRNA 还能够减少胰腺癌小鼠肿瘤的生长和转移,以及增加肿瘤相关的细胞凋亡[6-7]。血清外泌体EphA2 蛋白是否在液体活检中发挥同样的功能,作为胰腺癌诊断和预后的标志物还未可知。
本研究中证实血清中外泌体EphA2 蛋白在胰腺癌患者体内高表达,并与患者的肿瘤分期和淋巴结转移相关。同时研究发现,血清中外泌体EphA2蛋白表达阳性的患者3 年生存率低于阴性组,原因可能是外泌体EphA2 蛋白的高表达加强改变了患者本身对化疗药物的耐药性[7]。说明外泌体EphA2蛋白的高表达很可能与胰腺癌患者预后不良相关,并有可能成为胰腺癌预后不良的肿瘤标志物。
综上所述,胰腺癌患者血清外泌体EphA2 蛋白表达水平升高,与胰腺癌TNM 分期、淋巴结转移有关;血清外泌体EphA2 蛋白高表达的胰腺癌患者3年生存率低。胰腺癌患者血清外泌体EphA2 蛋白可以作为胰腺癌潜在预后评估标志物。
