3种蜂花粉酚类化合物组成及抗氧化活性研究
2021-04-16徐元元杨二林王小超赵浩安
徐元元,王 悦,杨二林,王小超,赵浩安,程 妮,3,曹 炜,3
(1.西北大学 食品科学与工程学院,陕西 西安 710069;2.西北大学 化工学院,陕西 西安 710069;3.陕西省蜂产品工程技术研究中心,陕西 西安 710065)
蜂花粉是蜜蜂采集被子植物雄蕊花药或裸子植物小孢子囊内的花粉,形成的团粒状物[1],是自然界营养最丰富的天然食品之一。蜂花粉富含糖类、蛋白质、游离氨基酸、不饱和脂肪酸、矿物质元素、维生素和酚类化合物等多种生物活性物质[2-3]。近年来,研究表明蜂花粉多酚提取物具有抗氧化、抗炎、抑菌、抗肿瘤,提高机体免疫能力等生理活性[4-6]。
植物酚类物质主要分为可溶性酚类(水有机相中)和不溶性酚类(残渣中)。可溶性酚类物质以游离态、酯键合态、糖苷键合态形式存在[7]。不溶性酚类共价结合蛋白质、果胶等物质[8],通过酸、碱水解破坏化学键,释放酚类物质。近年来有研究发现,红枣多酚类物质以游离态、酯键合态、糖苷键合态酚类化合物存在[9],长黑青稞多酚以可溶性、游离、酯化、醚化和不溶键合态存在[10]。本课题组前期对东北盛产的槭树、蒲公英和山里红蜂花粉的多酚类物质的存在形态进行了研究,发现蜂花粉的多酚类物质主要以游离态形式存在[11]。油菜、茶花和玫瑰蜂花粉产量丰富,是我国的大宗蜂花粉,其酚类物质的存在形态未见研究报道,因此有必要开展这3种蜂花粉的酚类化合物组成及其抗氧化活性研究。
本研究以我国主产的茶花、玫瑰和油菜蜂花粉为对象,分析蜂花粉中不同存在形态的酚类物质(游离态、酯键合态、甲醇不溶态、糖苷键合态)的组成与含量,DPPH自由基清除能力、Fe2+络合能力、Fe3+还原能力和对质粒DNA氧化损伤的保护能力等体外抗氧化活性,以明确蜂花粉多酚类物质的存在形态及抗氧化活性,为蜂花粉抗氧化功能食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
茶花、玫瑰和油菜蜂花粉均产自湖北省,并经过了花粉孢子检验[12-14],确定每种蜂花粉的种类。
没食子酸、芦丁、11-二苯基-2-苦肼基自由基(DPPH自由基)、Na2EDTA、6-羟基-2,5,7,8-四甲基苯并二氢吡喃(Trolox)、三吡啶基三嗪(TPTZ)、酚类标准品(没食子酸、对羟基苯甲酸、2-4-二羟基苯甲酸、丁香酸、p-香豆酸、阿魏酸、芦丁、鞣花酸、柚皮素、肉桂酸、山奈酚、槲皮素、异甘草素)均从Sigma公司(美国)购买;琼脂糖购于BioWest公司(西班牙);pBR322 DNA从Takara生物技术公司(日本)购买;色谱级甲醇,过氧化氢(H2O2)、三羟甲基氨基甲烷(Tris)购于科昊生物工程有限公司,其他试剂均为国产分析纯。
1.2 蜂花粉酚类物质的提取
不同存在形态酚类物质的提取采用溶剂萃取和酸碱水解相结合的方法[9,15-16]。
1.2.1 游离态酚类物质的提取 分别称取3种花粉20 g,按1∶15(m/V)加75%乙醇,热回流2 h后离心,保留上清液,沉淀重复以上操作2次。浓缩上清液,用6 mol/L HCl酸化至pH为2,离心,上清液用2倍体积的正己烷脱脂3次,脱脂后用乙酸乙酯和乙醚(1∶1,V/V)(简称AE/DE)萃取至无色,合并萃取液,用无水硫酸钠干燥后过滤,真空旋蒸至干,复溶于5 mL 75%乙醇,置于-4℃冰箱中保存备用,标记为游离态酚类物质。
1.2.2 酯键合态酚类物质的提取 向上述游离态多酚提取后的剩余物中加入10 mL的NaOH溶液,充入氮气,室温下碱水解4 h后,用6 mol/L的HCl溶液调至pH=2,再用AE/DE萃取至无色,合并萃取液,用无水硫酸钠干燥后过滤,真空旋蒸至干,复溶于5 mL 75%乙醇,置于-4℃冰箱中保存备用,标记为酯键合态酚类物质。
1.2.3 糖苷键合态酚类物质的提取 从酯键合态多酚提取后的水相中加入6 mol/L HCl,85℃下酸化30 min,用AE/DE萃取至无色,合并萃取液,用无水硫酸钠干燥后过滤,真空旋蒸至干,复溶于5 mL 75%乙醇,置于-4℃冰箱中保存备用,标记为糖苷键合态酚类物质。
1.2.4 甲醇不溶态酚类物质的提取 取出离心后的固体残渣用4 mol/L NaOH在室温下碱水解4 h,再用6 mol/L HCl酸化至pH为2,离心,弃去滤渣,上清液用2倍体积的正己烷脱脂3次,然后用AE/DE萃取至无色,合并萃取液,用无水硫酸钠干燥后过滤,真空旋蒸至干,复溶于5 mL 75%乙醇,置于-4℃冰箱中保存备用,标记为甲醇不溶态酚类物质。
1.3 色谱分析
采用高效液相色谱(HPLC-DAD)法测定蜂花粉酚类化合物含量[17],HPLC-DAD(Agilent Technologies Deutschland,Germany)色谱柱Zorbax SB-C18(250 mm,5.0 μm);流动相是甲醇(A)和0.1%甲酸(B);洗脱程序为:0 min,15% A;0~5 min,17% A;5~10 min,30%A;10~25 min,40% A;25~35 min,50% A;35~40 min,55% A;40~55 min,60% A;55~65 min,65% A;65~70 min,70% A;70~75 min,70% A。流速为1.0 mL/min,进样量是10 μL,二极管阵列检测器(DAD);检测波长:254 nm、280 nm、290 nm、324 nm;柱温是30℃。配置0.05、0.1、0.2、0.5、1 mg/mL的标准溶液,得到标准曲线。通过比对保留时间和二维谱图确定花粉多酚的种类,将HPLC-DAD图中酚类化合物的峰面积带入标准曲线定量。
1.4 不同存在形态酚类化合物体外抗氧化活性的测定
1.4.1 总酚含量测定 参照Zhou等方法测定不同花粉提取液的总酚含量[18]。用乙醇将待测液稀释10倍,准确移取1 mL不同待测稀释液至10 mL刻度试管中,依次加入1 mL福林酚试剂、5 mL Na2CO3(1 mol/L),蒸馏水定容到10 mL,充分混匀后避光静置1 h。760 nm测量吸光度,结果以没食子酸当量(mg GAE/g花粉)表示。
1.4.2 总黄酮含量测定 在Blasa等方法的基础上加以改进[19],测定不同花粉提取液的总黄酮含量。移取1 mL不同花粉提取液至10 mL刻度试管中,加入0.4 mL NaNO2(5%),6 min后加入0.4 mL Al(NO3)3(10%),反应6 min后加入4 mL NaOH(4%),加4.2 mL 80%甲醇,振荡混匀后室温放置15 min。510 nm测量吸光度,结果以芦丁当量(mg RE/g花粉)表示。
1.4.3 Fe2+络合力测定 参照Nandita等方法并稍作修改进行测定[20]。取200 μL不同花粉提取液,依次加入100 μL FeSO4(1 mM)、300 μL Ferrozine(1 mM)、2.4 mL甲醇,混匀静置10 min。562 nm测量吸光度,结果表示为Na2EDTA当量(mg Na2EDTA/g花粉)。
1.4.4 Fe3+还原力测定 参照Benzie等方法测定不同花粉提取液的铁离子还原能力[21]。取1 mL的不同花粉提取液,加入4.0 mL的TPTZ工作液(包括300 mM pH=3.6醋酸盐缓冲液,10 mM TPTZ,20 mM FeCl3,按10∶1∶1配置),37℃水浴10 min。593 nm测量吸光度,结果表示为mg Trolox/g花粉。
1.4.5 DPPH自由基清除能力测定 对Thaipong等人的研究方法进行改进,测定不同花粉提取液对DPPH自由基的清除能力[22]。分别吸取0.1、0.2、0.3、0.4、0.5、0.6 mL的不同花粉提取液,用75%的甲醇定容至1 mL,加入4 mL DPPH(0.04 mg/mL)后避光反应1 h。517 nm测量吸光度,结果用IC50(清除率是50%时,所需花粉提取液的浓度)表示,DPPH自由基清除率计算公式

其中:A0为参比溶液的吸光值;A1为反应1 h后样品溶液的吸光值。
1.5 对·OH诱导的pBR322质粒DNA氧化损伤保护作用的测定
参照Yeung等方法进行测定[23]。正常组加入0.5 μg DNA和14 μL PBS,模型组加入0.5 μg DNA、1 μL 1 mM FeSO4、1 μL H2O2、12 μL PBS,实验组是0.5 μg DNA、1 μL 1 mM FeSO4、1 μL H2O2、3 μL不同花粉提取液、9 μL PBS。反应液于37℃避光水浴30 min,0.8%的琼脂糖凝胶中电泳50 min。使用凝胶成像仪(UVP Gelstudio touch)进行拍照,通过Quantity One软件分析电泳各条带的光密度,确定DNA双螺旋与开链的百分比,以比较不同花粉提取液对·OH诱导的DNA氧化损伤的保护作用。
1.6 数据分析
采用Excel 2010初步处理数据,SAS 8.1进行方差分析和显著性分析,Origin 9.0作图。结果表示为平均值±标准差,P<0.05代表显著差异。
2 结果与分析
2.1 不同存在形态酚类化合物组成
2.1.1 不同存在形态酚类化合物组成的色谱分析结果 本研究采用HPLC-DAD对3种蜂花粉不同存在形态酚类化合物进行鉴定(见图1),其种类和含量有所不同,结果见表1。茶花蜂花粉共检出9种酚类化合物,其中没食子酸、槲皮素和山奈酚主要存在于游离态和酯键合态中,且游离态中的槲皮素和山奈酚含量是酯键合态的2倍多。游离态中山奈酚的含量为1 103.7 μg/g,与彭国霞研究的茶花蜂花粉游离态中山奈酚的含量相近[24]。对羟基苯甲酸仅存在于酯键合态中,含量为72.5 μg/g。p-香豆酸、阿魏酸和鞣花酸是甲醇不溶态的主要成分。糖苷键合态中以没食子酸和山奈酚为主,但均低于游离态中的含量。
玫瑰蜂花粉提取物中共检出7种酚类化合物,其中鞣花酸含量最高,主要存在于游离态中,为315.56 μg/g,分别是酯键合态、糖苷键合态的5倍和19倍,高于庄永亮等报道的玫瑰蜂花粉游离态中鞣花酸的含量[25],可能是萃取方法不同造成的差异。甲醇不溶态中没食子酸含量为121.40 μg/g,约为游离态中的3倍。肉桂酸在游离态和酯键合态中均有分布,甲醇不溶态中痕量检出。山奈酚在游离态、酯键合态、糖苷键合态中均有分布,这与茶花蜂花粉中山奈酚的分布类似。
油菜蜂花粉提取物中共检出8种,其中含量较高的是柚皮素、芦丁、槲皮素和p-香豆酸。柚皮素主要以游离态的形式存在,含量为1 509.46 μg/g,在前人研究的蜂花粉成分中未见报道。芦丁在游离态和酯键合态中的含量分别为129.87、229.83 μg/g,均低于Kakonien等人研究的油菜蜂花粉醇提物中芦丁的含量[26],这可能与提取方式和花粉不同地理来源有关。槲皮素多以游离态的形式存在,含量为283.38 μg/g,是酯键合态中的4.7倍,在糖苷键合态中痕量检出。p-香豆酸在游离态、酯键合态、糖苷键合态中均有检出,其中游离态中含量为186.57 μg/g,远高于其他2种形态中的含量。

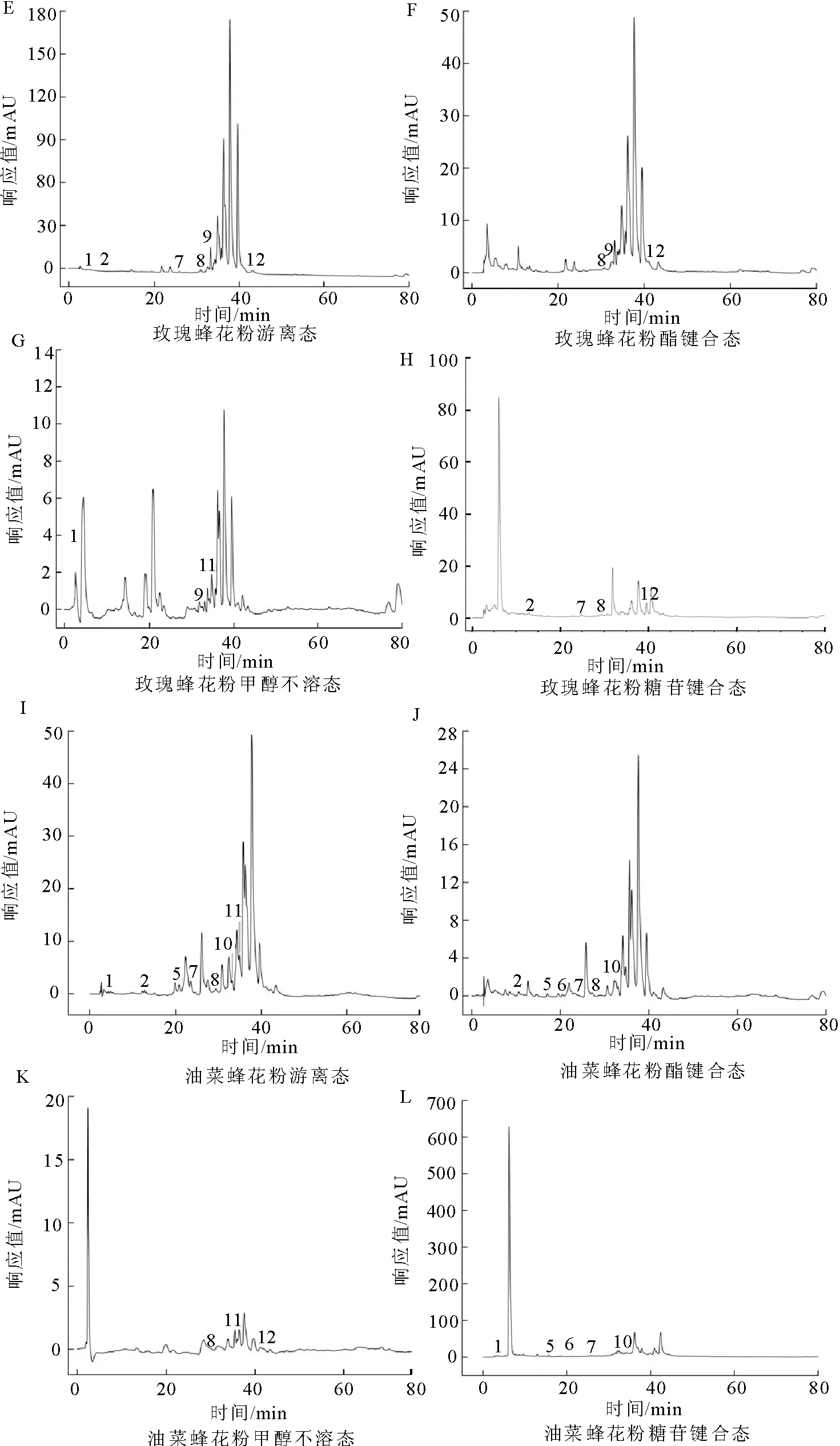
注:峰1 没食子酸;峰2 对羟基苯甲酸;峰3 2,4-二羟基苯甲酸;峰4 丁香酸;峰5 p-香豆酸;峰6 阿魏酸;峰7 芦丁;峰8 鞣花酸;峰9 肉桂酸;峰10 槲皮素;峰11 柚皮素;峰12 山奈酚;峰13 异甘草素。图1 3种蜂花粉不同存在形态HPLC图Fig.1 HPLC chromatogram of different phenolic extracts from three kinds of bee pollen
总之,蜂花粉游离态、酯键合态、甲醇不溶态和糖苷键合态酚类化合物的组成与含量有较大的差别,且主要以游离态和酯键合态形式存在。
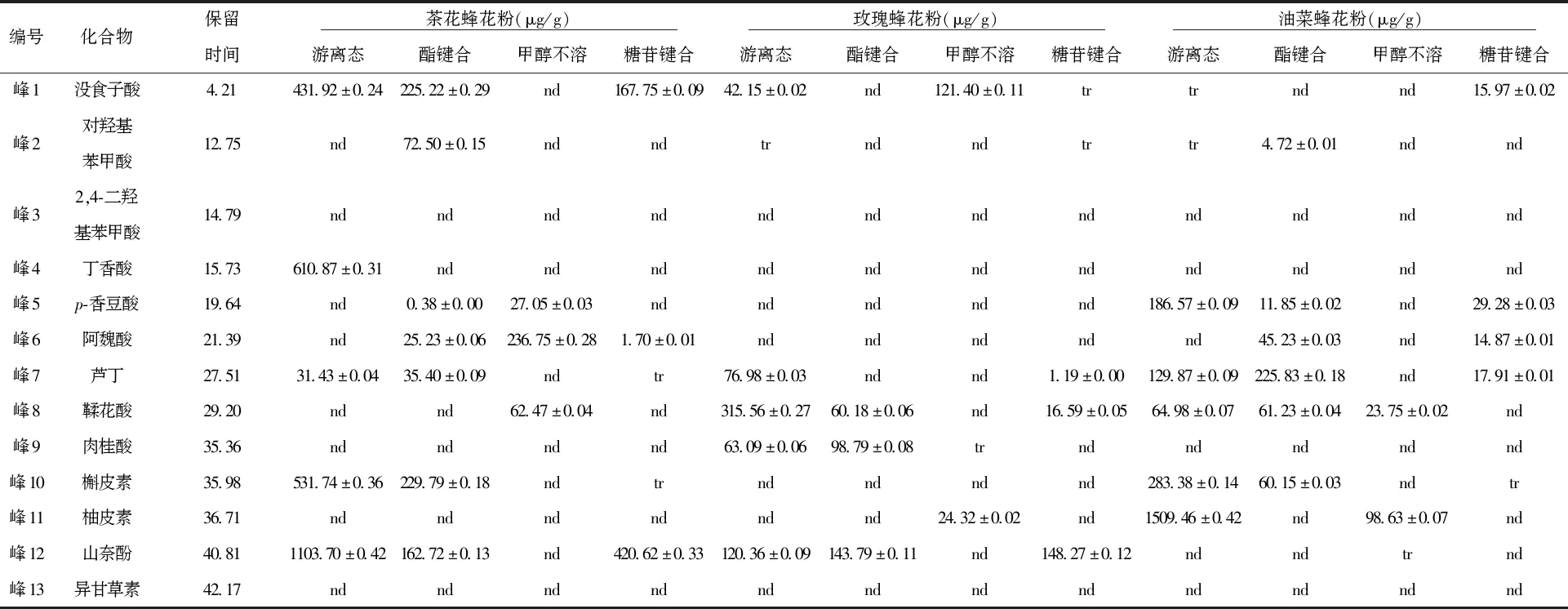
表1 3种蜂花粉酚类化合物的组成与含量Tab.1 Profile and content of phenolic extracts in three kinds of bee pollen
2.1.2 总酚和总黄酮含量 3种蜂花粉总酚和总黄酮含量见表2。不同存在形态酚类提取物中总酚、总黄酮含量有显著性差异(P<0.05),3种蜂花粉中游离态总酚的含量最高,分别占4种形态总和的55.47%、47.92%、57.39%,其次是酯键合态,分别占4种形态总和的24.04%、39.40%、20.84%,含量最低的是甲醇不溶态。茶花蜂花粉的总酚总量最高,玫瑰蜂花粉和油菜蜂花粉总量相近,两者无显著性差异。本研究中茶花蜂花粉(湖北省)游离态总酚含量为11.26 mg GAE/g,高于彭国霞等人报道的5个产地(湖南、安徽、浙江、四川、江西)的茶花蜂花粉,其报道中总酚含量为8.41~8.97 mg GAE/g[27],说明不同地理来源的蜂花粉总酚含量可能有所不同。
由表2知,4种不同存在形态酚类提取物的总黄酮分布不同。与上述酚酸的分布类似,茶花蜂花粉的游离态总黄酮含量最高,达到56.63%,酯键合态含量占总量的29.76%,最低是甲醇不溶态,含量占比为3.81%;玫瑰蜂花粉的游离态黄酮占4种形态黄酮总量的50.68%,其次是酯键合态为37.89%,甲醇不溶态和糖苷键合态黄酮含量占比分别为7.11%、4.33%(P<0.05);油菜蜂花粉游离态的黄酮含量显著高于其他3种形态的黄酮含量(P<0.05),甲醇不溶态与糖苷键合态的黄酮含量最低。从蜂花粉的总黄酮含量来看,三者无显著性差异且本研究中玫瑰蜂花粉总黄酮含量高于陈南迪等人测得的玫瑰蜂花粉(4.29 mg RE/g)[28]。

表2 3种蜂花粉的总酚和总黄酮含量Tab.2 Total phenolic and total flavonoid content of three kinds of bee pollen
2.2 不同存在形态酚类化合物的抗氧化活性
2.2.1 Fe2+络合能力 Fe2+诱导芬顿反应,生成强氧化性的羟基自由基[29],因此可通过Fe2+络合力评价物质抗氧化活性的强弱。蜂花粉4种存在形态的酚类物质对Fe2+的络合能力见表3。不同存在形态酚类物质络合Fe2+的能力具有显著性差异(P<0.05),游离态络合Fe2+的能力最强,达到0.33~0.45 mg Na2EDTA/g之间,其次是酯键合态,络合能力为0.22~0.29 mg Na2EDTA/g,糖苷键合态络合Fe2+的能力最弱。3种蜂花粉甲醇不溶态的Fe2+络合能力都强于糖苷键合态,这可能与其多酚组成有关。

表3 3种蜂花粉的Fe2+络合能力Tab.3 Ferrous ion-chelatingactivity of three kinds of bee pollen
2.2.2 Fe3+还原能力 Fe3+还原能力常用于评价物质抗氧化活性。低pH条件下,Fe3+-TPTZ复合物被还原剂还原为Fe2+-TPTZ复合物,在593nm有最大吸收波长[30]。3种蜂花粉游离态、酯键合态、甲醇不溶态和糖苷键合态的酚类物质Fe3+的还原能力见表4,不同存在形态的酚类物质对Fe3+的还原能力各不相同,具有显著性差异(P<0.05)。游离态酚类物质还原能力最强,每克该提取物的还原能力相当于19.46~24.57 mg Trolox,是甲醇不溶态的5~10倍,其次是酯键合态,为10.93~16.68 mg Trolox/g。本研究茶花蜂花粉游离态Fe3+还原能力显著高于彭国霞等人测得茶花粉游离态Fe3+还原能力(5.37 mg Trolox/g)[24]。Fe3+还原能力随着总酚、总黄酮含量的上升而增强,与总酚含量有较强相关性[31]。
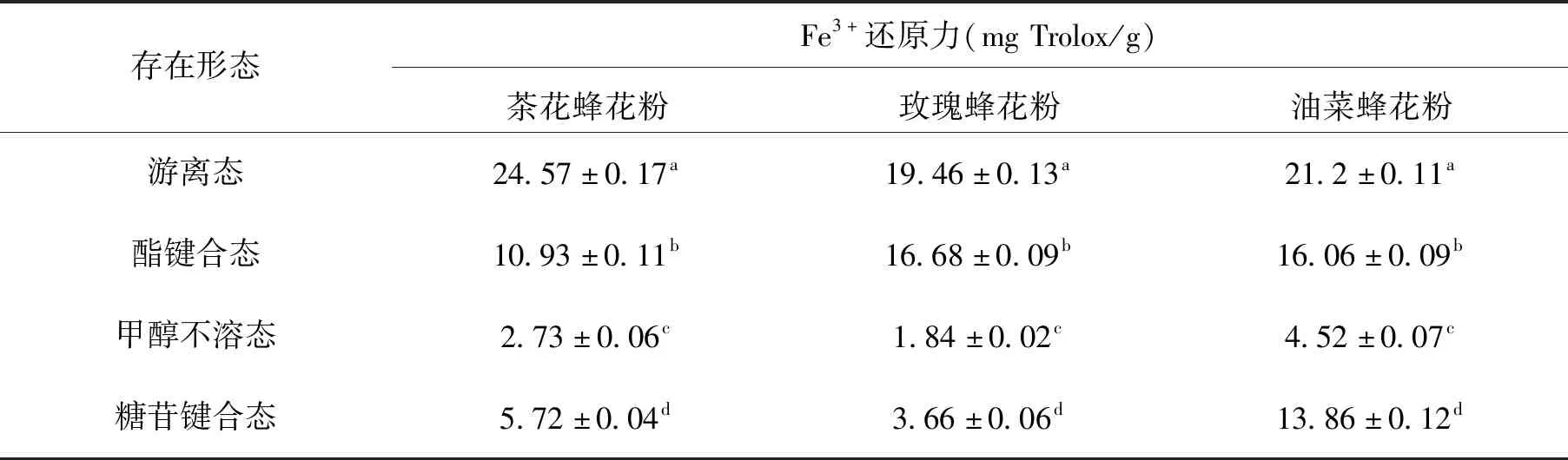
表4 3种蜂花粉的Fe3+还原能力Tab.4 Ferric reducing antioxidant power of three kinds of bee pollen
2.2.3 DPPH自由基清除能力 DPPH是一种稳定的自由基,它可接受电子或氢自由基成为稳定分子,在抗氧化剂的存在时被还原,广泛用于测定可清除活性氧的化合物的抗氧化能力[32]。本研究中,不同存在形态的酚类物质对DPPH自由基清除能力以IC50值衡量,IC50值与清除能力成反比。由表5可知,游离态酚类物质清除能力最强,为6.86~8.07 mg/mL,其中玫瑰蜂花粉是8.07 mg/mL,低于张燕新测得玫瑰蜂花粉(10.03 mg/mL)[33],可能与产地、品种有关;酯键合态的清除能力次之,在9.26~13.77 mg/mL之间;甲醇不溶态清除能力最弱。蜂花粉不同存在形态的酚类物质对DPPH自由基的清除能力不同,这与其酚类物质的种类和含量有关。

表5 3种蜂花粉的DPPH自由基清除能力Tab.5 DPPH radical scavenging ability of three kinds of bee pollen
2.3 对·OH诱导的质粒DNA氧化损伤的保护作用
Fe2+条件下,芬顿反应中过氧化氢(H2O2)生成羟基自由基(·OH),能够破坏DNA双螺旋结构,而酚类物质能够络合Fe2+或清除H2O2,阻止Fenton反应的发生,减少DNA双螺旋结构的破坏[34]。由图2可知,茶花蜂花粉中不同存在形态酚类物质对·OH诱导的质粒DNA氧化损伤都具有保护作用。其中,游离态酚类物质对DNA的保护高达97.58%,显著高于其他3种形态(P<0.05),酯键合态、糖苷键合态、甲醇不溶态依次降低,分别为85.89%、79.29%、51.14%(P<0.05),这可能与茶花蜂花粉游离态酚类提取物中高含量的没食子酸、丁香酸、槲皮素和山奈酚有关。由图3和图4可知,玫瑰蜂花粉和油菜蜂花粉中4种形态酚类物质对·OH诱导的DNA氧化损伤的保护作用均与茶花蜂花粉相似,游离态酚类物质的保护率>酯键合态>糖苷键合态>甲醇不溶态,对质粒DNA的保护能力与酚类含量呈正相关性。总之,茶花蜂花粉对·OH引起的质粒DNA氧化损伤的保护作用最强,油菜蜂花粉次之,玫瑰蜂花粉最弱。
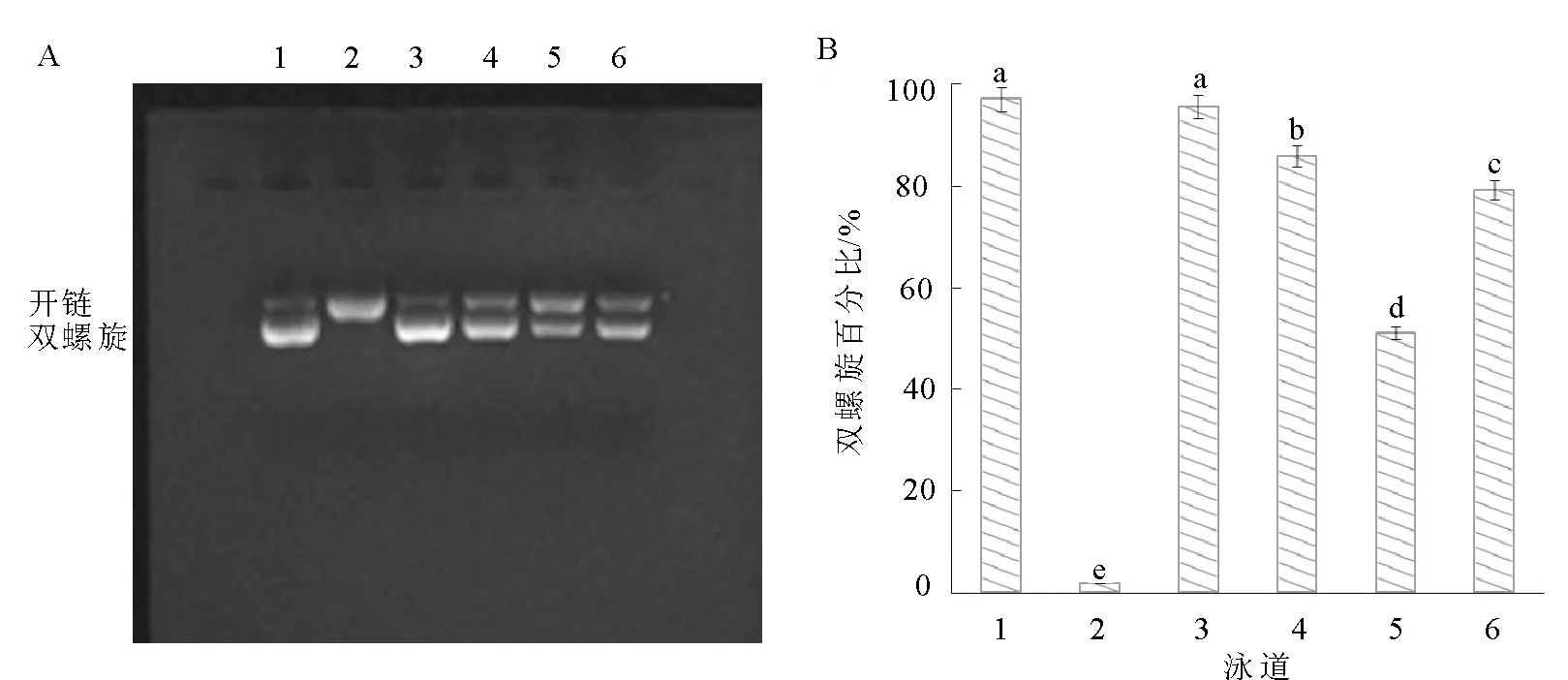
注:泳道1是0.5 μg pR322DNA(正常组);泳道2是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2(模型组);泳道3~6是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2+3 μL茶花蜂花粉不同存在形态酚类物质(泳道3~6分别是游离态、酯键合态、甲醇不溶态、糖苷键合态)。图2 茶花蜂花粉对·OH诱导的质粒DNA氧化损伤的保护作用Fig.2 Protective effect of Camellia Japonica bee pollen on plasmid DNA oxidative damage induced by hydroxyl radical
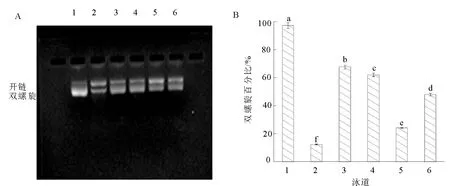
注:泳道1是0.5 μg pBR322DNA(对照组);泳道2是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2(模型组);泳道3~6是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2+3 μL玫瑰蜂花粉不同存在形态酚类物质(泳道3~6分别是游离态、酯键合态、甲醇不溶态、糖苷键合态)。图3 玫瑰蜂花粉对·OH诱导的质粒DNA氧化损伤的保护作用Fig.3 Protective effect of rose bee pollen on plasmid DNA oxidative damage induced by hydroxyl radical
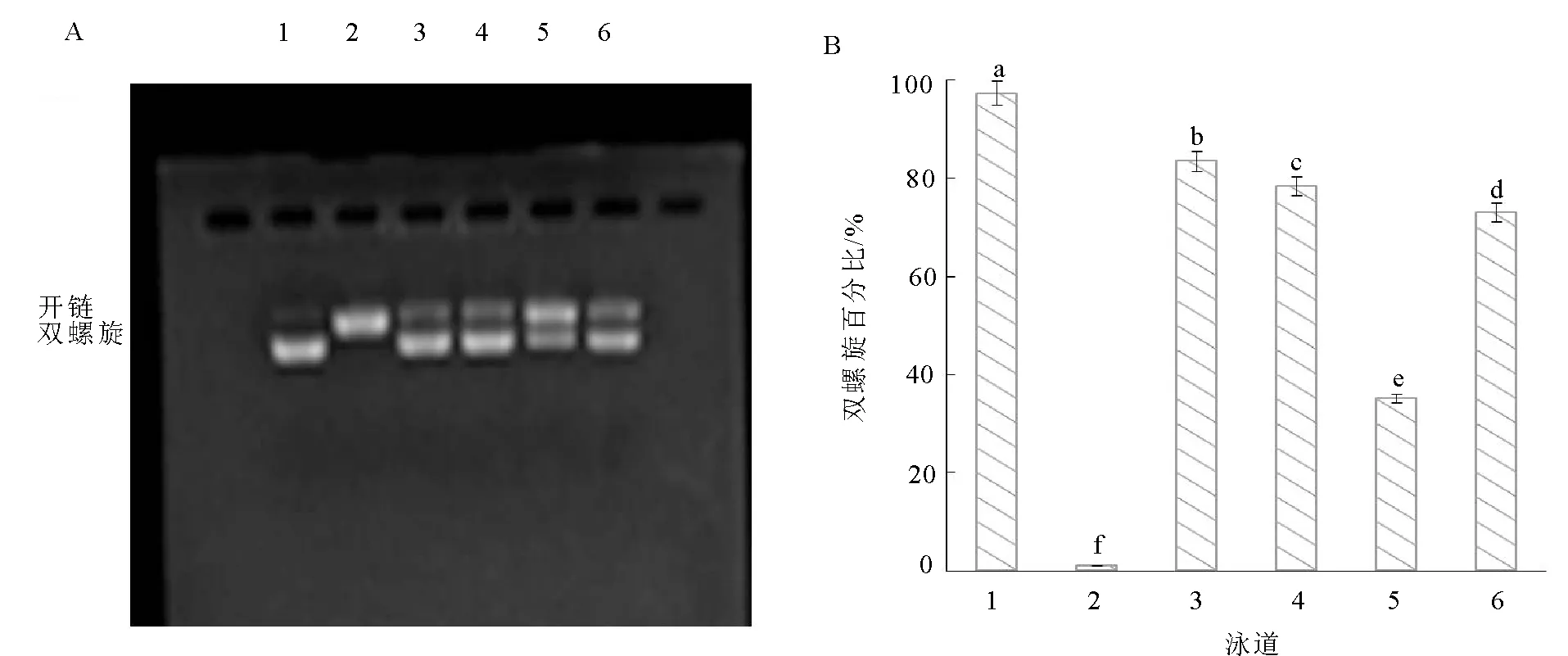
注:泳道1是0.5 μg pBR322DNA(对照组);泳道2是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2(模型组);泳道3~6是0.5 μg pBR322DNA+1 μL 1 mM FeSO4+1 μL 1% H2O2+3 μL油菜蜂花粉不同存在形态酚类物质(泳道3~6分别是游离态、酯键合态、甲醇不溶态、糖苷键合态)。图4 油菜蜂花粉对·OH诱导的质粒DNA氧化损伤的保护作用Fig.4 Protective effect of rape bee pollen on plasmid DNA oxidative damage induced by hydroxyl radical
3 结论
本文研究了茶花蜂花粉、玫瑰蜂花粉、油菜蜂花粉中4种存在形态的酚类化合物的组成与含量、抗氧化活性及其对·OH引起的质粒DNA氧化损伤的保护作用。结果表明,不同存在形态酚类化合物的多酚组成及含量有一定的差异,没食子酸、丁香酸、槲皮素和山奈酚是茶花蜂花粉的游离态和酯键合态提取物的主要成分。游离态提取物的总酚、总黄酮含量最高,抗氧化活性也最强,对·OH介导的DNA氧化损伤的保护效果最好,其次是酯键合态提取物。因此,在开发蜂花粉抗氧化食品时,可以主要考虑游离态和酯键合态的酚类物质的提取与产品开发。本研究为蜂花粉抗氧化功能食品的开发提供理论参考。
