miR-16 在冠状动脉粥样硬化斑块进展中的作用及初步机制研究
2021-04-15于晨溪叶佳雯
查 晴,于晨溪,刘 亚,杨 玲,叶佳雯,刘 艳
(1.上海交通大学医学院附属第九人民医院心血管内科,上海 200011;2.上海交通大学医学院附属瑞金医院心血管内科,上海 200025)
冠心病为冠状动脉粥样硬化斑块引起血管腔狭窄、阻塞或功能性改变导致心肌缺血或坏死,是最常见的心血管疾病[1]。近年来,我国的冠心病患病率逐年增高,2019 年估计我国的冠心病患者已达1 100 万例,且农村地区的冠心病死亡率明显上升,2017 年农村居民冠心病死亡率为122.04/10万,超过城市水平[2]。遗传因素、脂代谢紊乱、内皮损伤、平滑肌细胞增殖和迁移、内源性免疫调控异常及炎症反应等是动脉粥样硬化发生、发展的主要机制[1,3]。冠状动脉粥样硬化斑块形成大致可分为脂纹、纤维斑块和粥样斑块3 个阶段[4],在整个过程中可观察到低密度脂蛋白 (low density lipoprotein,LDL)透过内皮细胞深入内皮细胞间隙,促使单核细胞迁入内膜;进而氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL) 与巨噬细胞表面清道夫受体结合并被摄取,诱导巨噬细胞转化为泡沫细胞;之后,血管中层平滑肌细胞大量增殖、迁移,并分泌细胞外基质形成纤维帽,待oxLDL 累积后,泡沫细胞坏死、崩解,释放炎症因子,最终形成粥样斑块[4]。在这一病理过程中,oxLDL 诱导巨噬细胞向泡沫细胞转化,后者大量凋亡和释放炎症因子,是导致纤维斑块向粥样斑块进展的重要病理机制[4-6]。在粥样斑块组织中,泡沫细胞大量浸润和形成,其凋亡显著高于纤维斑块中的泡沫细胞[7]。
微小RNA(microRNA,miRNA,miR)调控多种参与动脉粥样硬化病理生理过程的细胞功能,但其对泡沫细胞凋亡的作用机制目前尚不明确[8]。miRNA 是由21~25 个核苷酸组成的非编码RNA,其与靶mRNA 的3′-非翻译区 (3′-untranslated region,3′-UTR)结合,调控靶mRNA 的翻译和降解,在调控心血管组织中细胞的分化、发育和凋亡等中发挥重要作用[9]。以往研究表明,miR-146a 不仅可经TLR4-Myd88-IRAK1-TRAF6-NFκ B 细胞信号通路控制炎症反应,还可经TLR4-Src-FAK-JNK 细胞信号通路控制细胞吞脂[10]。然而,关于miR-16 在调节斑块局部炎症反应中发挥促进炎症还是抑制炎症的作用,以及其在粥样斑块进展中发挥促进还是抑制作用,目前仍存在争议[11-12]。本研究采用miRNAs 微阵列芯片(miRNAs array)检测及比较冠心病患者的冠状动脉纤维斑块与粥样斑块中miR-16 的表达情况,并建立oxLDL 诱导的泡沫细胞模型,初步探究miR-16 在调控冠状动脉粥样硬化中的作用,这可能为将来控制冠状动脉斑块进展及预防和治疗冠心病提供新的靶点。
材料与方法
一、材料
1.组织获取:选取2016 年6 月至2017 年6 月间的16 例冠心病患者(排除风湿性心脏病、先天性心脏病及炎症性疾病),所有患者均接受了冠状动脉旁路移植术治疗,于术中获取冠状动脉斑块组织。所有患者均签署书面知情同意书,且本研究经上海交通大学医学院附属瑞金医院伦理委员会审批同意。
2.细胞及试剂:THP-1 细胞 (人急性单核细胞白血病细胞,在佛波肉荳蔻醋酸诱导下向单核系方向分化) 购自中国科学院上海细胞生物所细胞中心。本研究所用试剂中,10%胎牛血清、1×磷酸盐缓冲液、100×双抗(青霉素和链霉素)、100×三抗(青霉素、链霉素和两性霉素)、0.25%胰蛋白酶(含EDTA)、含1‰吐温20 的磷酸盐缓冲液均购自Gibco 公司(美国)。RPMI-1640 培养基、酶联免疫吸附试验检测相关炎症因子[白细胞介素(interleukin,IL)-6、IL-8、单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)和基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)]购自Invitrogen 公司(美国),TUNNEL 检测试剂盒购自Promega 公司 (美国)。miRNA 转染巨噬细胞使用lipofectamine 2000,由Invitrogen 公司提供,miR-16 由上海吉凯公司合成并提供。RNA 反转录试剂盒及实时PCR 检测试剂盒由日本TaKaRa 公司提供,miRNAs array由Affymetrix 公司提供 (Affymetrix miRNA 4.0,美国)。
二、方法
1.冠状动脉组织的处理和分组:术后将患者的冠状动脉组织送病理学检查,对组织切片行苏木精-伊红(hematoxylin-eosin,HE)染色,根据斑块特征分为纤维斑块型及粥样斑块型(见图1)。采用miRNAs array 检测miR-16 在冠状动脉纤维斑块和粥样斑块中的表达情况。
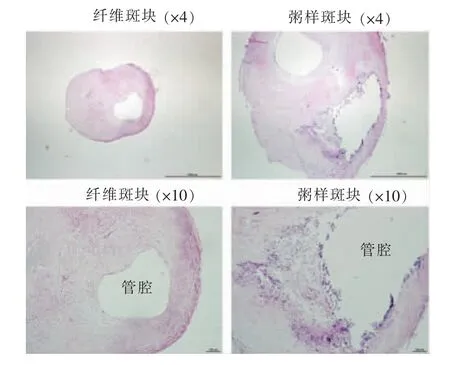
图1 冠状动脉纤维斑块及粥样斑块病理图片
2.反转录聚合酶链反应及miRNAs array 检测:用RNeasy Mini Kit 抽提细胞的总RNA 共10 μg,进行反转录后获得用生物素标记的cRNA。取10 μg的cRNA 杂交Affymetrix miRNA 4.0 芯片,一共检测2 000 个miRNA 的表达情况。基因芯片使用GeneChip Scanner 3000 扫描杂交信号,用分析软件GeneSpring GX 7.3.1 对杂交信号进行均一化、筛选以及基因功能分类分析,利用随机方差模型,计算每个miRNA 的P 值和误判率 (false discovery rate,FDR),筛选出在2 种斑块间差异表达的基因(表达变化>1.5 或<0.5,P<0.05)。
2.佛波肉荳蔻醋酸诱导THP-1 细胞转化为巨噬细胞:将THP-1 细胞用含10%胎牛血清(Gbico公司,美国)的RPMI-1640 培养基(Invitrogen),在37 ℃、5% CO2条件下培养THP-1 细胞至106/mL;换为无血清培养基,加入佛波肉荳蔻醋酸至终浓度为100 nmol/L,孵育24~48 h。THP-1 细胞在刺激48 h 后,由悬浮状态转化为粘附状态,贴附于细胞培养皿底部,贴壁细胞即为转化完成的巨噬细胞。洗去未贴壁的细胞,加入新鲜培养基培养巨噬细胞。
3.oxLDL 诱导巨噬细胞转化及泡沫细胞凋亡、炎症因子释放检测:分别用0、25、50 μg/mL 的oxLDL 刺激巨噬细胞,采用TUNEL 检测、细胞计数和蛋白质印迹法检测不同浓度oxLDL 刺激下的泡沫细胞形成比例和凋亡比例;不同浓度oxLDL 刺激巨噬细胞24 h 后,用酶联免疫吸附试验检测泡沫细胞上清液中的炎症因子(IL-6、IL-8、MCP-1、MMP-9)水平。
4.miR-16 对于靶点分子表达影响的检测:采用lipofectamine 2000 将外源合成的miR-16 转染至巨噬细胞中,用50 μg/mL 的oxLDL 刺激巨噬细胞,使用TUNEL 检测试剂盒检测细胞的凋亡情况。使用酶联免疫吸附试验试剂盒检测相关炎症因子(IL-6、IL-8、MCP-1 和MMP-9)的分泌。
5.oxLDL 对于miR-16 表达影响的检测:用0、25、50 μg/mL 的oxLDL 刺激巨噬细胞,裂解并收集细胞中总miRNAs,使用miRNAs array 检测miR-16的表达情况。
6.统计学分析:采用SPSS 21.0(IBM,美国)软件进行数据分析。计量资料以平均值±标准差表示,首先进行正态性和方差齐性检验,检验各组数据是否符合正态分布且方差齐,组间采用非配对t 检验。P<0.05 表示差异有统计学意义。
结 果
一、粥样斑块中miR-16 表达上调
对冠心病患者的纤维斑块和粥样斑块进行miRNA 表达谱分析,发现在768 种miRNAs 中有29 种在2 种斑块间表达存在显著差异,其中miR-16、miR-590-3P、miR-1290、miR-223 和miR-140-3p在粥样斑块中的表达显著升高,而miR-1208、miR-296、miR-193a-5p、miR-485-3p 和miR-144 表达显著下降(见图2),提示差异表达的miRNAs 可能参与了粥样斑块发生、发展的病理生理过程。
对在2 种斑块间有差异表达的miRNA 进行分析,结果显示,miR-16 的FDR 值为>0.000 1,在所有差异表达的miRNA 中排首位。结合表达差异倍数以及FDR 值差异,后续选择miR-16 作为本研究的研究目标。与冠状动脉纤维斑块相比,冠状动脉粥样斑块组中的miR-16 表达升高1.75 倍。
二、oxLDL 刺激巨噬细胞向泡沫细胞转化并促进泡沫细胞表达miR-16
本研究表现随着oxLDL 水平的升高,巨噬细胞向泡沫细胞的转化增多,泡沫细胞凋亡比例上升,炎症因子IL-6、IL-8、MCP-1 和MMP-9 的释放增加,提示oxLDL 可促发巨噬细胞向泡沫细胞的转化,并诱导其凋亡,同时增加了炎性因子的释放(见图3)。同时,随着oxLDL 水平升高,miR-16 的相对水平也增高,提示oxLDL 可促进泡沫细胞表达miR-16(见图4)。
三、转染miR-16 后促进泡沫细胞凋亡和炎症反应
在上述实验的基础上,经TUNEL 检测和酶联免疫吸附试验检测发现,转染miR-16 后,泡沫细胞的凋亡比例上升,炎症因子IL-6、IL-8、MCP-1 和MMP-9的表达升高(见图5、6),提示miR-16 可进一步加剧泡沫细胞的凋亡以及炎症因子的分泌。
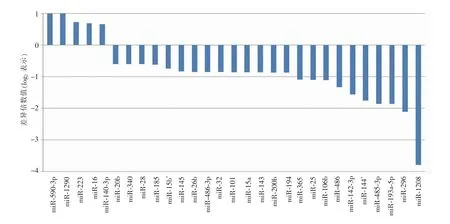
图2 人冠状动脉纤维斑块和粥样斑块差异表达的miRNA

图3 0、25、50 μg/mL oxLDL 诱导泡沫细胞凋亡及炎症因子释放

图4 oxLDL 刺激对泡沫细胞miR-16 表达的影响
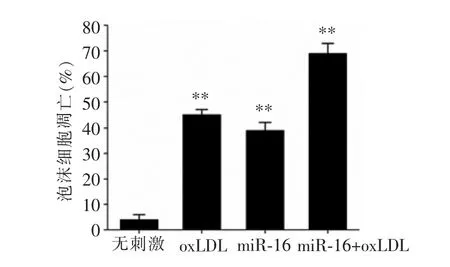
图5 miR-16 对泡沫细胞凋亡的作用

图6 miR-16 对炎症因子分泌的作用
讨 论
在冠状动脉粥样硬化形成过程中,LDL 透过内皮细胞后,在氧化和磷脂酶等作用下转变为oxLDL,oxLDL 进一步与巨噬细胞清道夫受体SR-A、CD36 等结合进入细胞,促进泡沫细胞的形成[13];随着oxLDL 积聚,泡沫细胞崩解形成坏死核心,释放IL-1β、IL-6 等炎症因子,使炎症细胞被招募,抑制细胞外基质的产生,导致粥样斑块形成[14]。本研究发现,与纤维斑块相比,粥样斑块中miR-16 的表达升高。进一步行体外细胞研究,经酶联免疫吸附试验检测证实,oxLDL 在诱导泡沫细胞凋亡的同时,也诱导miR-16 表达上调,且在转染miR-16 后,oxLDL 诱导泡沫细胞凋亡和组织炎症反应也明显增加,提示miR-16 促进了冠状动脉纤维斑块向粥样斑块进展。
本研究中共有5 种miRNA 分子(miR-16、miR-590-3P、miR-1290、miR-223 和miR-140-3P)在粥样斑块中的表达显著升高。其中,miR-590-3P 和miR-223 已被报道可促进斑块中血管形成,进而促进动脉粥样硬化的发展[15-16]。目前,对于miR-1290 和miR-140-3P 的研究主要关注其对肿瘤细胞增殖和转移的影响[17-18],而miR-16 对于动脉斑块局部炎症反应和冠心病的影响目前仍存在争议。miR-16 的上调可以促进NF-κB 调节的IL-8 促炎因子的表达[19]。另一方面,miR-16 也可结合基因的3′UTR 区域,促进炎症因子IL-6、TNF-α 等的mRNA 降解,从而抑制炎症因子的表达[20]。炎症反应是冠状动脉粥样硬化进展的机制之一,而目前关于miR-16 对冠心病的影响尚不明确[21]。一些研究发现,与非冠心病患者相比,冠心病患者的循环miR-16 表达水平下降,但也有部分研究结果与之相反[12,22]。
本研究发现,miR-16 可使局部促炎因子(如IL-6、IL-8)的表达升高,增强泡沫细胞的凋亡,促进冠脉硬化斑块的进展,同时推测这一过程可能涉及以下2 个细胞信号通路。①NF-κB-TNFα-MAPK/JNK 通路:oxLDL 促进了NF-κB 的磷酸化,NF-κB的磷酸化可使miR-16 表达增高,进而导致TNF-α分泌增加,促进泡沫细胞凋亡[23];而TNF-α 的增高又可激活MAPK/JNK,从而促进相关炎症因子释放[24]。②TNFα-NF-κB-Bcl-2/ERK 通路:TNF-α 增加可反向激活NF-κB,使miR-16 表达升高,miR-16靶向性结合mRNA 的3′-UTR,抑制Bcl-2 和MEK1基因表达,直接作用于Bcl-2 和MAPK/ERK 通路,促进细胞凋亡反应,从而促进动脉粥样硬化的进展和恶化[24-26]。
总之,本研究发现,在冠状动脉粥样硬化形成过程中,oxLDL 诱导泡沫细胞的生成和凋亡时,同时促进miR-16 表达上调;而上调的miR-16 表达又进一步诱导泡沫细胞的凋亡和局部炎症反应,促进了冠状动脉粥样硬化的发展。本研究结果可能为今后治疗冠心病和预防急性心肌梗死提供潜在的治疗靶点,抑制斑块部位miR-16 的表达可能可以延缓冠状动脉斑块进展。