皮肌炎合并妇科恶性肿瘤11 例临床特征与短期随访结局分析
2021-04-15冯炜炜沈立翡
刘 畅,曹 华,冯炜炜,沈立翡
(上海交通大学医学院附属瑞金医院a.妇产科,b.皮肤科,上海 200025)
皮肌炎(dermatomyositis,DM)是临床常见的特发性炎症性肌病 (idiopathic inflammatory myopathy,IIM) 之一,主要表现为皮肤及骨骼肌炎性改变,如皮疹、眶周水肿、肌痛及肌无力等,但同时可累及其他系统,如肺、消化道、心脏等[1],部分患者可并发肿瘤。1916 年,Barnes 等[2]首次报道了胃癌合并DM,随后恶性肿瘤合并DM 的病例被逐步发现。DM 患者罹患恶性肿瘤的概率明显高于正常人群[3]。DM 患者合并恶性肿瘤的发病机制尚不明确,但2018 年西班牙学者Pinal-Fernandez 等[4]发现,这可能与血清抗转录中介因子1(transcriptional intermediary factor 1,TIF1)基因突变有关。2001 年,在北欧进行的流行病学调查提示,每年每10 万人中约有5~10 人患DM,女性多见,其中约25%的患者发生恶性肿瘤,以肺癌、结肠癌、乳腺癌和卵巢癌的发生率居高[5],其中女性生殖道肿瘤包括卵巢癌、子宫内膜癌和宫颈癌均有个案报道。但是DM 和妇科肿瘤发病的次序关系、DM 对肿瘤治疗方式的影响、围手术期以及肿瘤的放化疗期间DM 的治疗方案以及肿瘤治疗的疗效与DM 预后之间的关系还不明确。故本研究回顾性分析11 例DM 合并妇科恶性肿瘤患者的临床资料,以期为该类患者的临床诊疗提供参考。
资料与方法
一、资料
收集2015 年至2020 年在上海交通大学医学院附属瑞金医院妇科病区住院的DM 合并妇科恶性肿瘤患者11 例。所有DM 患者诊断均符合1975 年Bohan/Peter 诊断标准。11 例妇科恶性肿瘤的诊断均有组织病理学依据,所有患者根据2020 年国际妇产科联盟妇科 (International Federation of Gynecology and Obstetrics,FIGO)肿瘤分期标准进行分期。
二、方法
1.临床资料:收集患者的年龄、绝经情况、合并症、家族史等一般资料;收集DM 的病程及主要临床表现,如皮疹、肌肉疼痛、眶周紫红斑、Gottron 征、吞咽困难等。
2.DM 相关资料:血清学检查包括血清肌酸激酶(creatine kinase,CK)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、抗核抗体(antinuclear antibody,ANA)、抗TIF1-γ 抗体水平。采用酶联免疫吸附试验及重组蛋白法测定检测患者血清中抗TIF1-γ 抗体 (MESACUP 抗TIF1-γ 抗体来自日本MBL 公司,Nagoya),MBL 法测定值<50 U/L 为阴性,重组蛋白法测定值<90 U/L 为阴性。影像学检查为肌肉磁共振成像(magnetic resonance imaging,MRI);病理检查为皮肤肌肉穿刺。
3.肿瘤相关资料:收集肿瘤病程、临床表现(如异常阴道流血、盆腔肿物等)资料。血清学检查包括癌抗原12-5(cancer antigen 12-5,CA12-5)、癌胚抗原 (carcinoembryonic antigen,CEA)、甲胎蛋白(αfetoprotein,AFP)等肿瘤标志物。影像学检查如妇科B 超和胸部、腹部、盆腔(胸腹盆)CT 或MRI 检查,此外收集肿瘤的病理资料。收集所有患者肿瘤治疗方案以及肿瘤治疗前、肿瘤治疗过程中以及治疗后的DM 用药方案,收集随访资料(随访期为2 个月~2 年)。
结 果
一、一般资料
本研究纳入11 例DM 合并妇科恶性肿瘤患者,年龄在46~78 岁,平均年龄为(57±10)岁,其中5 例为卵巢癌、2 例宫颈癌、3 例子宫内膜癌(见表1)。
二、临床表现及治疗方案
1.DM 与妇科肿瘤确诊的次序关系:本组所有患者在DM 确诊之后,接受了影像学和肿瘤指标的筛查,从而确诊了恶性肿瘤,间隔时间为1 周到2 年不等。10 例患者为初诊后经过盆腹腔CT、肿瘤标志物、人乳头瘤病毒(human papilloma virus,HPV)及液基薄层细胞学检查等,逐步确诊妇科恶性肿瘤。本组4 号患者在DM 确诊后,每3~6 个月进行一次妇科检查和肿瘤指标检测,在第21 个月时出现CA12-5 持续升高,从而发现卵巢癌。11 号患者确诊DM 后3 个月时因阴道流血就诊妇科,从而确诊子宫内膜癌,但追溯病史,患者出现不规则阴道流血已经持续3 年,因此子宫内膜癌的发生可能先于DM 的发生(见表2)。
2.DM 对肿瘤治疗方式的影响:11 例患者的皮疹和肌炎的严重程度各不相同,使用药物的方法和途径不同,因此肿瘤治疗的方法需考虑DM 的情况。表3 例举了DM 患者临床症状及妇科肿瘤的治疗方式,其中1 例患者因DM 改变了手术方式及手术时机,第9 号为子宫内膜癌患者,原则上首选手术治疗,但因其合并环咽肌受累,考虑患者随时有呼吸衰竭可能,麻醉及手术风险较高,故先行DM治疗,同时予新辅助化疗控制肿瘤,待环咽肌受累症状改善后,再行手术治疗。本研究资料提示DM合并妇科恶性肿瘤的治疗仍以妇科恶性肿瘤原则为主。

表1 妇科恶性肿瘤合并DM 的一般情况

表2 DM 与妇科恶性肿瘤确诊的次序关系
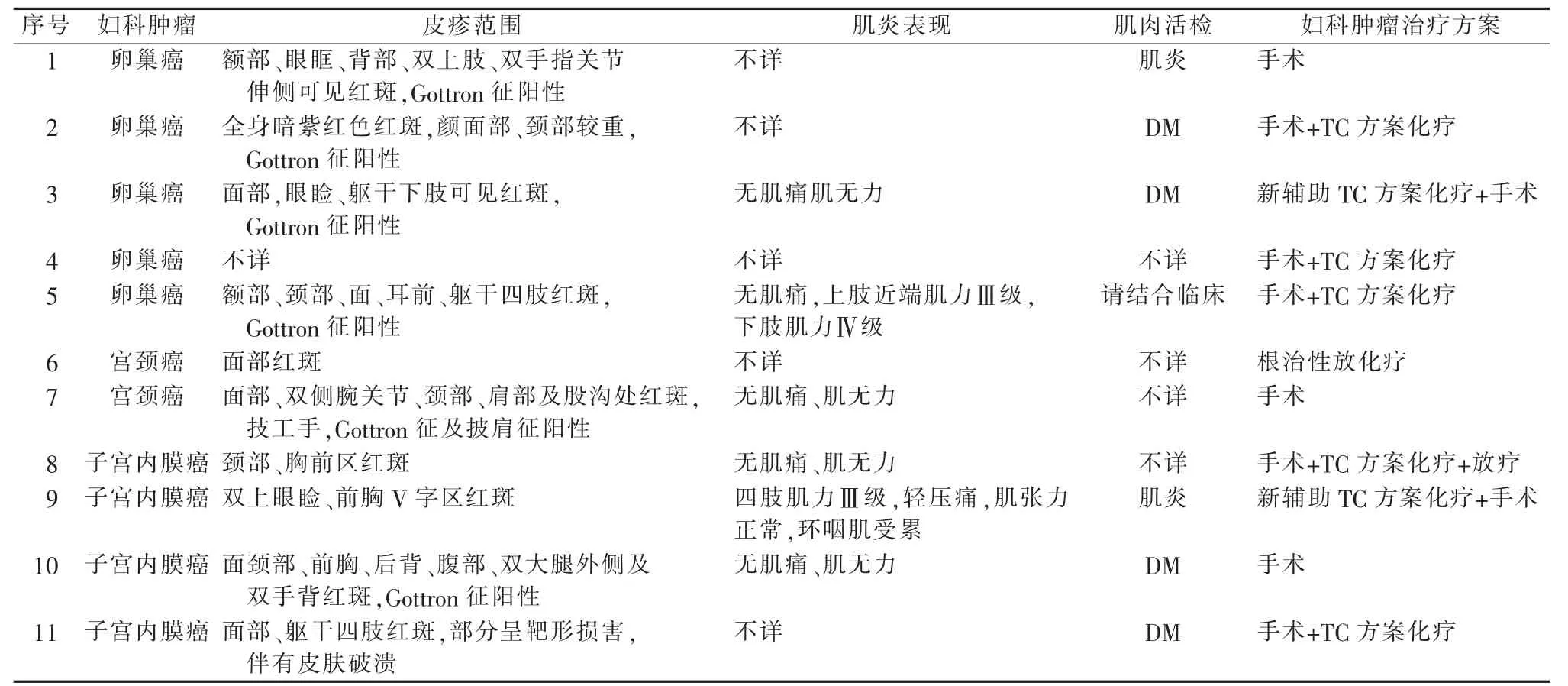
表3 DM 对妇科恶性肿瘤治疗方式的影响
3.血清肿瘤标志物及抗TIF1-γ 抗体水平:11 例患者均有不同程度的肿瘤指标变化,其中7 例患者CA12-5 升高,2 例患者宫颈癌患者鳞状细胞癌抗原 (squamous cell carcinoma antigen,SCCA)升高。3 例患者未行抗TIF1-γ 抗体的检测,剩余8 例中6 例患者的抗TIF1-γ 抗体呈阳性状态(见表4)。
三、病理学检查及分期
卵巢癌患者5 例,病理类型均为高级别浆液性腺癌,ⅢC 期4 例,ⅡA 期1 例。子宫内膜癌4 例,其中子宫内膜癌肉瘤ⅢA 期1 例,子宫内膜样腺癌ⅢC2 期1 例,子宫内膜样腺癌Ⅱ期合并透明细胞癌1 例,子宫内膜浆液性癌ⅢC2 期1 例;宫颈癌2 例,其中宫颈鳞癌ⅣA 期1 例,宫颈鳞癌ⅠB2 期1 例(见表5)。

表4 肿瘤标志物及血清抗TIF1-γ 抗体的水平

表5 术前、围手术期DM 的治疗方案
四、妇科肿瘤的治疗
按照妇科肿瘤治疗的原则,10 例患者接受了手术治疗,其中卵巢癌2 例为新辅助化疗后中间型减瘤术,其余均为初次减瘤术。4 号患者因初次探查无法行满意的减瘤术而先行4 次TC 方案[紫杉醇(taxol)联合卡铂(carboplatin)]化疗,再行中间减瘤术。而9 号为子宫内膜癌,因合并环咽肌受累,考虑患者随时有呼吸衰竭可能,麻醉及手术风险较高,故先行DM 治疗,同时行新辅助化疗控制肿瘤,待环咽肌受累症状改善后,再行手术治疗。依据手术病理分期及治疗推荐,9 例卵巢癌或子宫内膜癌的患者术后均需辅助化疗,但1 例卵巢癌和1 例子宫内膜癌患者因个人原因拒绝化疗,其余7 例均行TC 方案化疗6 个疗程,其中1 例子宫内膜癌患者在接受化疗的同时行盆腔外照射放疗。1 例宫颈癌ⅣA 期患者接受了宫颈癌根治性同步放疗和化疗。1 例宫颈癌ⅠB2 期患者无需放疗、化疗。
10 例行手术的患者,术后均无发热、出血等并发症。切口愈合方面,1 例(5 号)患者腹部伤口裂开,术后行二次手术清创缝合后好转;1 例(9 号)患者术后阴道残端裂开,予以碘伏纱条阴道填塞及抗炎治疗后,残端愈合良好。
五、围术期DM 治疗
手术患者术前、术中、术后3 日均采用了静脉用激素替代口服激素,同时加用了术前得宝松1 支。术后DM 方面,11 例患者均用糖皮质激素治疗,其中5 例在术后继续使用免疫抑制剂。采用紫杉醇化疗过程中,地塞米松预处理的剂量均根据患者原有甲强龙治疗剂量减量(见表5)。
六、随访及术后治疗
11 例患者中,3 例患者失访(1、10、11 号),剩余8 例患者随访时间为术后2 个月~2 年不等。截至2020 年12 月,8 例患者均存活,其中6 例患者皮肤症状好转,皮疹范围或皮疹程度均较前有不同程度好转,患者的强的松用量逐渐减量中。2 号患者术后1 年余DM 复发,主要表现为皮疹再发,转皮肤科治疗,增加了激素用量后好转,期间行影像学检查及肿瘤标志物检查未发现肿瘤复发。9 号患者化疗结束约2 个月左右,DM 再次复发,主要表现为四肢肌无力,但环咽肌无力未见明显加重,激素用量增加后,仍有四肢无力感,同时复查肿瘤指标及妇科影像学检查,目前未见妇科肿瘤复发。
讨 论
一、DM 合并恶性肿瘤机制研究的最新进展
DM 发生恶性肿瘤的潜在机制之一是两者存在共有的抗原表达。在血清中有抗Hu 抗体表达的小细胞肺癌合并DM 患者中,肌肉组织与肿瘤组织中表达同样的Hu 抗原[6],并且肿瘤组织中有明显的T细胞浸润,由此推断,DM 合并恶性肿瘤的发病机制为T 细胞介导的免疫反应[7]。同时,在DM 患者的肌肉和多种肿瘤组织(例如肺和乳腺肿瘤)中可观察到Mi2 抗原的过表达。DM 患者的肿瘤组织与再生肌肉组织之间这种共有的抗原表达,即人体对恶性肿瘤的自身免疫反应可能对肌细胞发生免疫交叉反应,从而导致肌细胞自身免疫[8-9]。
一项针对DM 合并恶性肿瘤患者的研究中发现,抗TIF1-γ 抗体检测阳性患者TIF1 基因的遗传修饰发生频率比阴性者更高[4]。这些遗传变化包括TIF1 基因的突变和杂合性的缺失。肿瘤组织中由于TIF1 基因改变出现的新抗原,可攻击肌肉组织中产生TIF1 抗原的细胞。此外,合并恶性肿瘤的DM 患者其肌肉和肿瘤组织中的TIF1-γ 表达水平比未合并恶性肿瘤DM 患者高。这提示DM 的炎症表现是由于抗肿瘤及肌肉的交叉反应抗体导致的[10-11]。
二、DM 与妇科肿瘤发病的次序关系
根据赵辨[12]报道,恶性肿瘤已成为DM 患者死亡的主要病因之一。恶性肿瘤合并DM 患者的年龄一般>40 岁,并且随着DM 患者年龄增大,其伴发恶性肿瘤的风险也增大。根据流行病学调结果,我国上皮性卵巢癌多发生于50 岁以上的女性,子宫内膜癌往往发生于55 岁以后的女性,宫颈癌的发病往往集中在45~55 岁女性。研究发现,年龄>45岁是预测DM 发生恶性肿瘤的危险因素之一,女性DM 患者伴发恶性肿瘤的风险是男性DM 患者的3 倍[13]。本研究中,所有患者均大于45 岁,与国内外相关报道相符。
在我国,恶性肿瘤合并DM 患者中有74.0%~81.8%的恶性肿瘤出现在确诊DM 后,大部分患者首先就诊于皮肤科[14]。本研究11 例患者中有9 例是在皮肤科治疗DM 过程中发现妇科恶性肿瘤而转诊至妇科。患者确诊DM 后2 年内的恶性肿瘤发生率最高,之后逐渐下降[15]。本研究中所有DM 患者均在2 年内发现恶性肿瘤,多为常规影像学筛查发现盆腔肿物,其次为绝经后阴道流血症状及肿瘤标志物升高,主要是CA12-5。因此,超过45 岁的女性DM 患者应高度警惕妇科恶性肿瘤的发生。Hill 等[15]建议超过40 岁的DM 女性患者应高度警惕卵巢癌,每6 个月需检查血CA12-5、盆腔超声。因DM 可作为恶性肿瘤的一个预测指标,据此笔者建议,女性患者确诊DM 时就应行全身筛查,如CT检查,甚至PET-CT、妇科B 超、HPV、液基薄层细胞学检查等,如结果为阴性,则每3~6 个月需检查肿瘤标志物、妇科B 超,每6~12 个月复查全身CT。在此过程中,存在治疗效果较差或病情进行性加重的DM 患者,则可缩短随访全身CT 检查的时间。如DM 确诊2 年后仍未发现明显的恶性肿瘤依据,可适当延长随访时间。
由于妇科恶性肿瘤是DM 患者的主要合并症之一,也是患者死亡的重要原因,因此肿瘤的早期诊断和治疗对患者的预后改善至关重要,而抗TIF1-γ 抗体的出现早于肿瘤的血清标志物如CA12-5、人附睾蛋白4(human epididymis protein 4)HE4 等以及影像学检查,抗TIF1-γ 抗体检测阳性有助于癌症的早期筛查。本研究患者中除3 例未行抗TIF1-γ 抗体检测外,余8 例中6 例患者的抗TIF1-γ 抗体呈阳性。近期夏群力等[16]的研究显示,抗TIF1-γ 抗体与DM 合并恶性肿瘤显著相关,TIF1-γ 可能是DM 合并恶性肿瘤的血清学标志物。因此,检测血清中抗TIF1-γ 抗体可为DM 合并恶性肿瘤的诊断提供重要的临床信息。我院皮肤科DM 课题组曾对3 例DM 合并卵巢癌的患者进行了随访,在接受了手术、化疗等治疗后,患者的血清抗TIF1-γ 抗体水平显著下降,甚至转阴,但血清抗TIF1-γ 抗体在肿瘤治疗随访中是否有监测价值还需要进一步研究。血清抗TIF1-γ 抗体阳性的患者,在DM 确诊时即使没有找到确诊恶性肿瘤的影像学或病理学证据,仍应加强随访筛查。
三、DM 对肿瘤治疗方式的影响
在DM 合并妇科恶性肿瘤患者的恶性肿瘤治疗方面,应完全按照妇科恶性肿瘤治疗原则,如有手术指征,则应尽早手术切除肿瘤[17];如无手术指征,则先行放疗、化疗,根据恶性肿瘤的术后病理及分期,制定下一步辅助治疗方案。
DM 合并妇科恶性肿瘤治疗的基本目标是识别和治疗肿瘤,改善肌肉和皮肤症状,因此在DM 合并妇科恶性肿瘤患者治疗中,与单纯恶性肿瘤治疗最大的不同,是此类患者需进行多学科会诊,以评估手术及麻醉风险。如患者DM 累及腹部皮肤,需评估DM 的病变程度,如手术野有皮肤破溃、皮疹或感染,则需暂缓手术,先对皮肤病变处进行治疗,待好转后再考虑手术。如患者DM 累及呼吸肌、环咽肌等重要功能性肌肉,则将影响麻醉复苏,其发生术后拔管困难、术中呼吸抑制、呼吸衰竭的可能性也更大。如本研究中第9 号合并环咽肌受累的患者,考虑其随时有呼吸衰竭的可能,麻醉及手术风险较高,故先行DM 治疗,同时行新辅助化疗控制肿瘤,待环咽肌受累症状改善后,再行手术治疗。
四、围手术期以及肿瘤的放疗、化疗期间DM的治疗方案
在DM 治疗中,最主要的药物是糖皮质激素和免疫抑制剂,但在伴发恶性肿瘤的DM 中,应用糖皮质激素和免疫抑制剂治疗效果往往不佳[18]。但也有研究证明[2],多数情况下DM 伴发恶性肿瘤者的DM 临床症状更为严重,除了常规使用糖皮质激素,使用免疫抑制剂是必要的。因此本研究在妇科恶性肿瘤治疗中,先联合皮肤科及风湿免疫科医师,考虑加用免疫抑制剂治疗。
因DM 患者大多接受口服糖皮质激素治疗,手术及化疗方案也受到一定的影响。本研究患者治疗方案由医师根据会诊结果,于手术前1 天、手术当天及术后3 d 将口服强的松改为同等剂量的甲强龙(甲泼尼龙琥珀酸钠)静脉用药,术后3 d 后根据正常饮食的恢复将激素改为原有用药剂量口服,围手术期免疫抑制剂等可按原剂量口服。术后化疗过程中,因患者口服糖皮质激素,故使用紫杉醇前,地塞米松用量应适当减少,如TC 方案化疗过程中,紫杉醇使用前,应用20 mg 地塞米松静脉滴注,根据地塞米松0.75 mg 相当于强的松0.5 mg 换算,如患者每日口服15 mg 及以上剂量的强的松,则可不加用地塞米松;如口服强的松剂量小于15 mg,则补充相差剂量的地塞米松。
五、肿瘤治疗的疗效与DM 预后之间的关系
DM 合并妇科恶性肿瘤患者预后均较差,以肿瘤广泛转移、继发感染和恶性肿瘤所致的全身衰竭为主要死亡原因。DM 伴发恶性肿瘤患者的总体生存率比DM 伴发其他合并症患者更低,预后和生存期由潜在的恶性肿瘤所决定[17]。笔者发现,DM 病情变化与恶性肿瘤的治疗疗效间关系密切,肿瘤的有效治疗可改善DM 的临床进程,而肿瘤恶化时,DM症状也随之加重。本研究中,患者在恶性肿瘤治疗过程中,随着手术、放疗、化疗等治疗施行,DM 症状也明显好转。
目前,DM 合并妇科恶性肿瘤的发病机制尚不明确,同时相关研究较少。因DM 合并的妇科恶性肿瘤种类、分型较多,目前尚无明确的研究结果以指导治疗,只能暂时分别按照DM 及恶性肿瘤各自的治疗方案治疗,缺乏针对性治疗。