脂肪因子Vaspin在非酒精性脂肪性肝病中的表达及其临床意义*
2021-04-14陈香梅张亮齐立明孙磊王鹏
陈香梅,张亮,齐立明,孙磊,王鹏
(首都医科大学附属北京地坛医院 病理科,北京100015)
我国肝脏疾病中非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)患病率仅次于病毒性肝炎,已成为第一大慢性疾病及肝功异常的首要原因,且患病年龄逐渐年轻化,严重威胁人们的身体健康[1]。在NAFLD 发生机制中,脂肪组织特别是内脏脂肪组织有着重要作用[2]。NAFLD 患者血清内脏脂肪组织来源的Vaspin 水平明显升高,是机体针对胰岛素抵抗的一种代偿机制,也可以抑制促炎脂肪因子抗胰岛素蛋白、瘦素和肿瘤坏死因 子-α (tumor necrosis factor-α, TNF-α) 的 表达[3-4]。目前,Vaspin 是缓解肥胖、降低胰岛素抵抗的新靶点,其研究多集中在肥胖人群、2 型糖尿病人群血清学和高脂饮食诱导的动物模型[5-7]。鉴于脂肪因子主要通过胰岛素抵抗、肝脂肪变性、肝炎症及肝纤维化4 个方面来参与NAFLD 的病程进展[8],本研究初步探索Vaspin 在NAFLD 不同病理分级肝脏中的表达及其临床意义。
1 资料与方法
1.1 一般资料
回顾分析2016年10月—2019年10月首都医科大学附属北京地坛医院收治的78例NAFLD 患者临床病理资料。其中,男性41 例,年龄(38±13)岁;女性37 例,年龄(48±12)岁。患者均进行超声引导下肝脏组织细针穿刺手术,并对肝脏标本进行病理分析。其中,脂肪肝患者52例(脂肪肝组),非脂肪肝患者26例(非脂肪肝组)。
1.2 主要仪器及试剂
多功能自动染色机ST5050(德国Leica 公司)。Gomori 网状纤维染色试剂盒(上海国药集团化学试剂有限公司),免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),山羊血清一抗Vaspin(英国Abcam公司,ab238745),转化生长因子-β(transforming growth factor-β, TGF-β)(英国Abcam 公司,ab66043),二抗(北京中杉金桥生物技术有限公司,PV-6000D)。
1.3 方法
1.2.1 HE 染色将NAFLD 患者的肝脏组织蜡块连续切片6 张,每张切片厚4 μm。取其中一张切片采用多功能自动染色机进行HE 染色。操作步骤:烤片约30 min,二甲苯脱蜡,100% 乙醇、100%乙醇、95%乙醇、95%乙醇、85%乙醇、75%乙醇各5 min,水洗,苏木精5 min,水洗,1%盐酸酒精分化数秒,水洗,1%氨水返蓝,水洗,伊红3 min,梯度酒精(低浓度至高浓度)脱水,二甲苯透明,中性树胶封片。
1.2.2 网织Gomori 银染色常规脱蜡至水,0.5%高锰酸钾水溶液氧化5 min,水洗,1%草酸漂白至无色(1~2 min),水洗,2%铁明矾溶液媒染5 min,蒸馏水冲洗,浸银氨液40~60 s,蒸馏水冲洗,10%甲醛还原10 s,蒸馏水冲洗,5%硫代硫酸钠溶液固定2 min,水洗,脱水、透明、封片。网状纤维呈黑色,胶原纤维呈棕色。
1.2.3 免疫组织化学染色常规脱蜡至水,3%H2O2室温孵育10min,pH 6.0 柠檬酸盐抗原修复缓冲液热高压修复抗原2 min,山羊血清封闭室温孵育10 min,一抗Vaspin(1∶400 稀释)和TGF-β(1∶200稀释)4℃孵育过夜,二抗30 min,DAB 显色,苏木精复染,脱水、透明、封片。
1.2.4 结果判读①肝脏炎症程度:依据炎症程度分为3 级(G 0~3):G0 为无炎症;G1 为腺泡3 带呈少数气球样肝细胞,腺泡内散在个别点灶状坏死;G2为腺泡3带明显气球样肝细胞,腺泡内点灶状坏死增多,汇管区轻、中度炎症;G3为腺泡3带广泛的明显气球样肝细胞,腺泡内点灶状坏死明显,汇管区轻、中度炎症伴/或汇管区周围炎症。②肝脏纤维化程度:依据纤维化范围和形态分为4级(S 0~4):S0为无纤维化;S1 为腺泡3 带局灶性或广泛的窦周/细胞周纤维化;S2 为纤维化扩展到汇管区,局灶性或广泛的汇管区星芒状纤维化;S3 为纤维化扩展到汇管区周围,局灶性或广泛的桥接纤维化;S4 为肝硬化。③免疫组织化学结果判读:随机采集10 个高倍视野,染色显示胞浆棕黄色颗粒即为抗原阳性物,无着色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3分;无阳性细胞为0分;阳性细胞数≤10%为1分,>10%~50%为2分,>50%~75%为3分,>75%为4分;两项计分相乘,结果0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用方差分析或秩和检验,两两比较用LSD-t检验或χ2检验;计数资料以构成比或率(%)表示,比较用χ2检验;等级资料以等级表示,比较用秩和检验;相关性分析用Spearman法,影响因素的分析用多因素逐步Logistic 回归模型,P<0.05 为差异有统计学意义。
2 结果
2.1 各组患者的临床病理特征
依据肝细胞脂肪变性占据小叶面积的范围分为5级:F0 ≤5%,F1 >5%~30%,F2 >30%~50%,F3 >50%~75%,F4 >75%。肝脏HE染色和Gomori银染色见图1。

图1 各组肝脏组织病理切片 (HE染色×100)
各级NAFLD 患者性别比较,经χ2检验,差异无统计学意义(P>0.05)。各级NAFLD 患者年龄、身高、体重、体重指数(BMI)、血清总胆固醇(TCHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰基转移酶(GGT)、总胆红素(TBIL)、直接胆红素(DBIL)、空腹血浆葡萄糖(FPG)、糖化血红蛋白(HbA1c)比较,经方差分析,差异均无统计学意义(P>0.05),见表1。
各级NAFLD 患者炎症程度和纤维化程度比较,经秩和检验,差异无统计学意义(P>0.05)。各级NAFLD 患者Vaspin 和TGF-β 表达水平比较,差异有统计学意义(P<0.05),NAFLD 分级越高,Vaspin和TGF-β 表达水平越低。见表2。
2.2 各组患者肝脏组织Vaspin和TGF-β的表达
Vaspin 在正常肝脏组织肝细胞浆中会有少量表达,随着NAFLD 肝脏脂肪变性的增加(F 1~3),其表达也会升高;F4患者的脂滴在肝组织中越来越多,占肝细胞胞浆的体积越来越大,Vaspin 表达似有降低。TGF-β 主要表达在肝细胞胆管面的胞膜上,随着肝脏脂肪变性的增加,其表达降低。见表2和图2。
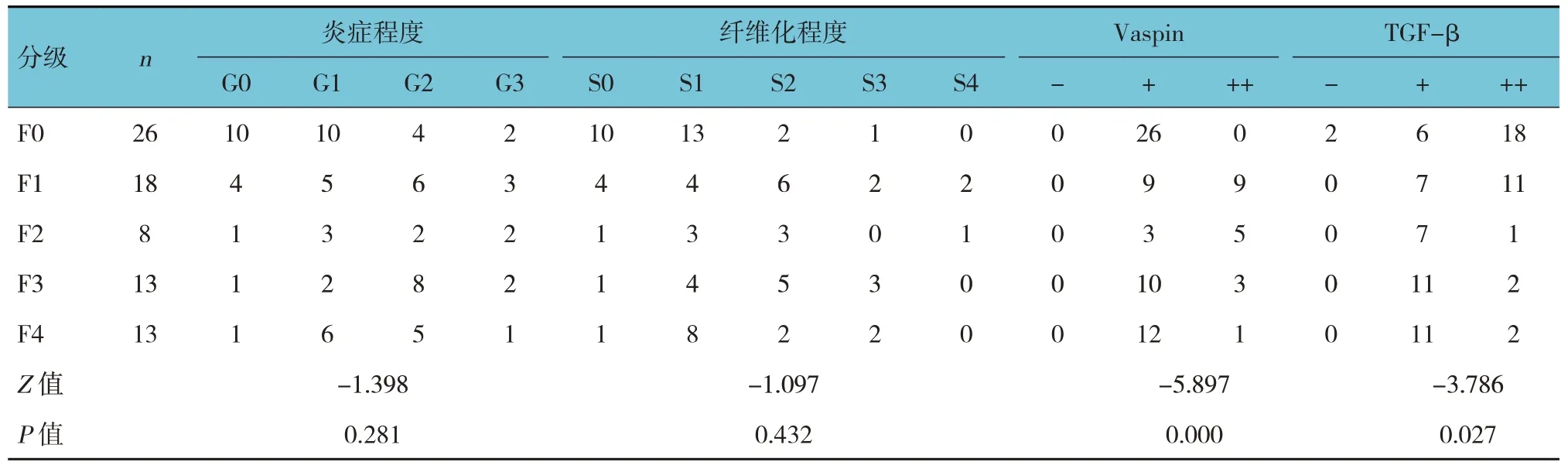
表2 各组患者肝脏组织炎症、纤维化程度及Vaspin、TGF-β表达水平比较 例
2.3 肝脏组织Vaspin 和TGF-β 表达分级与其他各项指标的相关性
Vaspin表达分级与炎症程度、纤维化程度、TCHO、HDL-C、ALT、AST、ALP、GGT、TBIL、DBIL、HbA1c无相关性(P>0.05)。Vaspin表达分级与TG呈负相关(P<0.05),与LDL-C、FPG呈正相关(P<0.05)。Vaspin阳性表达水平越高,TG越低,LDL-C和FPG越高。见表3。
TGF-β表达分级与炎症程度、纤维化程度、TG、TCHO、HDL-C、LDL-C、AST、ALP、GGT、TBIL、DBIL、FPG、HbA1c 无相关性(P>0.05)。TGF-β 表达分级与ALP呈负相关(P<0.05),TGF-β表达水平越高,ALP越低。见表3。
2.4 NAFLD的危险因素分析
脂肪肝组与非脂肪肝组患者的Vaspin 和TGF-β表达分级,以及ALT、AST、ALP、GGT、TBIL、DBIL、FPG、HbA1c 比较,差异有统计学意义(P<0.05),脂肪肝组高于非脂肪肝组。两组TCHO、TG比较,差异无统计学意义(P>0.05)。见表4。
以是否患脂肪肝为因变量,将单因素分析中差异有统计学意义的指标(Vaspin表达分级、TGF-β表达分级、ALT、AST、ALP、GGT、TBIL、DBIL、FPG、HbA1c)为自变量,进行多因素逐步Logistic回归,α入=0.05,α出=0.10。结果显示,Vaspin表达分级[=2.987(95%CI:1.065,8.379)]、ALT[=1.062(95%CI:1.014,1.112)]、TBIL [=1.502 (95% CI:1.147,1.967)]、FPG[=13.111(95%CI:1.430,120.195)]是发生NAFLD的独立危险因素。见表5。

图2 各组患者肝脏组织Vaspin和TGF-β的表达 (免疫组织化学染色×200)
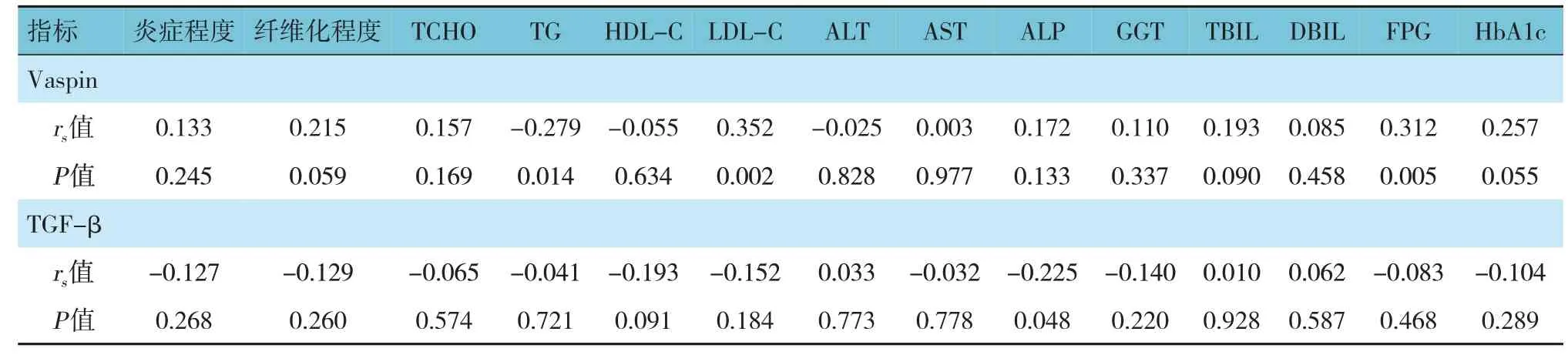
表3 Vaspin、TGF-β表达分级与其他指标的相关性

表4 脂肪肝组与非脂肪肝组患者的临床资料比较
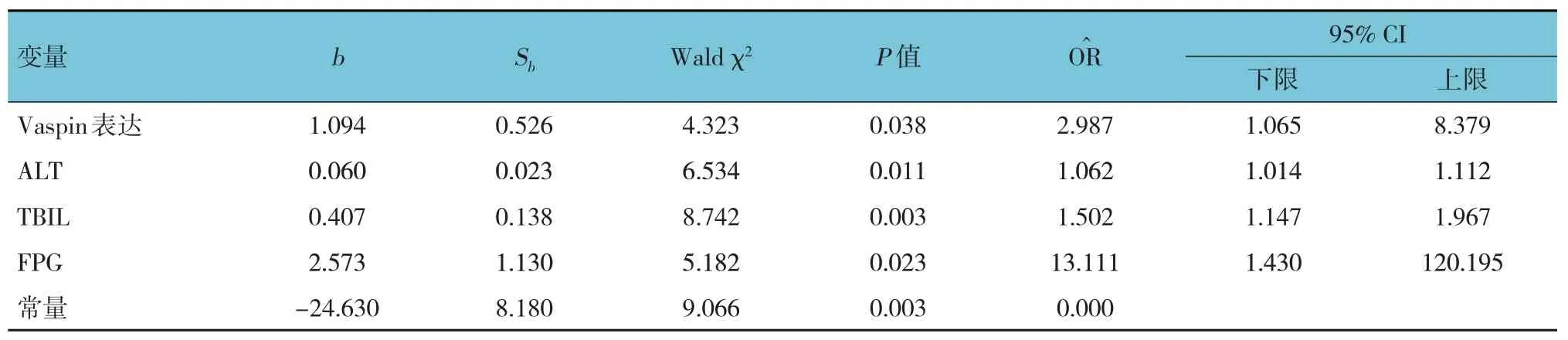
表5 NAFLD危险因素的多因素Logistic回归分析参数
3 讨论
在NAFLD 发生机制中,脂肪组织特别是内脏脂肪组织发挥着重要的作用。肥胖者身体脂肪分布位置的不同与NAFLD 发生有关,脂肪分布于腹腔内脏比分布于腹壁具有更大的NAFLD 发病风险[2]。脂肪组织是一个代谢活跃的内分泌器官,可通过自分泌/旁分泌分泌多种脂肪因子,包括激素、细胞因子、补体、生长因子、细胞外基质蛋白等,参与调节饮食、能量平衡及糖脂代谢等[9]。脂肪因子分两类:一类是脂肪细胞分泌的激素类,如脂连蛋白等;另一类是脂肪组织中的免疫细胞和内皮细胞分泌的炎症免疫相关的细胞因子,如TNF-α、白细胞介素-6(Interleukin-6, IL-6)等[10]。脂肪因子不仅影响脂肪细胞的功能,而且可通过循环系统运送至其他器官及组织来影响代谢。脂连蛋白在NAFLD 进展过程中发挥代偿作用,可以降低胰岛素抵抗,减少脂肪变性,有抗炎作用[11];而TNF-α、IL-6 增加胰岛素抵抗,有促炎作用,可使NAFLD 病程恶化[12-13]。尤其高表达TNF-α 联合低表达脂连蛋白可致胰岛素抵抗和NAFLD[14]。有研究证实,脂肪组织扩张可引起脂肪因子改变,进而导致肝单纯脂肪变性、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)及NASH 相关肝硬化。脂肪因子作用的失衡是发生NAFLD或NASH,甚至肝纤维化的重要因素[15]。
目前,脂肪因子瘦素、脂连蛋白、抗胰岛素蛋白、内脂素、Chemerin 等已在NAFLD 人群、脂肪肝动物模型和2 型糖尿病动物模型中被广泛研究[16-17],其在NAFLD 的发病机制基本清晰,但仍有很多脂肪因子与NAFLD 发病的关系不清楚。脂肪因子对NAFLD 的作用机制研究大多是在人群血清学水平,而人群肝脏组织的脂肪因子表达研究相对较少。肝脏中脂肪因子直接作用于肝脏,参与NAFLD 进程,很多情况下与血液中脂肪因子的作用不一致,即脂肪因子的肝脏效应常常不能通过其在血液中的表达水平来反映[8]。
Vaspin 是内脏脂肪组织来源的丝氨酸蛋白酶抑制剂,是一种从2 型糖尿病大鼠的内脏脂肪组织中发现并分离的脂肪因子[18]。OLETF 大鼠肥胖达到顶峰并出现胰岛素抵抗时,内脏脂肪和血浆Vaspin 水平都明显升高,随着糖尿病病程恶化并伴随体重减轻,内脏脂肪和血浆Vaspin 水平均明显下降,因此Vaspin 是胰岛素敏感型脂肪因子[19]。Vaspin 广泛表达于脂肪、肝脏、胃、下丘脑等组织。内脏脂肪组织来源的Vaspin 可以抑制促炎脂肪因子的表达,如抗胰岛素蛋白、瘦素和TNF-α。人体血清Vaspin 水平升高与BMI、胰岛素抵抗相关,低水平血清Vaspin 是2 型糖尿病进展的危险因素[20]。在高脂喂养小鼠模型中,血浆和肝脏Vaspin 表达水平升高,这可能是机体对高脂饮食诱导的糖脂代谢负荷的代偿性调节,外源性Vaspin 蛋白输注能够抑制高脂模型肝脏脂肪合成关键酶(脂肪酸合成酶、乙酰辅酶A 羧化酶)的mRNA 表达,促进脂肪分解限制酶(激素敏感性脂肪酶、肉毒碱棕榈酰转移酶)的mRNA 表达[21]。本研究结果也显示,Vaspin 在NAFLD患者肝脏组织中表达升高,并与血清LDL-C、FPG 呈正相关,同时也是NAFLD 的独立危险因素。Vaspin 在正常肝脏组织肝细胞胞浆中有少量表达,随着NAFLD 的进展,Vaspin 表达进一步升高,并与肝脏组织纤维化呈正相关。在本研究中由于样本量较小,差异无统计学意义。有研究表明,肥胖人群血液中的Vaspin 与TG、LDL-C 密切相关[11],这与本研究中肝脏组织高表达的Vaspin 与血清LDL-C 呈正相关一致。肥胖与NAFLD 均为代谢综合征的表现,因而血液与肝脏中的Vaspin 水平可能具有一致性。
