铜绿假单胞菌磷脂酶C的重组表达、复性及酶学性质
2021-04-14顾正华李由然丁重阳石贵阳
许 杰,张 梁,顾正华,李由然,丁重阳,石贵阳
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
磷脂酶C(PLC,EC 3.1.4.3),是一种水解甘油磷脂C3位点磷酯酰键生成甘油二酯和磷酸胆碱、磷酸肌醇等的脂类水解酶[1]。PLC按来源可分为微生物来源、动物来源及植物来源[2]。其中,微生物来源的PLC具有生产周期短、结构简单、可工业化大规模培养等优点[3]。但是,大多数微生物法产PLC的来源菌株都具有病原性,在食品安全性方面存在一定的隐患[4]。
PLC目前主要用于植物油的酶法脱胶[5-7]。PLC水解产物甘油二酯是一种生理活性物质,能激活蛋白激酶C (PKC) 而引起细胞增殖、分化、收缩、分泌和代谢等功能变化[8-9],同时,其对抗血小板新型药物、抗静脉血栓及高血压医疗方面的研究有重大意义[10-13]。另外,PLC也可用于食品工业,可提高面团的乳化性能、气泡的稳定性以及增大面包体积[14]。
微生物法是获得PLC的主要方法,但是,PLC在大肠杆菌的表达过程中容易形成包涵体。包涵体是外源基因在宿主细胞尤其是原核细胞(如大肠杆菌)中高效表达时,形成的一种由膜包裹的或无膜裸露的高密度、不溶性的蛋白质颗粒[15]。包涵体主要由目的蛋白组成,可改变大肠杆菌的光散射性质,在光学显微镜下观察可见,多为圆形、卵圆形或不定形等[16]。包涵体稀释复性是将复性缓冲液加入到具有高浓度变性剂的变性溶液中[17],如6 mol/L盐酸胍、8 mol/L尿素等。稀释复性包括直接稀释法、分段稀释法和连续稀释法[18]。Schlegl等[19]通过稀释复性,得到了具有生物活性的α-乳清蛋白。目前,采用稀释复性法已成功使多种包涵体蛋白在体外进行再折叠。
本研究中,笔者以铜绿假单胞菌来源的磷脂酶C[20]的基因在大肠杆菌中进行重组表达,对重组PAplc包涵体蛋白进行复性,并分析其酶学性质,为磷脂酶C的后续研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
铜绿假单胞菌(P.aeruginosa)为笔者所在实验室保藏的产磷脂酶C菌株,E.coliJM109、BL21(DE3)菌株及载体pET-28a(+)为粮食发酵工艺与技术国家工程实验室保藏。
1.1.2 试剂与培养基
限制性内切酶EcoRⅠ、HindⅢ、T4 DNA连接酶、2×Taq Mix、2×Pfu Mix、氨苄青霉素、卡那霉素等,生工生物工程(上海)有限公司;PCR产物纯化试剂盒、质粒小量提取试剂盒和胶回收试剂盒等,杭州宝赛生物科技有限公司;p-NPPC,中国上海阿拉丁公司;50%卵黄液,上海江莱生物科技有限公司。
LB液体培养基:蛋白胨10.0 g/L,酵母粉5.0 g/L,NaCl 10.0 g/L;pH 7.0。固体培养基另加20 g/L的琼脂粉。
硼砂卵黄固体培养基:硼砂 1.9 g/L,NaCl 6.6 g/L,硼酸10.9 g/L,琼脂粉20 g/L;pH 7.2~7.4,灭菌完成后加入质量分数为5%的卵黄溶液。
1.1.3 仪器
Spark多功能酶标仪,帝肯(上海)贸易有限公司;超声波细胞破碎仪,Sonic & Materials Inc(USA);HH-2型数显恒温水浴锅,江苏荣华仪器制造有限公司;生化培养箱,上海一恒科技有限公司;凝胶成像系统,Alpha Innotech公司;琼脂糖凝胶电泳槽,北京六一仪器厂。
1.2 方法
1.2.1 基因组DNA的提取
基因组提取参照文献[21]相关方法进行。
1.2.2PAplc基因的克隆
根据NCBI上报道的磷脂酶C(NC_002516.2)基因为模板设计引物PAplc-F/PAplc-R,序列分别为PAplc-F:G ̄A ̄G ̄A ̄A ̄T ̄T ̄C ̄A ̄T ̄G ̄A ̄C ̄C ̄G ̄A ̄A ̄A ̄A ̄C ̄T ̄G ̄G ̄A ̄A ̄A ̄T ̄T ̄C ̄C;PAplc-R:C ̄C ̄A ̄A ̄G ̄C ̄T ̄T ̄T ̄C ̄A ̄G ̄G ̄T ̄C ̄G ̄C ̄T ̄G ̄C ̄G ̄A ̄T ̄G ̄T ̄C。
以P.aeruginosa染色体为模板,PAplc-F/PAplc-R为引物进行PCR扩增,PCR产物经试剂盒纯化后连接 pMD19-T-Simple Vector 载体,转入大肠杆菌 JM109 感受态细胞后培养1 h,最后涂布至氨苄抗性的LB固体培养基中。提取的质粒用EcoRⅠ、HindⅢ进行双酶切验证并将验证正确的质粒送到生工生物工程(上海)有限公司进行测序。
1.2.3 重组大肠杆菌表达质粒pET28a-PAplc的构建
将测序正确的pMD19-PAplc质粒用EcoRⅠ、HindⅢ进行双酶切后,经胶回收获得纯化的PAplc基因片段,再与同样经过EcoRⅠ、HindⅢ双酶切并纯化好的pET-28a(+)质粒连接过夜。次日,转化E.coliBL21(DE3) 感受态细胞。在37 ℃、200 r/min条件下培养1 h后涂布至卡那霉素抗性的LB固体培养基,37 ℃ 恒温培养10 h。挑取转化子用PAplc-F/PAplc-R引物进行菌落 PCR,挑取菌落PCR正确的转化子提取质粒,然后用EcoRⅠ、HindⅢ双酶切验证。将验证正确的质粒送到生工生物工程(上海)有限公司进行测序。
1.3 重组大肠杆菌的诱导表达与SDS-PAGE分析
将重组菌株分别命名为pET28a-PAplc/DE3和pET28a/DE3。挑取单菌落于20 mL LB液体培养基中,在37 ℃、200 r/min条件下培养12 h。次日以体积分数4%的接种量转接至50 mL终质量浓度为60 μg/mL卡那霉素抗性的LB液体培养基中,在37 ℃、200 r/min条件下培养2 h后,加入IPTG至终浓度为0.5 mmol/L,在25 ℃、150 r/min条件下诱导培养6 h。诱导结束后以12 000 r/min的离心条件离心5 min收集菌体,用浓度为25 mmol/L Tris-HCl(pH 7.2)缓冲液洗涤菌体,以超声破碎的方式破碎菌体,12 000 r/min离心30 min收集上清与沉淀,在20 μL样品中加入5×蛋白上样缓冲液(SDS Loading buffer),煮沸20 min,12 000 r/min离心20 min,上样量为20 μL,采用7.5%分离胶、5%浓缩胶进行SDS-PAGE来鉴定蛋白表达情况。
1.4 重组PAplc包涵体蛋白复性
包涵体蛋白复性方法多种多样,透析、超滤和稀释复性法是应用最广泛的。其中稀释法操作简单,包涵体复性成功率较高。重组PAplc包涵体复性条件:蛋白质量浓度0.05 mg/mL,4 ℃静置48 h,复性缓冲液包含50 g/L甘油,1 mmol/L还原型谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG),50 mmol/L NaCl,50 mmol/L三羟甲基氨基甲烷-盐酸(Tris-HCl),pH 7.4。
1.5 磷脂酶C酶活力测定
目前,磷脂酶C酶活力的测定常用的有2种方法[21]。
①硼砂卵黄平板牛津杯法。取200 μL样品置于等距放置在硼砂卵黄平板上的牛津杯中,35 ℃反应48 h,以产生的乳白色晕圈的直径大小表示酶活的高低。
②p-NPPC定量法。p-NPPC是卵磷脂的一种底物结构类似物,磷脂酶C可以分解其生成黄色的对硝基苯酚,在410 nm处的吸光值可反映磷脂酶C水解p-NPPC产生对硝基苯酚的量。根据对硝基苯酚的标准曲线,定量计算出相应酶活力的大小。酶活力测定反应体系为0.25 mol/L Tris-HCl (pH 7.2)、60 g山梨醇(以100 mL水计)、10 mmol/Lp-NPPC,在1 mL反应体系中加入200 μL酶液于37 ℃反应30 min后,立刻用酶标仪测410 nm波长处的吸光度。
酶活单位的定义:在pH 7.2、温度37 ℃的条件下,每分钟水解p-NPPC产生1 nmol的对硝基苯酚所需的酶量为1个酶活力单位(U)。
2 结果与讨论
2.1 磷脂酶C基因在大肠杆菌(DE3)中重组表达
2.1.1PAplc基因的克隆与分析
PAplc基因的扩增片段如图1所示。由图1可知,在2 200 bp处有单一扩增片段,与目的片段大小(2 193 bp)一致。将验证正确的克隆子送到生工生物工程(上海)股份有限公司进行测序,测序结果显示扩增序列与NC_002516.2的磷脂酶C基因序列比对相似度99.13%,氨基酸序列比对相似度99.18%。

M—标准DNA;1—PAplc图1 PAplc基因的PCR电泳结果Fig.1 PCR product of PAplc
2.1.2 重组质粒pET28a-PAplc的构建
提取测序正确的阳性克隆菌的质粒,经EcoR Ⅰ、HindⅢ双酶切验证,结果见图2。由图2可知,提取的质粒载体经双酶切后得到大小为2 193和5 369 bp的2个片段,与预期片段相符,说明表达载体pET28a-PAplc构建成功。
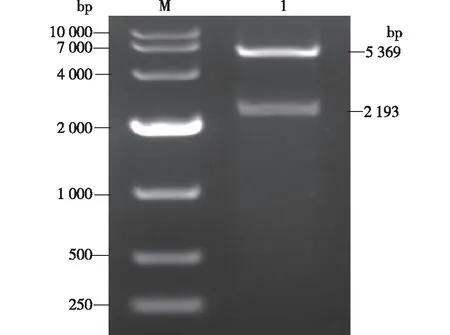
M—标准蛋白;1—重组质粒pET28a-PAplc双酶切验证图2 重组载体pET28a-PAplc酶切验证Fig.2 The enzymatic digestion of pET28a-PAplc
2.1.3 重组菌pET28a-PAplc/DE3诱导表达与鉴定
取200 μL经超声破碎后的上清置于等距放置在硼砂卵黄平板上的牛津杯中,35 ℃下反应48 h后观察有无乳晕圈,结果如图3所示。由图3可知,破碎上清液中含有较少的重组蛋白,此不利于后期纯化以及各项分析研究,且重组菌破碎后的上清在硼砂卵黄平板上并没有产生明显乳晕圈,经超滤浓缩后,以p-NPPC法测得酶活较低。
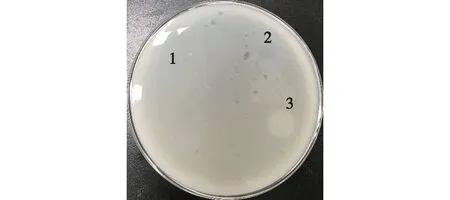
1—pET28a/DE3破碎上清液;2—pET28a-PAplc/DE3破碎上清液;3—pET28a-PAplc/DE3包涵体复性图3 重组PAplc活性检测Fig.3 Verification of recombinant PAplc activity
同时,进行 SDS-PAGE 电泳分析与鉴定,结果如图4所示。由图4可知:重组菌经超声破碎后,PAplc蛋白(约8.5×104)主要以包涵体形式出现在破碎沉淀中。
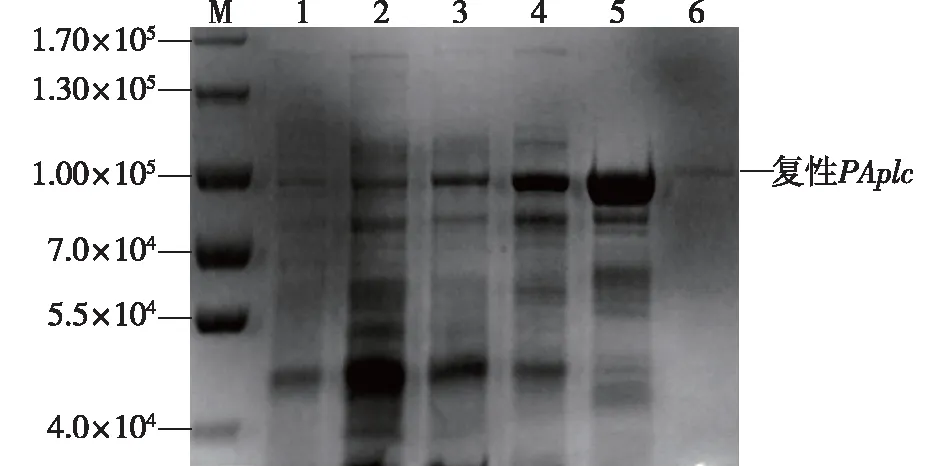
M—标准蛋白;1—pET28a/DE3细胞破碎上清液;2—pET28a-PAplc/DE3细胞破碎上清液;3,4,5—pET28a-PAplc/DE3细胞破碎沉淀;6—PAplc包涵体复性图4 重组磷脂酶C的SDS-PAGE电泳Fig.4 SDS-PAGE analysis of recombination PLC
2.2 重组PAplc蛋白包涵体复性
重组PAplc虽然以包涵体形式表达,但是包涵体本身独特的优越性不可忽视:①PAplc包涵体本身具有坚固致密的结构,可有效抵抗蛋白酶的降解,为后期获得大量的活性蛋白提供一定的支持。②PAplc包涵体可以很容易通过离心分离;包涵体杂蛋白含量较低,一定程度上利于后期纯化。③PAplc包涵体的形成减轻了大肠杆菌的代谢负担,有利于PAplc更加高效地表达。
任龙等[3]将BacilluscereusShenzhen754-1 来源的磷脂酰肌醇特异性磷脂酶C基因克隆进pGEX-KG质粒中,并在大肠杆菌BL21(DE3)中诱导表达出以包涵体形式存在的约3.8×104大小的重组磷脂酶C蛋白,而且经过复性后没有测到磷脂酶C的活性。
重组菌经破碎后含有大量的包涵体,SDS-PAGE鉴定重组PAplc蛋白主要以包涵体形式出现在破碎沉淀中,采取直接稀释复性的方式,对重组蛋白进行复性。
对磷脂酶C的复性条件进行优化后,磷脂酶C包涵体蛋白经过洗涤缓冲液洗涤除去杂蛋白等杂质后溶于8 mol/L的尿素(20 mmol/L Tris-HCl调pH 8.0)中。复性结束后,SDS-PAGE电泳分析结果见图4。由图4可发现,实验与预期结果一致,包涵体蛋白以单一条带出现。测得蛋白回收率为27.5%,纯度大于98%。在硼砂卵黄平板上检测酶活,出现明显白色乳晕圈(图3),结果与预期目标一致。以p-NPPC法测得重组PAplc比酶活为63.79 U/mg,重组PAplc包涵体蛋白复性成功。
2.3 重组磷脂酶C的酶学性质分析
2.3.1 最适反应温度的测定
温度对酶催化反应有决定性的作用。温度过低则酶催化反应速率降低,温度过高则酶有可能变性失活。为研究不同温度(20~90 ℃)下磷脂酶C的酶催化反应,将纯酶在上述温度的水浴中反应30 min,测定酶活力,以测得的最高比酶活(73.93 U/mg)为100%计算相对酶活,结果见图5。
由图5可见:酶反应最适温度为60 ℃,在20~50 ℃时,磷脂酶C酶活随着温度的上升逐渐提高;在60 ℃时达到最高;当温度超过75 ℃后酶活力显著降低。

图5 温度对重组磷脂酶C酶活力的影响Fig.5 Effect of temperature on the activity of recombinant phospholipase C enzyme
2.3.2 最适反应pH测定
pH是影响磷脂酶C酶活的一个重要因素,以0.25 mol/L pH为4.0~6.0 的柠檬酸-柠檬酸钠缓冲液、pH为6.5~7.0的K2HPO4- KH2PO4缓冲液及pH 7.5~9.0的Tris-HCl缓冲液配制底物反应液,在37 ℃下测定酶活力,并以pH 7.2 时测得的比酶活(47.9 U/mg)为 100%计算相对酶活,结果见图6。
由图6可知:酶反应最适pH为7.5,此时酶活力最高;当pH为 4.0~6.0时,酶活剩余不到10%;pH 大于7.5,酶活力逐渐下降。由此可见,该重组酶适合为pH 7.0~9.0。
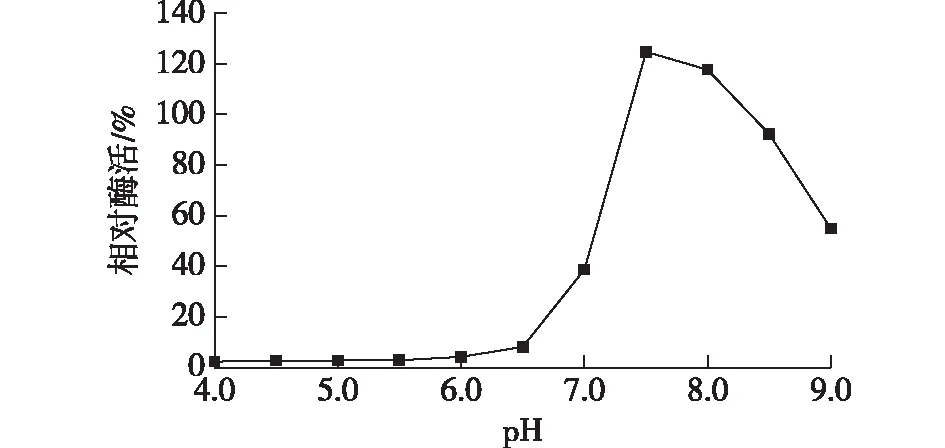
图6 pH对重组磷脂酶C酶活力的影响Fig.6 Effect of pH on the activity of recombinant phospholipase C enzyme
2.3.3 热稳定性分析
以未经水浴处理的酶的比酶活 (47.9 U/mg)为100%计算相对酶活,设置不同温度(20~90 ℃)水浴锅,将纯酶在上述温度的水浴中处理30 min后,在37 ℃下反应30 min并测定酶活力,结果见图7。
由图7可知:重组PAplc在20~60 ℃水浴30 min后酶活保持在60%以上;温度高于65 ℃,酶活力逐渐降至20%以下。由此可推测该酶随着处理温度的升高而逐渐丧失活性,由此可知,重组PAplc的热稳定性比较差。

图7 酶的热稳定性Fig.7 Thermal stability of the enzyme
2.3.4 pH耐受性分析
将浓缩的纯酶分别置于上述相应pH的缓冲液中,在4 ℃冰箱放置12 h后,37 ℃下反应30 min测剩余酶活力,以pH 7.2处理下的酶活力(47.9 U/mg)为100%,计算相对酶活,结果见图8。
由图8可知:当pH为7.5~8.5时,重组PAplc剩余酶活力在80%以上;当pH低于6.5时,酶活力逐渐降至10%以下。由此可知,该酶适合保存在偏碱性的环境中。
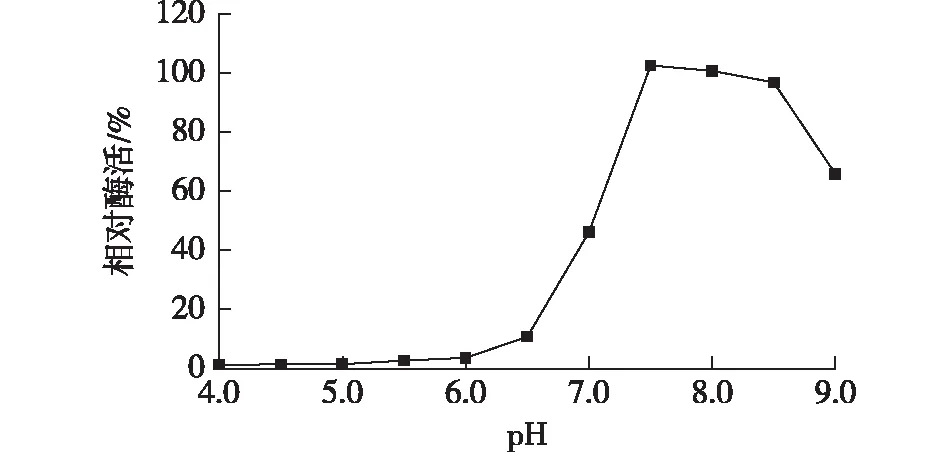
图8 酶的pH稳定性Fig.8 pH stability of the enzyme
2.3.5 金属离子对重组磷脂酶C酶活的影响
分别添加Mg2+、Zn2+、Ca2+、Cu2+、Mn2+和Co2+这6种二价金属离子至终浓度分别0.5、1.0和2.0 mmol/L并于37 ℃下测定酶活力,结果见图9。
由图9可知:Zn2+、Cu2+和 Co2+对重组磷脂酶C有明显的抑制作用;随着金属离子浓度的增加,抑制作用越明显;低浓度下的Mg2+、Ca2+及Mn2+对磷脂酶C有一定的促进作用。
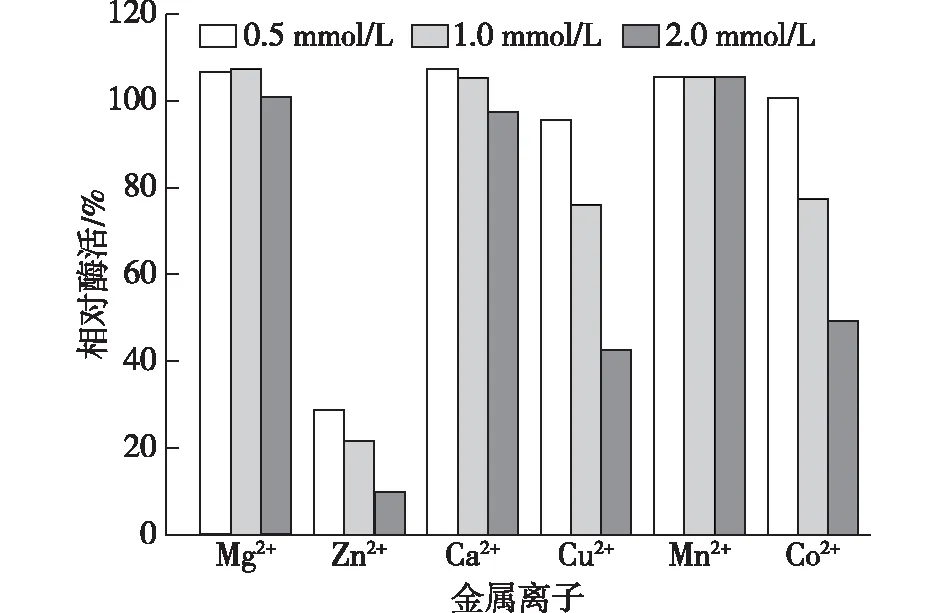
图9 金属离子对重组磷脂酶C酶活的影响Fig.9 Effects of metal ions on PLC enzymes activity
3 结论
通过分子生物学手段构建了pET28a-PAplc重组质粒,铜绿假单胞菌来源的磷脂酶C基因在大肠杆菌中主要以包涵体的形式表达,并初步对包涵体进行了复性以及酶学性质的分析。通过优化复性条件,重组PAplc包涵体蛋白成功得到了复性,蛋白回收率为27.5%,纯度在98%以上;p-NPPC法测得比酶活为63.79 U/mg,最适反应温度为60 ℃,最适pH 7.5,温度低于50 ℃、pH在7.0~9.0时重组PAplc比较稳定。Zn2+、Cu2+和 Co2+对重组PAplc酶活有明显的抑制作用;Mg2+、Ca2+和Mn2+对其酶活有一定的促进作用。后续将进行以分析研究重组磷脂酶C性质和结构为主、同时兼顾磷脂酶C包涵体的复性方法的探索。
