6′-O-月桂酰京尼平苷的酶法合成及其抗炎活性评价
2021-04-14杨文猛陆怡欣朱本伟
杨文猛,倪 芳,姚 忠,陆怡欣,孙 芸,朱本伟,苑 蘅,熊 强
(南京工业大学 食品与轻工学院,江苏 南京 211800)
京尼平苷(geniposide)是一种天然的环烯醚萜苷类化合物,广泛分布于植物的果实、茎和叶等组织中。如,茜草科的栀子GardeniajasminoidesEllis[1]、水栀子GardeniajasminoidesEllis var.radicans(Thunb.) Makino[2]、大花栀子Gardeniajasminoidesform.grandiflora(Lour.) Makino[3]及朱如拉GardeniajasminodesEllis[4],杜仲科的杜仲EucommiaulmoidesOliv.,卫矛科陕西卫矛EuonymusschensianusMaxim.[5],列当科肉苁蓉CistanchedeserticolaY.C.Ma[6],苋科牛膝AchyranthesbidentataBl.[7],鳞毛蕨科香鳞毛蕨Dryopterisfragrans(L.) Schott[8]和防己科云南青牛胆Tinosporasagittatavar.yunnanensis(S.Y.Hu)Lo[9]等。
京尼平苷是由1分子葡萄糖和1分子京尼平苷元组成(图1),其中的京尼平苷元含有活泼的羟基侧链和环氧结构,具有护肝[10]、抗抑郁[11]、抗氧化[12]、降糖[10]和抗炎[3]等多种生理功能,是传统中药的重要成分之一。
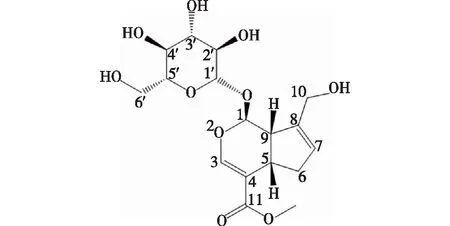
图1 京尼平苷的化学结构Fig.1 Chemical structure of geniposide
环烯醚萜苷类化合物家族成员众多,其中大多数具有重要的生理活性。这些环烯醚萜苷类化合物的分子结构中含有多个羟基,是酰基化反应的理想底物,对其进行酰基化修饰不仅有利于丰富化合物的结构多样性,调整母体化合物的亲油/亲水平衡(HLB),并可改善其生物活性、稳定性和生物利用度[13-14]。
目前,常用于催化天然产物酰化反应的酶有水解酶和酰基转移酶2种。其中,脂肪酶(lipase)催化的酰化反应具有底物谱宽、对映选择性和区域选择性强、耐有机溶剂以及不需要辅因子等优点,因而广泛应用于催化多种天然产物,如黄酮类和皂苷等多酚类化合物的酰基化修饰[15-18]。Xanthakis等[19]以月桂酸乙烯酯为酰基供体,脂肪酶Novozyme 435为催化剂对紫苏醇苷进行了酰化修饰,获得了葡萄糖苷C6位上的酰化产物,转化率高达84%,克服了紫杉醇的脂溶性差的问题并提高了其生物利用率。Singh等[13]以脂肪酶CAL-B作为催化剂,四氢呋喃作为溶剂,比较了不同的酰基供体对黄连糖苷的酰基化效果,结果发现,乙酰基或丁酰基衍生物的产率较高,其中胡黄连糖苷Ⅱ型糖基上的伯羟基被酰基化形成单酰基衍生物;而黄连糖苷Ⅰ型中的酰基化发生在苷元上的仲羟基上,这可能是由于在黄连糖苷Ⅰ型中,糖基上的伯羟基空间位阻较大。
京尼平苷来源丰富,且具有重要的生理和药理功能,但其脂溶性和生物利用度较差。为此本文中,笔者尝试以月桂酸乙烯酯为酰基供体,对京尼平苷进行酰基化修饰,考察不同脂肪酶的催化效果,优化6′-O-月桂酰基京尼平苷(6′-O-LGS)的酶法合成方法;在此基础上,对反应产物进行纯化和结构确证,并对6′-O-LGS的抗炎活性进行评价。
1 材料与方法
1.1 材料与试剂
京尼平苷(98%),上海士锋生物科技有限公司;月桂酸乙烯酯(99%),上海梯希爱(上海)化成工业发展有限公司;四氢呋喃(THF,分析纯),上海国药集团化学试剂有限公司;固定化南极假丝酵母脂肪酶A(CaLA)、固定化南极假丝酵母脂肪酶B(CaLB)、固定化疏棉状嗜热丝孢菌脂肪酶(TLIM)和固定化米黑根毛霉脂肪酶(RMIM),丹麦诺维信公司;乙腈(色谱纯),美国默克公司。
1.2 仪器与设备
LCQ DECA XP PLUS型电喷雾质谱仪,美国赛默飞世尔公司;AVANCE AV-500型核磁共振仪,瑞士布鲁克公司。
1.3 6′-O-LGS的制备和结构确证
将京尼平苷与月桂酸乙烯酯以摩尔比1∶ 4溶于预先经4A分子筛脱水的THF中,加入TLIM作为催化剂,于40 ℃摇床中反应60 h。滤纸滤去反应液中TLIM及其他不溶杂质后,用氮吹仪吹干THF,加入乙腈复溶。以反相高效液相色谱(RP-HPLC)制备色谱(GP-C18,21.2 mm×150 mm)对产物进行纯化,并利用质谱(MS)、1H NMR、13C NMR、H-H cosy、多键碳氢关系(HMBC)及异核单量子关系(HSQC)等方法分析以确定其结构。
1.4 HPLC分析
以HPLC对6′-O-LGS进行定量分析。色谱柱为Sepax Amethyst C18-H柱(4.6 mm×250 mm,5 μm);流动相为V(乙腈)∶V(水)=80∶ 20;流速为1.0 mL/min;检测波长为230 nm;进样量为20 μL。在此条件下,6′-O-LGS的保留时间为5.993 min。6′-O-LGS的标准曲线线性方程为y=4.273x+1.337 3,R2=0.999 96。
1.5 6′-O-LGS的酶法合成
1)酶的选择。在25 mL圆底烧瓶中加入40 mg底物京尼平苷,115 μL酰基供体月桂酸乙烯酯以及10 mL预干燥过的溶剂THF,并分别加入一定量的固定化 CaLA、固定化CaLB(Novozym 435)、TLIM和RMIM,酶活均为1 000 U左右,于40 ℃下搅拌反应48 h,转速200 r/min,每组反应设置3个平行样。反应完毕后以HPLC检测反应液中6′-O-LGS含量,并计算反应转化率。
2)酰基受体/供体比与反应时间的确定。在25 mL圆底烧瓶中分别加入40 mg底物京尼平苷、10 mL预干燥过的THF以及100 mg TLIM,加入不同量的月桂酸乙烯酯,使受体/供体摩尔比分别为1∶ 1、1∶ 2、1∶ 4、1∶ 6、1∶ 8和1∶ 10。将圆底烧瓶在40 ℃下搅拌反应(转速200 r/min),在反应时间为0.5、1、2、3和5 h时分别取样,通过HPLC检测反应液中6′-O-LGS含量,并计算反应转化率。
3)温度的选择。在25 mL圆底烧瓶中加入40 mg底物京尼平苷,230 μL酰基供体月桂酸乙烯酯,10 mL预干燥过的反应溶剂THF以及100 mg TLIM作为催化剂。在不同的温度条件下(30~50 ℃)搅拌反应2 h(转速200 r/min),反应结束后以HPLC检测反应液中6′-O-LGS含量,并计算反应转化率。
1.6 6′-O-LGS的体外抗炎免疫活性的测定
细胞株为巨嗜细胞RAW264.7,使用1 μg/mL脂多糖诱导炎症的产生,诱导时间为24 h,试验中使用的京尼平苷及6′-O-LGS浓度均为10 μmol/L。
1)溶液的配制。脂多糖(LPS)粉末溶于磷酸缓冲盐溶液(PBS)中,配制成1.5 mg/mL储备液待用。京尼平苷和6′-O-LGS均溶于二甲基亚砜(DMSO)中,储备液浓度均为2 000 μmol/L。
2)细胞培养。将RAW264.7细胞分成control组、LPS组、京尼平苷组和6′-O-LGS组。待细胞生长状态良好且长满整个平皿的70%时,LPS组用1.0 μg/mL LPS处理,京尼平苷组和6′-O-LGS组分别用10 μmol/L的京尼平苷和6′-O-LGS与LPS联合处理。24 h后收样。
3)炎症水平检测。采用蛋白质免疫印迹法(Western blotting)检测炎症因子IL-6、COX2、IL-1β、p-NF-kB和TNF-α的表达水平。
2 结果与讨论
2.1 6′-O-月桂酰基京尼平苷的结构确证
按既定方法对京尼平苷进行酰基化修饰,反应结束后以制备色谱分离反应产物,获得了一种新的化合物(化合物1),纯度达98.97%(图2)。
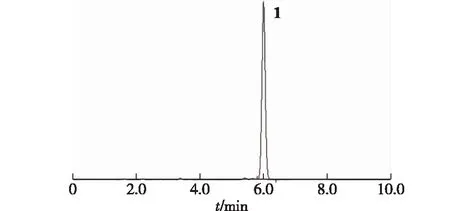
图2 化合物1的HPLC分析谱图Fig.2 HPLC analysis for compound 1
化合物1的质谱分析结果见图3。由图3可知:反应产物在正离子模式下的质荷比(m/z)为593.29,可能为京尼平苷的单月桂酰衍生物的加Na峰(570.3+23)。

图3 化合物1的正离子质谱图Fig.3 Positive ion mass spectrogram of compound 1
进一步对化合物1和京尼平苷进行1H NMR分析,结果见图4。由图4可知:化合物1低场氢的分布与京尼平苷类似,而高场区有新的氢出现,且数量与月桂酰基中的氢一致,表明化合物1确为京尼平苷的单月桂酰衍生物。
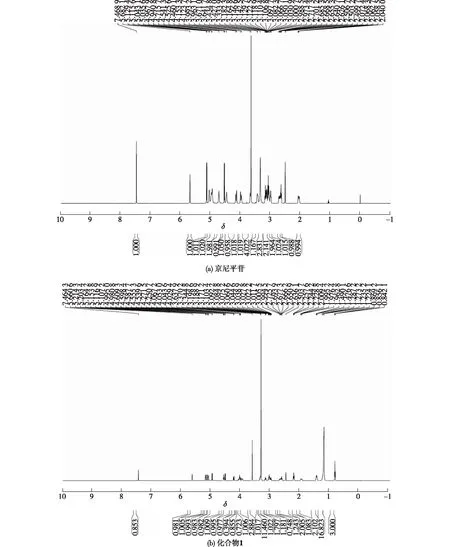
图4 京尼平苷和化合物1的1H NMR谱图Fig.4 1H NMR spectrum of geniposide and compound 1
化合物1的13CNMR、H-H cosy、HMBC及HSQC分析结果见图5~8。
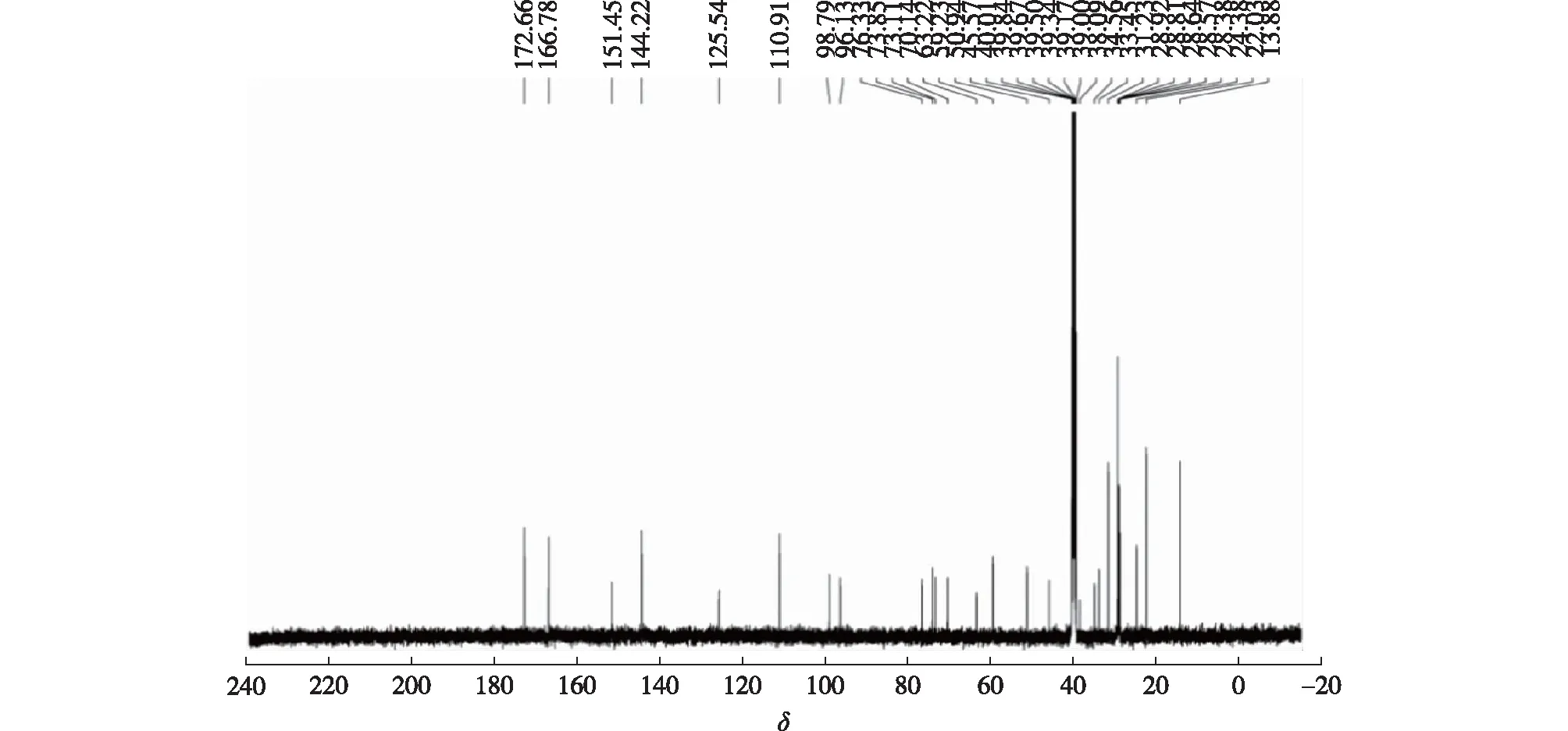
图5 京尼平苷单月桂酰衍生物的13C NMR谱图Fig.5 13C NMR spectrum of 6′-O-lauroylgeniposide

图6 6′-O-月桂酰基京尼平苷H-H cosy谱图Fig.6 H-H cosy spectrum of 6′-O-lauroylgeniposide
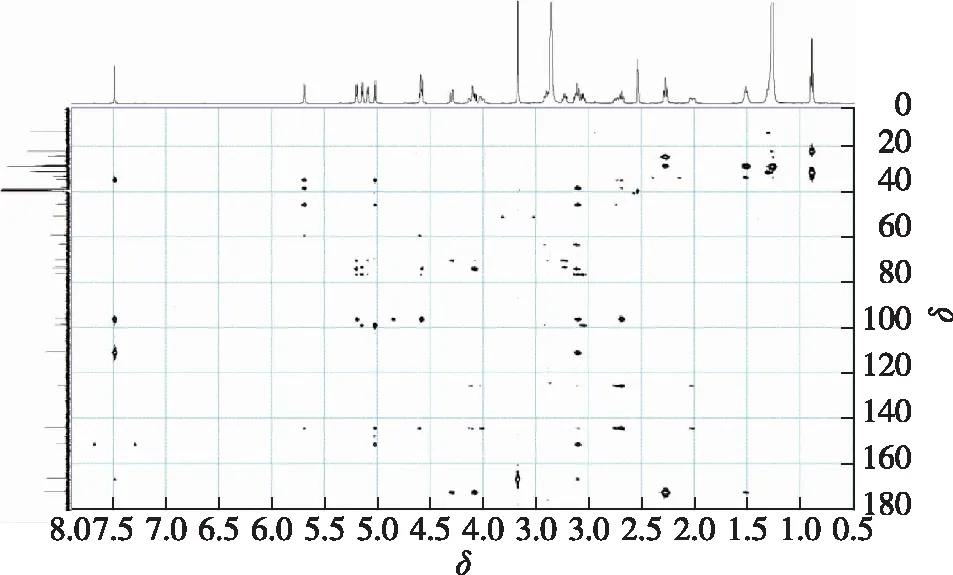
图7 6′-O-月桂酰基京尼平苷HMBC谱图Fig.7 HMBC spectrum of 6′-O-lauroylgeniposide
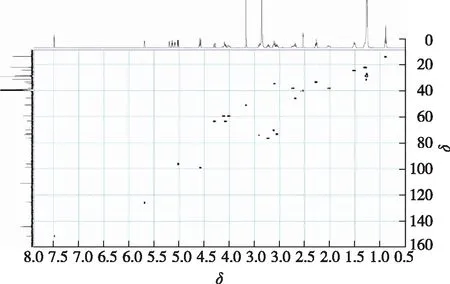
图8 6′-O-月桂酰基京尼平苷HSQC谱图Fig.8 HSQC spectrum of 6′-O-lauroylgeniposide
通过对化合物1核磁一级谱图(1H NMR、13C NMR)与二级谱图(H-H cosy、HMBC、HSQC)的解析,明确了月桂酰基连接位点为京尼平苷糖基上的6′位伯羟基,因此可确定化合物1的结构为6′-O-月桂酰基京尼平苷(6′-O-LGS),其1HNMR和13C NMR数据的全归属见图9。
6′-O-LGS核磁及质谱表征数据。
1H NMR (500 MHz,DMSO-d6) :δ5.66 (s,1H),5.24~5.09 (m,3H),4.99 (d,J=7.1 Hz,1H),4.63~4.52 (m,2H),4.26 (dd,J=11.9,2.1 Hz,1H),4.13~3.93 (m,3H),3.64 (s,3H),3.20 (td,J=8.9,4.8 Hz,1H),3.12~2.98 (m,3H),2.75~2.62 (m,2H),2.28~2.21 (m,2H),2.03~1.94 (m,1H),1.48 (t,J=7.2 Hz,2H),1.31~1.21 (m,18H),0.86 (t,J=6.7 Hz,3H)。
13C NMR (126 MHz,Acetone-d6) :δ125.58、76.36、73.88、73.14、50.97、45.60、40.04、39.96、39.87、 39.79、39.70、39.54、39.37、39.27、39.20、39.03、33.48、 31.27、28.95、28.60、28.41、24.41、22.06、13.91。
ESI-MS,C29H46O11[M+ Na+]+:理论值593.30,实测值为593.295 9。
综合以上分析,在TLIM的催化下,京尼平苷糖基上6′位上的伯羟基被酰基化,得到了京尼平苷衍生物6′-O-LGS,反应式如图10所示。

图9 6′-O-月桂酰基京尼平苷结构及核磁谱图归属Fig.9 The structure of 6′-O-lauroylgeniposide

图10 6′-O-月桂酰基京尼平苷的合成Fig.10 Synthesis of 6′-O-lauroylgeniposide
2.2 6′-O-LGS的合成方法优化
2.2.1 酶的选择
分别以CaLA、Novozym 435、TLIM、RMIM为催化剂,对京尼平苷进行酰基化修饰,比较4种脂肪酶的催化效果,结果见图11。由图11可知:使用TLIM时反应转化率最高,达到85.05%;Novozym 435催化效果低于TLIM,转化率为39.18%;而RMIM和CaLA基本没有催化京尼平苷酰基化生成6′-O-LGS的活性。
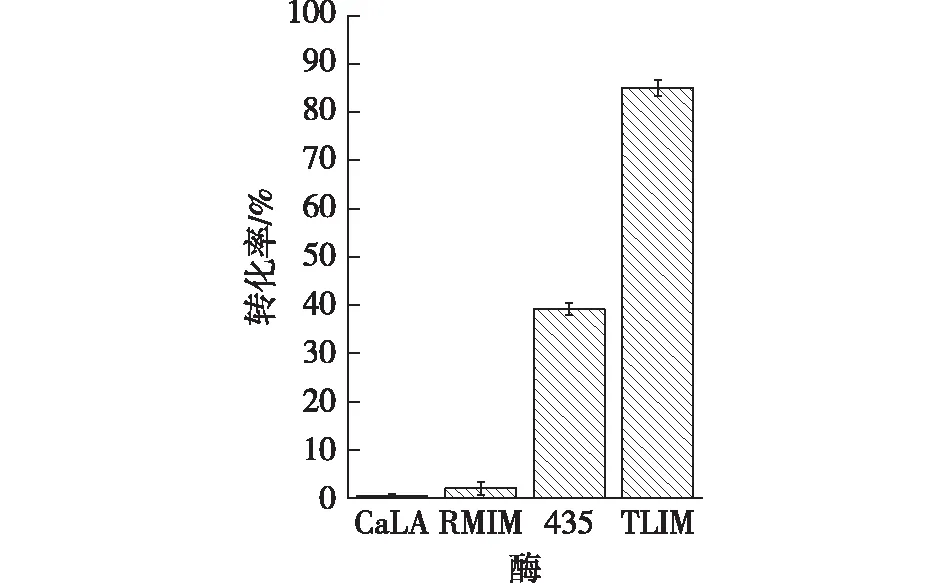
图11 不同脂肪酶对酶促酰化反应的影响Fig.11 Effects of different lipases on enzymatic acylation reaction
2.2.2 酰基受体/供体摩尔比对反应的影响
图12为酰基受体/供体比对合成效率的影响。由图12可知:随着京尼平苷/月桂酸乙烯酯摩尔比的上升,酰化反应速度和平衡转化率均迅速上升,平衡转化率从摩尔比1∶ 1时的22.98%上升到摩尔比1∶ 4时的92.36%。当摩尔比高于1∶ 4时,反应初速度仍有提高,反应到达平衡的时间不断缩短,而反应转化率上升并不显著(P>0.05)。当底物摩尔比高于1∶ 8时,酶促酰化反应能在2 h内迅速达到反应平衡状态(93.26%)。综合考虑试剂及时间成本的节约与后续分离纯化的要求,选择京尼平苷/月桂酸乙烯酯摩尔比为1∶ 8为最优投料比。

图12 不同投料比条件下转化率-时间曲线Fig.12 The conversion rate-time curve under different feed ratios
2.2.3 温度对反应的影响
在30~50 ℃范围内,考察不同温度条件下酶催化反应转化率,结果见图13。由图13可知:在30 ℃时反应初始速率略低于35~50 ℃时的反应初始速率,但是差别并不显著(P>0.05);温度区间内反应的2 h转化率基本一致,温度对反应转化率影响不大。综合考虑实验条件、反应速率、达到反应平衡时间及能源节约等因素,选择40 ℃作为反应温度。
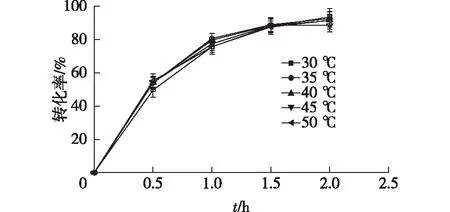
图13 不同反应温度对酶酰化反应的影响Fig.13 Effects of different reaction temperature on enzymatic acylation reaction
2.3 6′-O-LGS抗炎活性评价
分别对京尼平苷和6′-O-LGS的体外抗炎活性进行了评价。本研究采用的方法是用脂多糖(LPS)处理巨嗜细胞系RAW264.7细胞,刺激炎症的发生,建立炎症模型,然后加入京尼平苷及6′-O-LGS对炎症进行抑制,通过Western blotting 方法测定LPS组、Control组、京尼平苷组及6′-O-LGS组炎症因子(IL-6、COX2、IL-1β、p-NF-kB、TNF-α)的表达,从而验证京尼平苷及其衍生物的体外抗炎免疫活性并进行对比。实验内参为β-actin。
图14为栀子苷和6′-O-月桂酰栀子苷的抗炎免疫活性。由图14可知,炎性因子在各个实验组中表达的不同。脂多糖处理模型组(LPS组)和未经处理的空白对照组(Control组)相比,各个炎性因子的蛋白表达均增强。与模型组(LPS组)对比,京尼平苷组和6′-O-LGS组各个炎性因子的表达均减弱,其中6′-O-LGS组的抑制效果比京尼平苷组更为明显,其中对炎性因子肿瘤坏死因子α(TNF-α)的抑制作用差距最为明显,而对白介素-6(IL-6)的抑制效果则相差不大。总体来说,京尼平苷与6′-O-LGS均可以显著抑制炎症因子的表达,且相同浓度下6′-O-LGS的抑制效果更明显。

图14 栀子苷和6′-O-月桂酰栀子苷的抗炎免疫活性比较Fig.14 Comparation of anti-inflammatory immune activity of geniposide and 6′-O-lauroylgeniposide
京尼平苷的酰基化修饰虽然显著提高了物质的脂溶性,但是并未对苷元部分结构造成很大的影响,因此认为抗炎活性的差异可能源自于京尼平苷与6′-O-LGS脂溶性的差异。京尼平苷水溶性极强,这限制了其透过生物膜的能力,而进行过酰基化修饰的6′-O-LGS是脂溶性的,更容易被细胞膜选择性透过,其生物利用率也会更高,从而加强了其抗炎效果。
3 结论
以脂肪酶TLIM为催化剂,以月桂酸乙烯酯为酰基供体,对京尼平苷进行了酰基化修饰,确证了酰化产物的分子结构,并优化了酶促反应条件;在此基础上,对酰化产物6′-O-LGS的抗炎活性进行了评价,得到如下结论:
1)通过制备色谱纯化,获得了一种新的京尼平苷酰化产物,纯度达98.97%。
2)经质谱(MS)、1H NMR、13C NMR、H-H cosy、HMBC及HSQC分析,确证其结构为6′-O-月桂酰基京尼平苷(6′-O-LGS)。
3)在CaLA、Novozym 435、TLIM和RMIM这4种脂肪酶中,TLIM的催化效率最高,反应转化率达到85.05%,而RMIM和固定化的 CaLA则几乎没有催化活性。
4)TLIM催化合成6′-O-LGS的最优条件:溶剂四氢呋喃,京尼平苷/月桂酸乙烯酯投料摩尔比1∶ 8,反应温度40 ℃,反应时间2 h,反应转化率达93.26%。
5)在脂多糖诱导的RAW264.7细胞炎症模型中验证了6′-O-LGS的抗炎活性,结果显示6′-O-LGS对5种炎症因子(IL-6、COX2、IL-1β、p-NF-kB、TNF-α)均具有抑制作用,其中对TNF-α的抑制作用最为明显,活性优于相同浓度的京尼平苷。
