早期胃癌患者非治愈性内镜黏膜下剥离术后追加手术的危险因素分析
2021-04-14毛新宇冀春鹏汪宝林
毛新宇,卢 旭,冀春鹏,朱 华,汪宝林
(南京医科大学第二附属医院普通外科,江苏 南京,210011)
癌症是全球第二大死因,其中胃癌对人类健康造成重大威胁,尤其东亚地区[1]。在中国,每年约有68万胃癌新发病例[2]。早期诊断与治疗对胃癌的预后具有重要意义。随着内镜检查技术的普及,早期胃癌的检出率已大大提高[3]。早期胃癌是指局限于黏膜或黏膜下层的癌,不论有无淋巴结转移。随着内镜仪器与技术的进步,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗早期胃癌逐渐被广大学者采用。ESD能对肿瘤进行整块切除,并保留原本的生理结构,提高早期胃癌患者术后的生存治疗效果,但对于早期胃癌黏膜下浸润程度、淋巴结转移及脉管淋巴管侵犯等情况的判断仍存在一定局限性,同时有放大治疗指征的现象,常出现术后病理与术前评估有一定差异的情况。对于这些ESD非治愈性的病例,则需追加外科手术,从而达到根治的目的。本文旨在探讨ESD术后追加手术的相关危险因素,从而探索早期胃癌合适的治疗方式。
1 资料与方法
1.1 纳入及排除标准 纳入标准:病理证实为早期胃癌且CT等证实无远处器官的转移,既往无胃部手术史,未合并其他恶性肿瘤,术前未接受过化疗等抗肿瘤治疗。排除标准:术后病理不符合早期胃癌,严重心肺功能不全及其他重要器官功能障碍,凝血功能障碍,不能耐受全身麻醉,术后资料不全或失访。
1.2 临床资料 本研究纳入2017年1月至2019年9月南京医科大学第二附属医院接受ESD治疗的早期胃癌患者,并对其临床病理资料进行回顾性分析。最终纳入67例早期胃癌患者,平均(65.4±8.4)岁,其中男51例(76.1%),女16例(23.9%)。根据患者接受ESD治疗后是否追加手术分为ESD组(n=51)与ESD术后追加手术组(n=16)。两组患者除肿瘤浸润深度、分化程度外差异均无统计学意义(P>0.05)。见表1。

表1 两组患者临床资料的比较
1.3 手术方法
1.3.1 ESD组 采用全身静脉麻醉。内镜下用电凝刀于病灶周围0.5 cm标记病变范围,然后用肾上腺素与靛胭脂混合液多点注射病灶周围,使病灶隆起,用一次性黏膜切开刀于黏膜下逐层剥离,保持病灶完整,术中出血时采取电凝或钛夹止血,保证病灶完整切除。手术标本均送病理检查。根据第4版日本胃癌治疗指南[4],ESD的绝对适应证为不伴溃疡的直径2 cm内的分化型黏膜内癌(pT1a)。扩大适应证:(1)无溃疡的直径>2 cm的分化型黏膜内癌;(2)有溃疡形成,直径<3 cm的分化型黏膜内癌;(3)无溃疡,直径<2 cm的未分化型黏膜内癌;(4)直径<3 cm的浸润深度为pT1b~SM1(浸润黏膜肌层<500 μm)的分化型癌。内镜下非治愈性切除的判断标准:术后病理不符合治愈性切除的绝对及相对适应证的早期胃癌治疗。
1.3.2 追加手术组 ESD追加手术指征[5]:非治愈性切除,内镜下难以控制的出血及穿孔。根据ESD术后病理结果如切缘或基底切缘残留、肿瘤大小、分化程度等行追加手术。手术方式为腹腔镜下胃癌根治术或开腹胃癌根治术,行近端、远端或全胃切除,均按日本胃癌指南[4]进行D2淋巴结清扫。

2 结 果
2.1 ESD追加手术的危险因素 本研究纳入16例ESD术后追加手术的患者,其中2例出现ESD严重并发症而追加手术,1例为术中难以控制的出血,1例为进食困难,余均为非治愈性切除;2例术后复查胃镜发现存在癌变,3例胃癌组织紧靠标本切缘或基底,5例存在切缘阳性,7例侵犯黏膜下层,7例术后病理类型差,包括2例低分化腺癌、3例印戒细胞癌、2例黏液细胞癌,因此行追加手术,见表2。ESD术后追加手术的患者一般存在多种以上的危险因素,外科手术后发现7例存在病理癌残留。
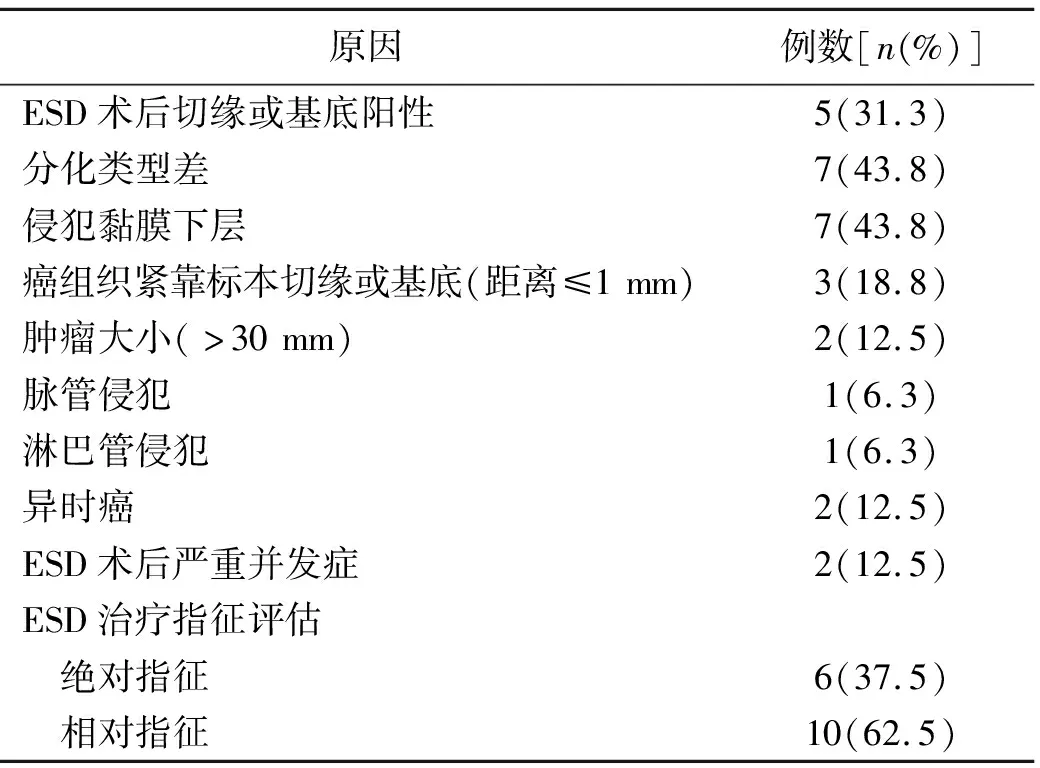
表2 16例患者ESD术后追加手术的原因
2.2 ESD术后追加手术切缘或基底彻底性的影响因素及eCura危险评分 根据eCura危险评分系统,5例出现垂直切缘阳性,1例出现肿瘤直径>30 mm,5例黏膜下层浸润>500 μm,1例存在脉管侵犯,1例存在淋巴管侵犯,其中14例为低危组(0~1分),1例为中危组(2~4分),1例为高危组(5~7分)。对ESD追加手术的术后病理进行分析,手术切缘或基底彻底性的影响因素见表3,追加手术的患者病理均未发现淋巴结转移。
2.3 ESD术后追加手术行开放及腹腔镜胃癌根治术的比较 ESD追加手术中,腹腔镜下胃癌根治术(n=9)与开放手术(n=7)在手术时间、出血量、清扫淋巴结数量、术后通气排便时间、术后住院时间及并发症发生率方面差异均无统计学意义,见表4。

表4 16例ESD术后追加手术开放及腹腔镜下胃癌根治术的比较
3 讨 论
随着诊断方式的进步,早期胃癌的检出率明显提高,早期胃癌治疗方式主要为手术切除,外科手术治疗胃恶性肿瘤作为主要手段之一,可做到完整切除病灶,术中根据病灶情况,进一步进行淋巴清扫。但同时也具有创伤大、术后康复慢等缺点。相较传统手术治疗,ESD作为相对新颖的方式,逐渐被应用于早期胃癌的治疗。
研究表明,ESD常见并发症有穿孔、出血、炎症、黏膜水肿等。但随着内镜技术的成熟,ESD术后出现的穿孔出血等不再是导致追加手术的主要原因,本研究中仅遇到1例ESD术中出现内镜下难以控制的出血而行追加手术的情况。其次,ESD术前评估的局限性通常是导致追加手术的原因之一,浸润深度判断的困难是内镜下治疗早期胃癌的限制之一。内镜观察局限于病灶黏膜面,难以对肿瘤病灶的基底做出准确判断,术前超声内镜有助于术者更好地判断肿瘤浸润深度[6],但对于T1a、T1b的区分取决于操作者的水平。部分患者术前评估符合ESD适应证,但术中或术后病理会出现侵犯黏膜下层的可能。
ESD切除的样本病理结果至关重要,可由切缘、病灶大小、基底浸润深度、淋巴转移、脉管转移、分化程度、组织类型等方面对ESD的疗效作出评估,并可根据病理结果决定进一步的治疗方式。对于非治愈性ESD,切缘阳性、脉管淋巴管侵犯及其他导致可能存在淋巴结转移的高危因素均提示ESD术后追加手术的必要性。本研究中,我们对手术切缘或基底彻底性进行分析,结果显示,肿瘤大小、分化类型、脉管及淋巴管侵犯、浸润深度、有无溃疡与手术切缘或基底的彻底性无关,但对于术前存在溃疡的患者出现切缘或基底阳性的比例高于无溃疡形成的患者。Milhomem等[7]提出,存在溃疡是早期胃癌淋巴结转移的独立危险因素。
研究表明[8-9],对于非治愈性ESD的患者,追加手术的总生存率明显高于未追加手术组。一项倾向性评分研究结果显示[10],未追加手术组的5年生存率低于追加手术组,差异有统计学意义。在我国共识及日韩指南中[4,11-12],对于非治愈性ESD的首选方案均为追加手术。本研究纳入的16例ESD追加手术的患者均符合ESD适应证,ESD术后病理证实存在非治愈性切除,造成了追加手术。术后病理证实7例患者存在癌残留,表明追加手术对于非治愈性ESD是必须的。
目前对于如何评价ESD术后是否需要追加手术及淋巴结清扫范围仍存在很大争议。同样,盲目的追加手术可能造成过度医疗,给患者带来不必要的手术及扩大的淋巴结清扫,增加手术难度,降低预后效果。Ren等[13]的研究结果表明,无淋巴结转移的早期胃癌患者的5年生存率明显高于存在淋巴结转移的患者。ESD术后追加手术的原因主要是考虑较高的淋巴结转移。Hatta等[14]报道,非治愈性ESD术后追加手术后出现淋巴结转移率为5%~10%,并提出了eCura危险评分预测非治愈性ESD淋巴结转移的可能性。这项评分系统由五项组成,分别为淋巴管侵犯、肿瘤大小、垂直切缘阳性、脉管侵犯及黏膜下层浸润,并根据评分分为三组:低危组(0~1分)、中危组(2~4分)、高危组(5~7分)。对于高危组患者强烈推荐追加手术。本研究中16例患者行追加手术,14例为低危组,1例为中危组,1例为高危组,术后均未发现淋巴结转移。eCura评分系统有助于选择合适的患者进行追加手术。同时,eCura评分系统对于淋巴结清扫程度也有一定的指示作用。根据第4版日本胃癌治疗指南[5],对于考虑无淋巴结转移的早期胃癌患者推荐行D1及D1+的淋巴结清扫,而对于存在淋巴结转移的早期胃癌患者推荐行D2淋巴结清扫。本研究中14例低危组患者术后证实均无淋巴结转移,证实了eCura系统对于淋巴结转移的预测,同时也可避免行扩大的淋巴结清扫。
同时,切缘或基底的彻底性也是用来评估ESD疗效及是否需行追加手术的重要指标。对于单纯水平切缘阳性的非治愈性切除,是否需行追加手术仍存在一定争议。Oda等[15]报道了一项对于非治愈性切除的早期胃癌患者的研究,其中72例为单纯水平切缘阳性的患者,余者为存在较高淋巴结转移风险的患者,分为追加手术组与随访组,结果证实两组淋巴结转移率、长期无病生存率差异无统计学意义。对于部分临床评估为非治愈性切除的患者,追加手术不是必须的,选择内镜下治疗或密切随访也可能是对患者更好的选择。本研究中存在2例单纯水平切缘阳性的非治愈性切除患者,均施行追加手术,术后病理证实均存在肿瘤残留,但未见淋巴结转移。本研究中,我们将切缘阳性及癌组织紧靠切缘的患者与切缘阴性患者进行对比,结果显示存在脉管及淋巴管侵犯、存在溃疡及浸润黏膜下层的患者出现切缘或基底阳性的概率有增高的趋势,但差异无统计学意义,可能与本研究的样本量较小且均来自同一医院有关。
对于ESD追加手术的术式选择仍存在一定争议,对于早期胃癌患者,腹腔镜远端胃切除术的安全性及有效性已得到大量的研究证实,其中最早的大型RCT为韩国的KLASS01[16]。根据日本胃癌指南[5],腹腔镜远端胃切除术被推荐应用于Ⅰ期胃癌患者。但目前对于腹腔镜下全胃切除及近端胃切除仍缺乏大样本RCT研究的证据,对于此类患者,开放胃癌根治术仍是标准治疗方案。本研究将ESD术后追加手术分为腹腔镜组与开放组进行分析,两组出血量、术后通气排便时间、住院时间差异无统计学意义,主要原因归咎于样本量较少。腹腔镜组术后并发症发生率为55.6%,主要因腹腔镜组相较开放组存在更多行全胃切除的患者。总体而言,腹腔镜胃癌根治术是ESD术后有效的追加手术。
总之,对于非治愈性ESD,追加手术是安全且必要的治疗方式。通过eCura评分系统,淋巴结转移风险低的早期胃癌患者推荐行D1及D1+淋巴结清扫,存在溃疡是切缘及基底彻底性的危险因素。同时腹腔镜下胃癌根治术是ESD术后追加手术有效且安全的方式。但对于ESD术后追加手术的策略仍需要大规模临床研究的证实。
