禽源NME/NM23核苷二磷酸激酶2(NME2)基因的克隆及表达鉴定
2021-04-13谢丽基谢芝勋王盛黄娇玲邓显文谢志勤罗思思曾婷婷张艳芳张民秀范晴
谢丽基,谢芝勋,王盛,黄娇玲,邓显文,谢志勤,罗思思,曾婷婷,张艳芳,张民秀,范晴
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西 南宁 530001)
禽呼肠孤病毒(ARV)主要引起家禽的病毒性关节炎/腱鞘炎、矮小综合征及吸收不良综合征等,尤为严重的是诱发免疫抑制,造成家禽对疫苗免疫应答能力和各种病原体抵抗力降低。σA蛋白是禽呼肠孤病毒S2基因编码的结构蛋白,能激活PI3K-AKT信号通路的作用[1],与禽呼肠孤病毒抗干扰素作用有关[2],在ARV的感染致病过程中发挥重要作用。本课题组在前期的免疫共沉淀(CO-IP)、质谱鉴定以及酵母双杂交筛选的研究中发现,禽源NME2是潜在的与禽呼肠孤病毒 σA 蛋白互作的宿主蛋白[3]。
NME(non-metastasis cells)基因即NM23基因,是Steeg等[4]学者从7株转移能力不同的小鼠黑色素瘤细胞系中,用差示杂交的方法蹄选鉴定出的一种与肿瘤转移抑制相关的基因,他们将此基因命名为NME基因。迄今为止,已发现属于基因家族的有10种,它们分别是到NME1到NME10[5]。二磷酸核苷激酶(nucleoside diphosphate kinase,NDPK)活性是NME家族共同的特征[6],其中,NME2(NME/NM23核苷二磷酸激酶2)编码的NDPK的B亚基,具有核苷二磷酸激酶活性,催化二磷酸核苷转化为相对应的三磷酸核苷[7],参与细胞的的能量代谢[8]、微管解聚[9]等过程,影响肿瘤的浸润和转移。
因此,本研究构建禽源NME2基因的真核表达重组质粒pEF1α-Myc-NME2,为后续进一步验证宿主蛋白NME2是否与禽呼肠孤病毒σA相互作用,并研究其对σA基因功能的影响奠定基础。
1 材料与方法
1.1 主要试验试剂
RT-PCR试剂盒、pMDTM18-T Vector Cloning Kit、PrimeScript Ⅱ 1stStrand cDNA Synthesis Kit、pEF1α-Myc载体和限制性内切酶SalⅠ和NotⅠ购自宝日医生物技术(北京)公司;T4 DNA连接酶和质粒提取试剂盒购自Promega公司;LipofectamineTM3000 Transfection Reagent购自Invitrogen 公司;Anti-Myc tag Mouse mAb购自Cell Signaling Technology公司;山羊抗鼠IgG (FITC)购自Abcam 公司;碱性磷酸酶标记的山羊抗鼠IgG购自碧云天公司。
1.2 引物的设计与合成
根据GenBank中禽源NME2基因序列(登录号:NM_205047.1),设计合成了1对特异性引物(表1),引物序列的斜体标记为酶切位点(EcoRⅠ和NotⅠ)。

表1 引物序列
1.3 NME2基因的克隆
1.3.1 RT-PCR扩增NME2基因
提取鸡胚成纤维细胞传代系(DF-1)的RNA,使用PrimeScript Ⅱ 1stStrand cDNA Synthesis Kit反转录成cDNA,并用表1中的特异性引物,对NME2基因进行PCR扩增。
1.3.2 NME2基因的克隆
将50 μL PCR产物电泳后,切胶后用DNA片断胶回收试剂盒纯化回收。将纯化PCR产物克隆至pMD-18T载体,得到pMD-18T-NME2重组菌。抽提重组菌及空载体pEF1α-Myc的质粒,分别用限制性内切酶EcoRⅠ和NotⅠ同时进行双酶切,酶切产物切胶回收后,用T4 DNA连接酶连接转化到 DH5α 感受态细胞中,得到pEF1α-Myc-NME2重组菌。对重组菌进行PCR检测、双酶切验证,并送深圳华大基因科技服务有限公司进行测序验证。
1.4 NME2基因的表达
1.4.1 转染细胞
参照无内毒素质粒大量提取试剂盒说明书,大量提取质粒(pEF1α-Myc、pEF1α-Myc-NME2),-20 ℃保存备用。参照脂质体转染试剂盒使用说明书,将质粒分别转染长成单层的DF1细胞(6孔板),同时设立阴性细胞组(未转染质粒)。
1.4.2 间接免疫荧光和Western blot检测NME2的表达
细胞转染24 h后弃掉培养液,用PBST洗涤3次,用预冷的甲醇和丙酮混合溶液于冰上固定细胞10 min,用PBS(4 ℃预冷)洗涤3次。在pEF1α-Myc、pEF1α-Myc- NME2转染的细胞中加入Anti-Myc tag Mouse mAb(1∶1 000稀释),37 ℃作用2 h。弃去细胞板中的一抗,用PBS(4 ℃预冷)轻洗细胞5次,加入FITC标记的山羊抗鼠IgG(1∶1 000稀释),37 ℃避光作用1.5 h。弃去细胞板中的二抗,用PBS(4 ℃预冷)轻洗细胞5次,荧光显微镜观察结果。
同时,收集转染后的DF1细胞,参考文献[10]的方法,使用Anti-Myc tag Mouse mAb和碱性磷酸酶标记的山羊抗鼠IgG,对目的蛋白NME2进行Western blot检测。
2 结果与分析
2.1 重组质粒的PCR鉴定及测序
通过菌液PCR对所构建的真核表达重组质粒pEF1α-Myc-NME2的阳性克隆进行筛选。如图1所示,NME2扩增的基因片段大小为462 bp,与预期大小相符。测序结果也证实了pEF1α-Myc-NME2重组质粒的正确性。
2.2 重组质粒的双酶切验证
真核表达重组质粒pEF1α-Myc- NME2的双酶切鉴定结果见图2。重组质粒pEF1α-Myc-NME2双酶切后,得到4 622 bp的载体条带和462 bp的NME2基因条带,说明NME2基因已经正确插入到表达载体pEF1α-Myc。

M.Trans DNA Marker;1、2.pEF1α-Myc-NME2图1 真核表达重组质粒的PCR鉴定
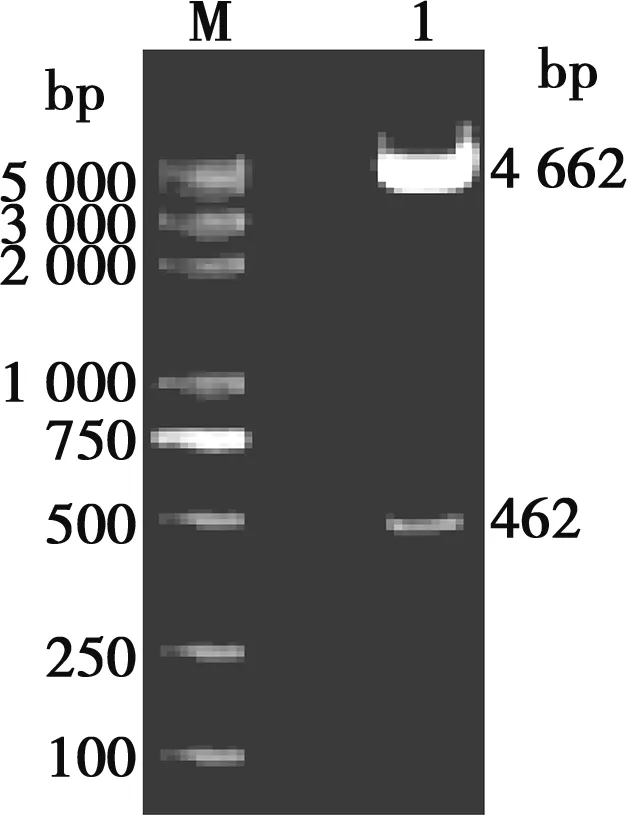
M.Trans2K Plus DNA Marker;1.pEF1α-Myc-NME2图2 真核表达重组质粒的双酶切验证
2.3 间接免疫荧光检测目的蛋白的表达
如图3所示,在荧光显微镜下,真核表达重组质粒pEF1α-Myc-NME2转染组的DF1细胞均可观察到绿色荧光的出现,而分别以鼠源Myc标签抗体为一抗的阴性对照组则无绿色荧光的出现。

A.阴性对照;B.pEF1α-Myc-NME2图3 间接免疫荧光检测结果
2.4 Western blot检测目的蛋白的表达
如图4所示,真核表达重组质粒pEF1α-Myc-NME2表达的Myc-NME2融合蛋白在大约19.4 kDa处有单一的目的条带,而阴性对照组没有条带。

M.蛋白Maker;1.阴性对照;2.pEF1α-Myc-NME2图4 Western blot检测目的基因的表达
3 讨论
NME2参与多种细胞活动,包括细胞增殖、生长、黏附和分化[11]。NME2 蛋白对于细胞凋亡也发挥重要作用。研究表明,NME2 蛋白作为Diva和Bcl2- L-10特异性结合蛋白,在细胞凋亡过程中发挥新的生物学功能[12-13]。NME2蛋白的过量表达能够诱导凋亡。Xiao等[14]研究报道,高表达量的NME2蛋白能够和TIP30转移抑制因子协同促进细胞凋亡;NME2蛋白的缺失引起Diva性凋亡活动的增加[15]。
本课题组在前期的CO-IP、质谱鉴定以及酵母双杂交的研究中,发现了禽源NME2基因蛋白是潜在的、与禽呼肠孤病毒σA蛋白互作的宿主蛋白[3]。为进一步的验证,需要将NME2基因克隆到真核表达载体,并与禽呼肠孤病毒 σA基因的重组质粒共同转染细胞,进行双向CO-IP和Western blot,验证NME2与禽呼肠孤病毒σA的相互作用。因此,本研究选定禽源NME2基因,分别设计了特异性引物进行RT-PCR扩增、双酶切和克隆,构建了宿主蛋白NME2的真核表达重组质粒,并命名为pEF1α-NME2。本研究构建重组质粒,所选用的真核表达载体pEF1α-Myc带有Myc标签,Myc这种标签的分子量较小,对后续表达的外源靶蛋白空间结构影响小,不会对蛋白质的功能产生影响。
本研究将真核表达重组质粒pEF1α-NME2转染DF1细胞后,经间接免疫荧光和Western blot两种方法,验证了Myc-NME2融合蛋白的正确表达,为后续进一步验证禽源宿主蛋白NME2是否与禽呼肠孤病毒σA蛋白相互作用奠定基础。
