湖羊PGR基因对卵泡颗粒细胞体外增殖与凋亡的影响
2021-04-13黄欣爱王洁陈明刘海霞姚晓磊李晓丹
黄欣爱,王洁,陈明,刘海霞,姚晓磊,李晓丹
(1.江苏农牧科技职业学院动物科技学院,江苏 泰州 225300;2.扬州大学动物科学与技术学院,江苏 扬州 225009;3.南京农业大学动物科技学院,江苏 南京 210095)
雌性动物的排卵是一个复杂的生理过程,涉及到机体卵巢卵泡发育和卵母细胞的成熟等功能。已证实,孕酮(progesterone,P4)是排卵过程中一个关键调节器[1]。P4可通过基因组与非基因组两个层面发挥其生理学功能。其中,基因组层面生物学功能的发挥需通过与孕酮受体(progesterone receptor,PGR)结合得以实现。研究表明,PGR是参与调控排卵的重要调节因子,在卵泡破裂和卵母细胞释放中起介导作用[2-3]。因此,在雌性动物生殖研究中探讨PGR调控卵泡发育的作用机理显得尤为重要。为揭示PGR在卵泡发育及排卵发生过程中的作用,前期研究者围绕人[4]、小鼠[5-6]、猪[7-8]、恒河猴[2]的卵巢开展部分工作,发现PGR蛋白主要定位于卵巢卵泡颗粒细胞中。同时,研究者在敲除小鼠[5]、斑马鱼[9]、大鼠[10]和恒河猴[2]PGR基因后,发现它们均不能正常排卵。研究人员在敲除PGR的小鼠模型中进一步发现,PGR能够调控其下游排卵相关基因(ADAMTS1、PPAR-γ和CTSL)的表达[ 5-6,11-12],从而影响优势卵泡的破裂和卵母细胞的释放。前期的研究还发现,PGR基因在不同大小卵泡中差异表达[7],提示PGR可能参与卵泡发育的调节。目前关于PGR基因的研究主要集中在啮齿类和哺乳动物上,但PGR在反刍动物(尤其是湖羊)中是如何发挥作用的鲜有报道。因此,为进一步探究PGR基因影响湖羊颗粒细胞增殖的作用机制,本研究在克隆并分析湖羊PGR基因的编码区序列 (coding sequence,CDS) 的基础上,探究PGR对湖羊颗粒细胞生物学功能的影响,明晰PGR基因在调节卵泡发育中的作用,旨在为挖掘湖羊多胎候选基因提供理论依据。
1 材料与方法
1.1 样品采集主要试剂和仪器
从江苏省丹阳市珥陵屠宰场采集非妊娠湖羊卵巢,采集时间为每年11月份至次年2月份,样品用于分离颗粒细胞。
兔抗PCNA(Ab15497),购自Abcam,Cambridge,英国,1∶1 000;兔抗BAX(50599-2-lg),购自ProteinTech,Chicago,IL,美国,1∶1 000;羊抗IgG(SA00001-2),购自ProteinTech,Chicago,IL,美国,1∶4 000;兔抗β-actin(bs-0061R),购自Bioss,中国北京,1∶2 000;Trizol Reagent RNA提取试剂盒购自Invitrogen,美国;Prime Script RT reagent Kit with gDNA Eraser试剂盒购自TaKaRa,中国大连;核酸蛋白测定仪ND-2000购自NanoDrop Technologies,美国)。
1.2 引物设计
引物序列及其产物大小见表1。
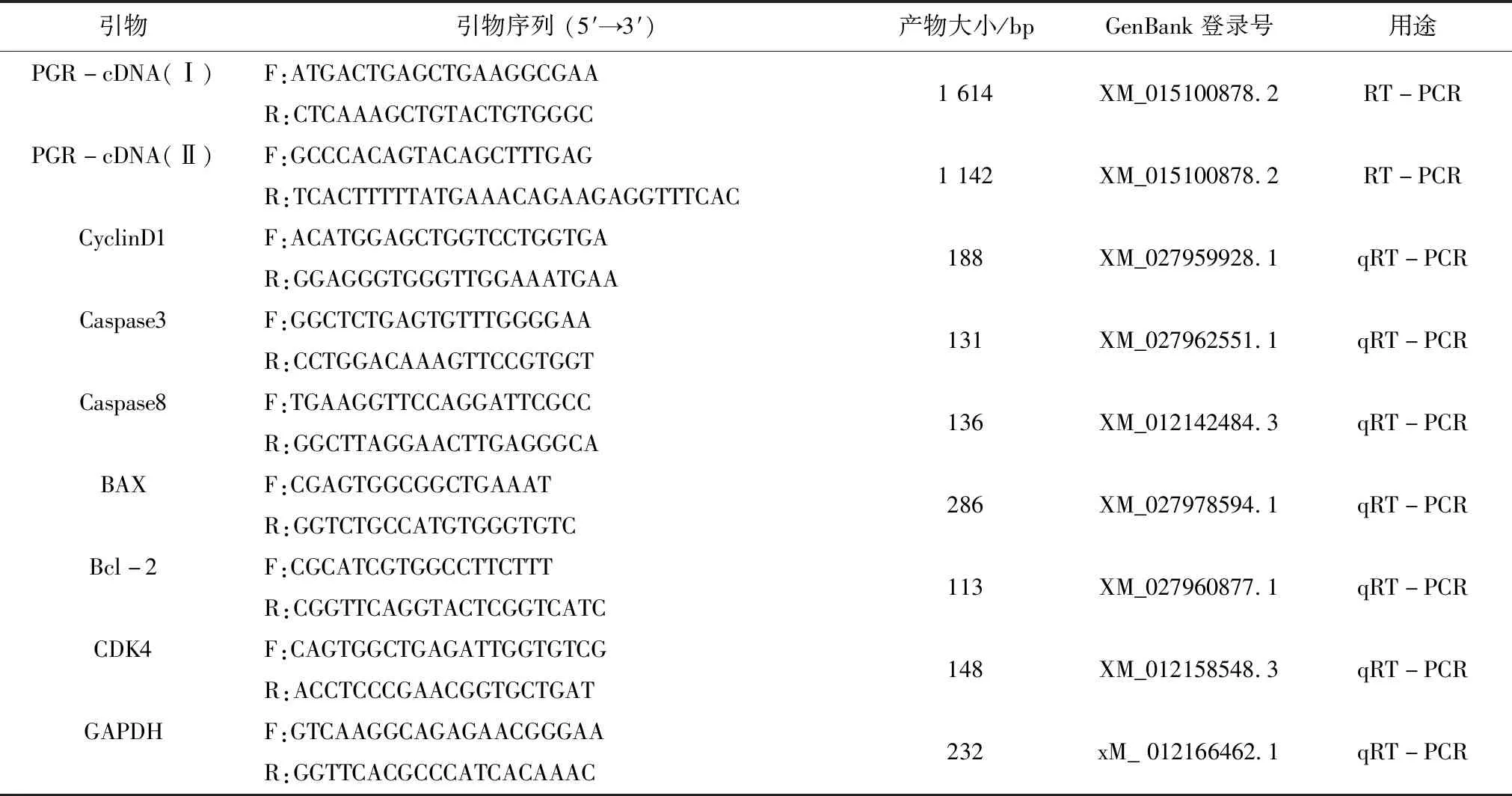
表1 引物序列
根据GenBank中绵羊PGR基因的序列(登录号:XM_015100878.2),采用Primer 5.0软件设计出扩增引物,湖羊PGR基因CDS区的引物和相关基因的定量引物序列。
1.3 cDNA片段扩增
使用实验室前期保存(-80 ℃)的湖羊卵巢RNA,进行PGR基因的扩增。反应条件为:95 ℃预变性3 min;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环,最后72 ℃再延伸7 min。反应结束后,用1%琼脂糖凝胶电泳检测,切胶回收严格按照胶回收试剂盒说明书进行。将扩增的基因片段连接到pMD19-T载体上,进一步转化到DH5α感受态细胞中,经蓝白斑筛选和菌液PCR检测后,挑取阳性克隆进行测序。
1.4 序列分析
利用DNAMAN软件对测序结果进行拼接,获得目的基因CDS区序列。通过ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/) 在线软件,找到该序列的起始和终止密码子。采用DNAMAN软件中的蛋白质翻译程序,得到湖羊PGR基因编码氨基酸的序列。通过BLAST方法在NCBI中搜索同源序列,并与其他物种的编码氨基酸的序列进行同源性分析。
依据上述获得的湖羊PGR基因CDS区序列,由上海吉玛生物制药有限公司合成过表达载体和干扰siRNA,其序列见表2。

表2 PGR的干扰序列
1.5 卵泡颗粒细胞的分离培养
将卵巢保存于含有双抗的37 ℃生理盐水中,3 h内运回实验室。用含有双抗的生理盐水冲洗卵巢3~5次后去除卵巢系膜;用5 mL注射器预先吸入1 mL含有1% 胎牛血清(Fetal Calf Serum,FBS)的杜氏磷酸缓冲液(Dulbecco’s Phosphate Buffered Saline,DPBS),在超净台内抽取2~5 mm健康卵泡的卵泡液,并将卵泡液收集置于15 mL无菌离心管中;1 500g离心5 min,用DPBS清洗1次,加入500 μL透明质酸酶(0.3%),轻轻吹打混匀,再加入5 mL完全培养基(含10% FBS的DMEM/F12),1 500g离心5 min,最后用6 mL完全培养基重悬,进行后续细胞培养。
1.6 细胞转染
将分离的湖羊颗粒细胞以适宜密度接种于6孔板中,细胞密度长到60%~70%时,将PGR基因的干扰siRNA和过表达载体转染至颗粒细胞中,转染48 h后,收集细胞,同时设置基础对照组(BC),-80 ℃保存。
1.7 细胞活力检测
将分离的湖羊颗粒细胞以适宜密度接种于96孔板中,将构建好的PGR基因干扰siRNA和过表达载体转染至颗粒细胞中,转染24 h后,每孔加入10 μL CCK8试剂,在37 ℃、5% CO2条件下培养3 h,用酶标仪测定在450 nm处的吸光度,同时设置基础对照组(BC)。
1.8 RNA提取和反转录
按照TRIzol Reagent试剂盒说明书提取上述颗粒细胞的总RNA,核酸蛋白测定仪ND-2000测定总RNA的浓度和纯度;按照Prime Script RT reagent Kit with gDNA Eraser试剂盒说明书进行反转录,cDNA置于-20 ℃保存。
1.9 qRT-PCR检测
以反转录的cDNA为模板,进行周期和凋亡相关基因的qRT-PCR扩增。反应体系为20 μL。SYBR Green Master mix (Roche,德国)10 μL,上、下游引物各0.6 μL,cDNA 1 μL,ddH2O 7.8 μL。反应条件和操作步骤严格按照试剂盒说明书进行。
1.10 Western blot检测
从-80 ℃冰箱取出样品,用添加有蛋白酶抑制剂(PMSF)的裂解液(RIPA)提取蛋白,按照BCA蛋白质定量试剂盒和蛋白变性试剂盒操作说明进行蛋白浓度的测定和变性。蛋白变性条件为70 ℃作用10 min,蛋白上样量为30 μg。SDS-PAGE电泳采用10%预制胶,200 V,30 min。转膜条件为100 V,1 h。5%牛血清白蛋白(BSA)封闭1 h,孵育兔抗PCNA、兔抗BAX和兔抗β-actin多克隆一抗,4 ℃过夜。TBST摇床上洗3次,每次10 min;羊抗兔IgG室温孵育1 h,TBST摇床上洗3次,每次10 min,电化学发光(ECL)显影并观察。用Image J软件对其灰度值进行分析。
1.11 数据统计与分析
所有试验均重复至少3次。使用SPSS 24.0(SPSS Inc.Chicago,IL,USA)软件进行统计分析。所有数据用“平均值±标准误”表示。采用单因素方差(one-way ANOVA)检验其差异显著性,P<0.05表示差异显著。应用Graph Pad Prism 5软件进行绘图。
2 结果
2.1 湖羊PGR基因CDS区序列分析
湖羊PGR基因CDS区全长为2 736 bp,编码911个氨基酸。
进一步采用DNAMAN软件与其他物种编码氨基酸的同源性进行分析,经比对发现,湖羊PGR基因编码氨基酸序列与山羊、牛、人、小鼠、大鼠、猪、鸡的同源性分别为:95.44%、89.18%、78.37%、39.66%、73.91%、81.44%和52.49%(图1)。
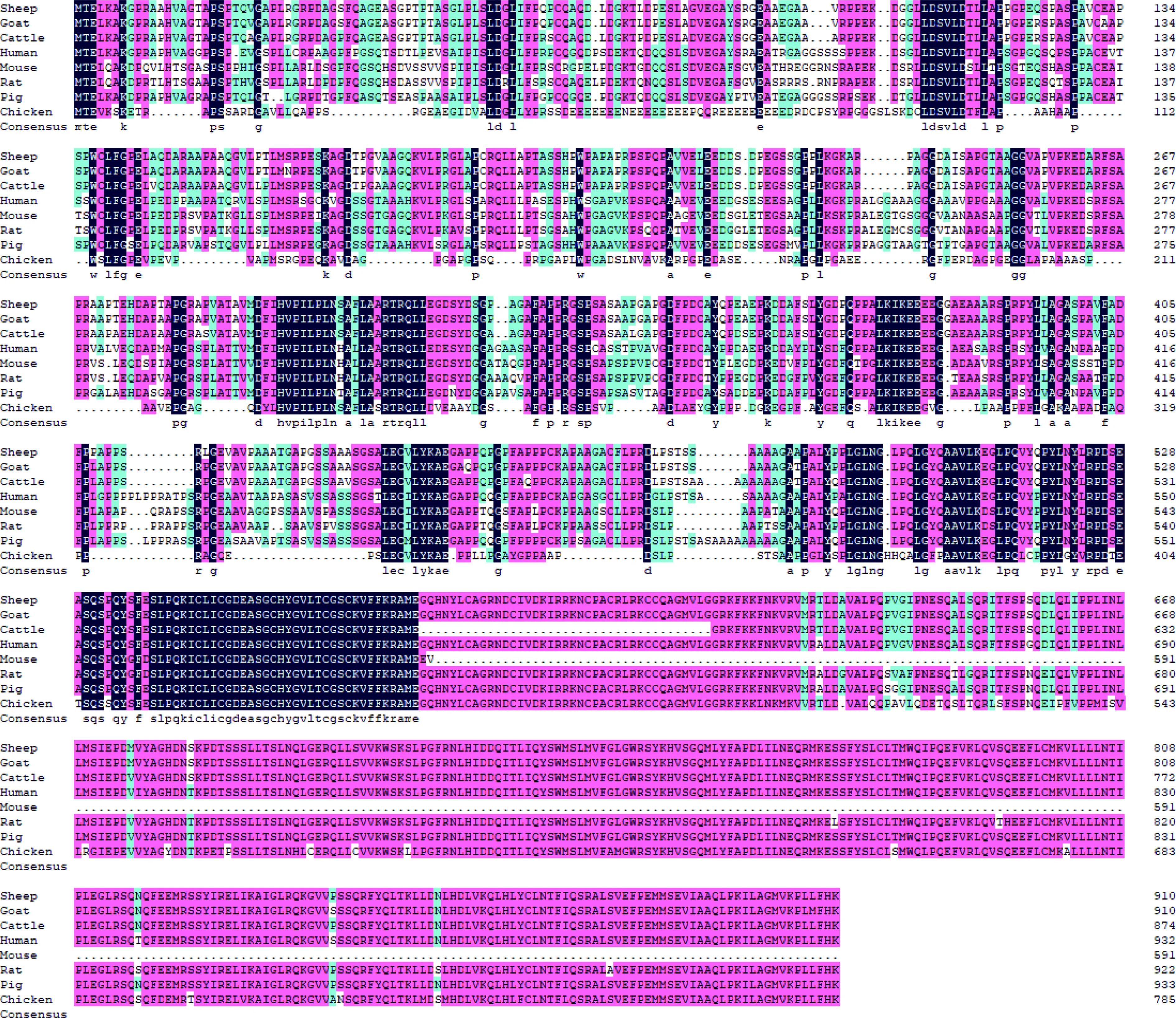
图1 不同物种PGR编码氨基酸序列比对
2.2 PGR基因对湖羊颗粒细胞体外增殖的影响
在湖羊颗粒细胞中,干扰和过表达PGR基因后,CCK8法检测细胞增殖情况,结果见图2。

柱形图上小写字母不同,表示基因表达水平差异显著,P<0.05。下同图2 PGR基因对湖羊颗粒细胞体外增殖的影响
由图2可看出,干扰PGR基因能够显著抑制颗粒细胞的增殖(P<0.05)。相反,过表达PGR基因则能显著促进颗粒细胞的增殖(P<0.05)。
2.3 PGR基因对湖羊颗粒细胞周期和凋亡相关基因表达水平的影响
干扰PGR基因可显著下调颗粒细胞中CDK4、Bcl-2基因mRNA的表达,见图3A和图3E(P<0.05),上调颗粒细胞中Caspas3、Caspase8和BAX基因mRNA的表达见图3C、图3D和图3F(P<0.05),但对CyclinD1未产生影响(图3B,P>0.05);相反,过表达PGR可显著上调CDK4、CyclinD1和Bcl-2基因mRNA的表达见图3A、图3B和图3E(P<0.05),而显著下调Caspase3、Caspase8、BAX基因mRNA的表达,见图3C和图3D(P<0.05)。同时,干扰PGR基因分别显著下调和上调颗粒细胞中PCNA和BAX蛋白表达水平,见图4A(P<0.05);相反,过表达PGR基因则分别显著上调和下调颗粒细胞中PCNA和BAX的蛋白表达水平,见图4B、图4C、图4D(P<0.05)。

A.CDK4;B.CyclinD1;C.Caspase8;D.Caspase3;E.Bcl-2;F.BAX图3 PGR基因对周期和凋亡相关基因表达的影响

A.干扰PGR基因;B、C、D.过表达PGR基因图4 PGR对BAX和PCNA蛋白表达水平的影响
3 讨论
为揭示PGR基因在湖羊卵泡发育中的作用机制,本研究首先克隆了湖羊PGR基因的CDS区序列,序列长度为2 736 bp,编码911个氨基酸,与NCBI上预测的序列一致,这为本研究后续构建PGR基因过表达载体和干扰siRNA奠定基础。已有研究发现鲤鱼PGR基因编码628个氨基酸[12]。经同源性比对,发现与山羊、牛具有较高的同源性,相似度达到89%以上,表明PGR基因在反刍动物中高度保守。提示PGR基因可能在反刍动物中具有相似的功能。
在对猪[6-7]、小鼠[4-5]、人[3]和恒河猴[2]的研究中,发现PGR在卵巢颗粒细胞中的表达。在牛不同大小卵泡中均检测到PGR基因的表达,且表达有差异[6]。在湖羊中也证实了这一点,即PGR基因在湖羊不同大小卵泡中表达存在差异性。提示PGR可能参与湖羊卵泡发育的调节,但具体机制尚不清楚。
颗粒细胞的增殖与凋亡与卵泡发育密切相关[13-14]。为揭示PGR基因在调节卵泡发育中的作用,研究者通过采用PGR拮抗剂处理人和大鼠排卵前颗粒细胞,发现PGR拮抗剂能够促进颗粒细胞凋亡[15-18]。Friberg等[19]在大鼠上也证实,PGR能够介导排卵前颗粒细胞的凋亡。Cheng等[20]研究发现,过表达PGR基因能够促进结肠平滑肌细胞的活力。本研究发现干扰PGR基因能够抑制湖羊颗粒细胞的增殖,而过表达则促进颗粒细胞的增殖,这与前期研究一致。但是,也有研究发现干扰PGR基因能够促进永生化子宫内膜细胞的增殖[21]。这提示,造成这种差异的产生的原因,可能与细胞类型及细胞状态有关。
细胞增殖和凋亡是一个极为复杂的过程,其中细胞周期和凋亡基因在其中扮演着重要角色[22-26]。本研究发现,PGR基因对调控颗粒细胞增殖与凋亡有一定的作用,干扰PGR基因能够上调Caspase3、Caspase8、BAX和下调CDK4、Bcl-2、PCNA基因或蛋白的表达水平;过表达PGR基因能够下调Caspase3、Caspase8、BAX和上调CDK4、CyclinD1、Bcl-2、PCNA基因或蛋白的表达水平。对牛排卵前颗粒细胞的研究发现,PGR能够通过下调CyclinD2和下调P27基因的表达水平,促进牛颗粒细胞的凋亡[24,26]。Friberg等[18]也报道,PGR拮抗剂通过增强Caspase3的活力,进而促进大鼠颗粒细胞的凋亡。在人和小鼠颗粒细胞中也证实了这一点[15,27]。以上研究结果表明,PGR基因通过调控细胞周期和凋亡相关基因的表达,进而影响颗粒细胞的增殖与凋亡。
4 结论
湖羊PGR基因CDS区序列长度为2 736 bp,编码911个氨基酸,与山羊和牛的同源性较高。PGR基因通过调节细胞周期和凋亡关键基因的表达,影响湖羊颗粒细胞的增殖与凋亡,进而调节卵泡发育。
