血红素氧化酶在脓毒症大鼠组织中的表达
2021-04-13张凯李文军
张凯 李文军
西北大学附属医院西安市第三医院重症医学科(西安710016)
目前脓毒症在全球已成为重症监护病房(ICU)的首要死亡原因。脓毒症根据严重程度分为脓毒症、脓毒症休克和严重脓毒症,其中严重脓毒症可引发多器官功能障碍综合征(MODS),其中临床常见的为急性肺损伤和急性呼吸窘迫综合征,其主要病理和生理学特征可引发顽固低氧血症和炎症性肺水肿。血红素加氧酶(heme oxygenase,HO)属于抗氧化剂,还是组织细胞保护酶,对内毒素引发的急性肺损伤有明显保护效果,而HO 可作为反应组织氧化应激水平的重要指标[1-2]。其中HO-1 是诱导型同工酶,一般情况下主要存在于血细胞代谢旺盛的肝、脾、骨髓等组织器官中[3-4]。HO 可将血红素分解为胆绿素和一氧化碳等,在整个分解过程中,还原辅酶Ⅱ需要为其提供电子,胆绿素则会被还原酶还原至胆红素[6]。HO-1 也称为热休克蛋白,当组织或细胞处于某些应激状态时,HO-1 能够承担保护性蛋白的作用被诱导,从而抑制人体内由细胞因子介导的细胞凋亡现象的产生,在应激状态下,很多应激成分均能够诱导HO-1表达[6-7]。本研究通过造模脓毒症肺损伤,探索HO-1 在脓毒症肺损伤中具体作用和机制,从而为脓毒症的诊治、早期治疗和预后判断提供参考指标。
1 材料与方法
1.1 材料选取40 只大鼠(雄性Wistar),体质量(210.02 ± 69.21)g,周龄(8.65 ± 1.35)周,所选择大鼠均来自于我院动物实验中心;所有大鼠均给予相同饮用水和饲料进食,给予适当光照。本实验已获得伦理文员会批准,批号:201803015。
1.2 主要试剂DAB显色试剂盒:北京中山试剂公司;多聚赖氨酸:北京中山试剂公司;乙醚:天津市化学试剂三厂;重组人红细胞生成素(3 500 IU∕支):上海实业科华生物药业有限公司;多聚赖氨酸:北京索来宝科学技术有限公司;4%多聚甲醛:临沂市泰尔化工科技有限公司;人血红素氧化酶(HO-1)免疫组化试剂盒(100T):上海雅吉酶联生物科技有限公司。分组:将所有大鼠随机分为假手术组和脓毒症组,每组20 只。对脓毒症组进行大鼠脓毒症模型构建,而假手术组仅开腹在缝合的过程,而不进行模型构建。
1.3 模型构建采用CLP 法建立脓毒症大鼠模型:在模型制作开始前12 h 内,禁止大鼠进食,可自由饮水,给药前给予大鼠10%水合氯醛生理盐水0.3 mL∕100 g,静脉全麻后对皮肤进行常规消毒,与腹部开2 cm 切口,自腹腔取出盲肠,并采用丝线结扎盲肠根部。使用9 号注射针头于盲肠端选取相距3 mm 点处进行穿刺,结束后消毒并包扎伤口。术后给予大鼠皮下注射5 mL∕100 g 生理盐水补充术中体液流失。观察大鼠在72 h 的存活情况,以72 h 内病死率在70%~80%的范围内作为理想的脓毒症模型。脓毒症组所有大鼠进行以上操作,以制作CLP 大鼠脓毒症模型;而假手术组的所有大鼠仅做开关腹处理。两组大鼠分别于术前20 min 及造模后2、6 和12 h 断头处死大鼠,开胸取肺组织标本,使用10%甲醛溶液固定,固定24 h 后将各组大鼠脑组织自4%多聚甲醛中取出,并切成0.5 cm × 0.5 cm × 1.0 cm 作为组织标本。将组织标本分别于70%、90%和95%乙醇下脱水,结束后使用100%乙醇脱水2 次,并采用二甲苯透明标本,对组织标本行石蜡包埋。取每组标本皮质部分3 张切片,对其行HE 染色。
1.4 观察指标观察肺组织的变化情况采用HE染色的方法:将石蜡切片取出,放在60 ℃的温箱中40 min,然后用二甲苯脱蜡2 次,每次40 min,然后用梯度酒精脱蜡,用自来水清洗片刻,放入苏木精中直至其变蓝色,之后再用自来水清洗1 min,清洗后使用1%盐酸酒精分化至红色后立即使用清水清洗,结束后放入伊红中40 s后再次清洗,并采用梯度酒精脱水,在切片上滴入二甲苯,最后用中性树胶封片,使其自然晾干。HO-1 表达采用Western印迹法检测,以actin 作为内参照,actin 灰度值比值即为HO-1 蛋白相对表达量。HO-1mRNA 水平的变化使用Realtime PCR 法:引物合成-提取总RNA-测定RNA 浓度-反转录合成cDNA-荧光实时定量PCR,扩增产物经琼脂糖凝胶电泳分离后扫描,用SD2.0 软件分析其Ct 值,计算各标本平均Ct 值,Ct=HO-1 Ct 值-actin Ct 值(Ct 值越低,目的基因的相对表达量越高),计算标准化后2-Ct 值表示mRNA 相对表达量。
1.5 统计学方法应用SPSS 17.0 统计学软件进行分析,计数资料采用频数和频率的方式表示,计量资料采用()表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 肺组织病理变化假手术组大鼠在2、6 h 和12 h 中的肺组织形态未发生明显变化,且未存在明显病理特征,可清晰观察到肺组织细胞结构和层次,均显示正常。脓毒症组肺组织中的病理变化较假手术组明显,肺内出现了炎症、水肿和出血等,2 h 时脓毒症组中的大鼠肺间质和肺泡出现了轻度水肿,肺泡间隔有变厚倾向,6 h 时水肿加重,肺泡间隔较之前明显增厚,且肺部体积明显增大,颜色变为暗红色,肺组织表面还可看到不同程度的充血,且于肺组织边缘发现较多肺梗死病灶,12 h 时肺组织病理特征明显减轻,肺部由暗红色变为浅红色,仍旧有充血现象,但细胞水肿现象已有明显减轻,肺组织边缘的梗死灶也比6 h 减少。两组大鼠的具体病理特征见下图1-4。
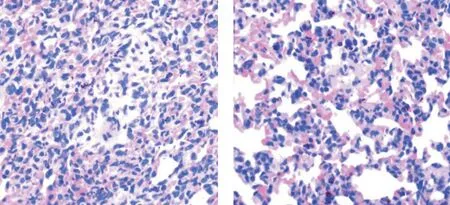
图1 两组大鼠术前病理图片(×400,左为假手术组,右为脓毒症组)Fig.1 Preoperative pathological pictures of rats in two groups(×400,sham operation group on the left and sepsis group on the right)
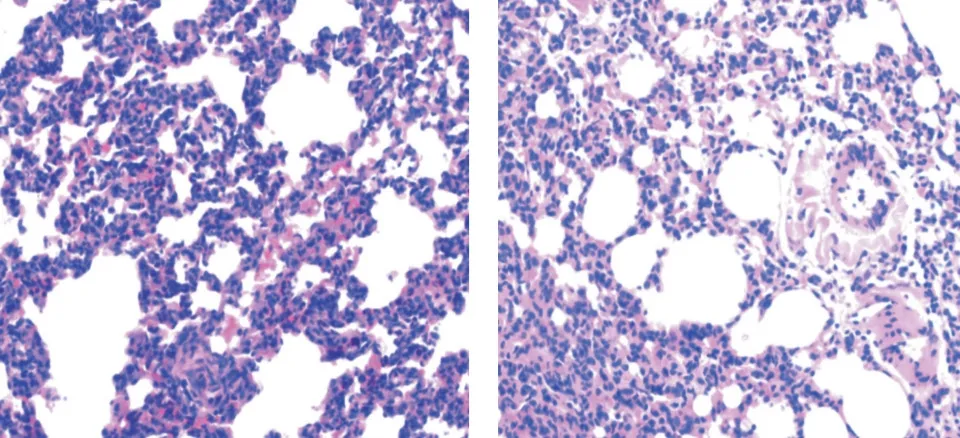
图2 两组大鼠手术后2 h 的病理图片(×400,左为假手术组,右为脓毒症组)Fig.2 Pathological pictures of rats in two groups 2 h after operation(×400,sham operation group on the left and sepsis group on the right)
2.2 Western blot 观察肺组织HO-1 蛋白比较两组大鼠在6、12、24 h 体内的HO-1 水平,见图5。图5 中可发现在各个时间点脓毒症组大鼠体内的HO-1 印迹颜色均很深,在12 h 时印迹颜色最深,其次为6、24 h 的颜色最浅;而假手术组在三个时间点的HO-1 印迹颜色均很浅,且与脓毒症组一样在12 h 印迹颜色最深,其次为6、24 h 的颜色最浅。说明假手术组大鼠体内的HO-1 表达水平均显著比假手术组高,而两组大鼠体内的HO-1 表达在12 h 后随着时间的推迟而逐渐减弱。
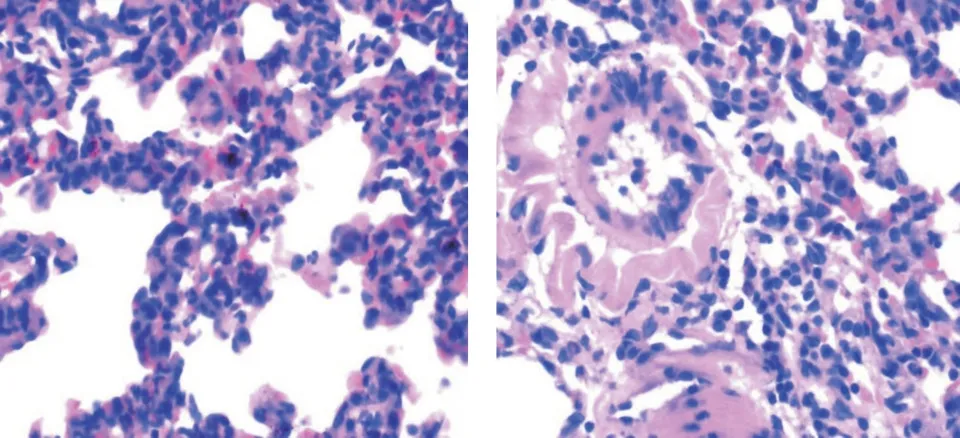
图3 两组大鼠手术手6 h 的病理图片(×400,左为假手术组,右为脓毒症组)Fig.3 pathological pictures of rats in two groups at 6 h(×400,sham operation group on the left and sepsis group on the right)
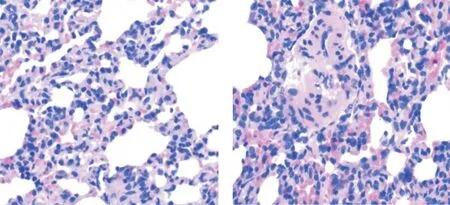
图4 两组大鼠手术12 h 后病理图片(×400,左为假手术组,右为脓毒症组)Fig.4 pathological pictures of rats in two groups after 12 h of operation(×400,sham operation group on the left and sepsis group on the right)
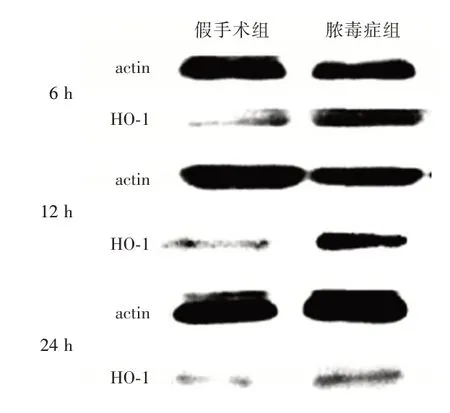
图5 大鼠肺组织中HO-1 蛋白的表达Fig.5 expression of HO-1 protein in lung tissue of rats
2.3 观察不同时间点HO-1 蛋白表达情况观察两组大鼠肺组织HO-1 蛋白OD值,发现假手术组的OD值最低,且2、6、12 h 经比较差异无统计学意义(P>0.05);脓毒症组的OD值在2 h 最低,以后逐渐上升,且3 个时间点内OD值对比差异有统计学意义(P<0.05);脓毒症组大鼠的OD值均比假手术组高,差异有统计学意义(P<0.05),见表1。
2.4 观察不同时间点HO-1mRNA表达的变化两组大鼠HO-1mRNA 表达显示假手术组OD值最低,且各时间点经比较差异无统计学意义(P>0.05);脓毒症组OD值在各个时间点均明显高于假手术组(P<0.05),见表2。
表1 各组大鼠肺组织HO-1 蛋白OD 值Tab.1 OD value of HO-1 protein in lung tissue of rats in each group ±s
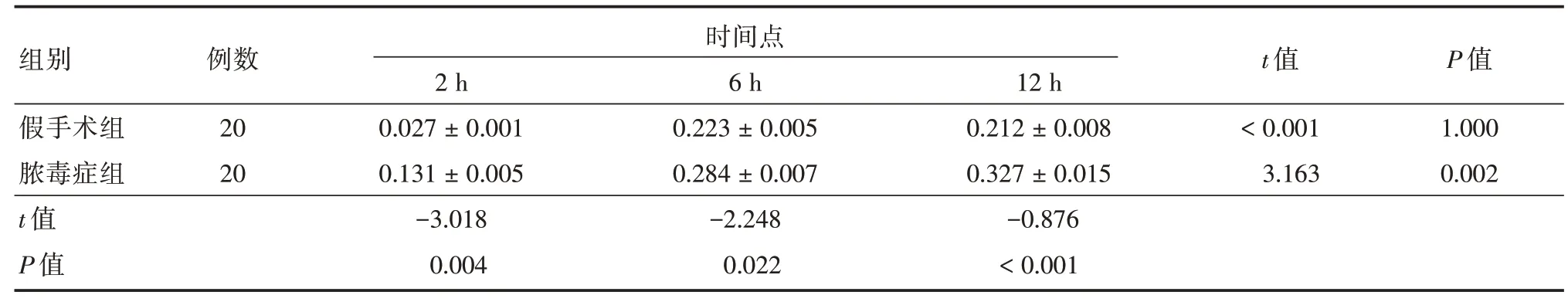
表1 各组大鼠肺组织HO-1 蛋白OD 值Tab.1 OD value of HO-1 protein in lung tissue of rats in each group ±s
2 h时6间 h点12 ht 值P 值0.027±0.0010.223±0.0050.212±0.008<0.0011.000 0.131±0.0050.284±0.0070.327±0.0153.1630.002组别假手术组脓毒症组t 值P 值例数20 20-3.018 0.004-2.248 0.022-0.876<0.001
表2 两组大鼠HO-1mRNA 表达OD 值Tab.2 OD values of HO-1 mRNA expression in two groups ±s
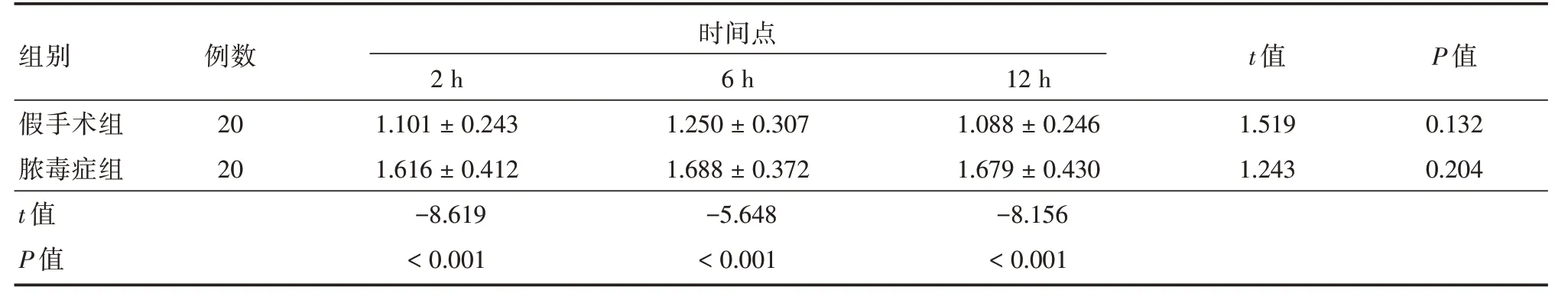
表2 两组大鼠HO-1mRNA 表达OD 值Tab.2 OD values of HO-1 mRNA expression in two groups ±s
2 h时6间 h点12 ht 值P 值.101±0.2431.250±0.3071.088±0.2461.5190.132.616±0.4121.688±0.3721.679±0.4301.2430.204组别假手术组脓毒症组t 值P 值例数20 20 1 1-8.619<0.001-5.648<0.001-8.156<0.001
3 讨论
脓毒症对患者的身体健康和生命安全都会产生严重威胁,且部分患者会发生死亡等不良结局[8-10]。调查显示,全球每年脓毒症发生例数约为1 800 万,发生率约为总人口的0.3%,且目前每年呈显著性升高[11-12]。HO 属于限速酶,对血红素具有分解和代谢的作用,而HO 受到环境和药物因素的影响下易激起细胞活性,加剧了HO-1 的表达,对HO-1 行化学或物理性的刺激时,HO-1 会随着细胞转录时导致蛋白水平持续升高[13-14]。结合最新研究发现,HO-1 与脓毒症的发生和发展存在密切关联。南川川等[15]发现脓毒症大鼠模型制备结束后分别给予HO-1 抑制剂和诱导剂,大鼠血浆中凝血功能出现明显障碍,游离TM 增加,肾脏TM 表达明显降低,且微笑求微血管内血栓形成明显,诱导剂的干预增加了肾脏TM 的表达,减轻了炎症反应和降低了游离TM,从而改善了肾脏功能,证实HO-1 可通过TM 发挥抗炎和抗凝血作用,从而起到保护肾脏的作用。
HO-1在分子学的研究机制中发现,呼吸道疾病等引发的肺损伤,可导致HO-1 表达的升高,而其作用机制对靶细胞的保护作用会明显增强[16-17]。研究发现HO-1 属于一种细胞保护性蛋白,在炎性反应过程中可抵抗各种有害刺激导致的机体损伤,且证实在脓毒症肝脏、心肌和肺部等靶器官保护方面发挥了重要作用[18]。本实验发现假手术组大鼠肺组织整体结构未发生病理性改变,且肺泡间隔未发现有增厚迹象,而脓毒症组大鼠肺组织中发生了炎症、出血和水肿等问题,且2 h 时可观察到肺泡和肺间质发生了轻度水肿,且肺泡间隔有便后迹象,6 h 水肿加重,且肺泡间隔较2 h 明显增厚,颜色变为暗红色,还可与肺组织表面看到不同程度充血现象,12 h 时在肺部组织边缘发现很多肺梗死灶再到肺部由暗红色变为浅红色,仍旧有充血的现象,但细胞水肿现象已有明显减轻,肺组织边缘的梗死灶比6 h 减少。研究发现,脓毒症组大鼠的病理形态发生了从轻度到重度再到中度的变化。研究发现HO-1 源性CO 可增加由丝分裂原激活的蛋白酶活性,且蛋白激酶还可对脂质过氧化有明显抑制作用,除外胆红素还可抑制蛋白激酶C 和NADPH 氧化酶活性,这可能是HO-1 抑制氧化应激作用产生的机制。
本实验中两组大鼠不同时间点的HO-1 印迹颜色变化为:各个时间点脓毒症组大鼠体内的HO-1 印迹颜色均很深,在12 h 印迹颜色最深,其次为6、24 h 的颜色最浅;而假手术组在三个时间点的HO-1 印迹颜色均很浅,且与脓毒症组一样在12 h 印迹颜色最深,其次为6 h 时,24 h 的颜色最浅。而对两组大鼠肺组织中HO-1 蛋白的OD值来说,假手术组也抑制保持平稳的状态,未发生明显变化,而脓毒症组OD值在2 h 最低,随着时间延长逐渐上升,且3 个时间点内的OD值对比差异有统计学意义(P<0.05);脓毒症组大鼠的OD值均比假手术组高(P<0.05),说明脓毒症组大鼠体内的HO-1 表达水平明显高于假手术组,且大鼠的病理组织学形态则随着HO-1 水平的不断升高有了明显的改善情况,证明HO-1 在大鼠体内的表达能够对脓毒症大鼠的肺组织起到明显的保护作用。有研究发现,给予乌司他丁后血浆中的炎性细胞因子IL-6 和IL-8 水平因CLP 造成的升高有所降低,抗炎因子IL-10 大量释放,增强了组织中的SOD活性,清除了氧自由基,因此考虑到HO-1 mRNA水平的降低与上述细胞因子调节有关,从而减轻了脓毒症引发的急性肺损伤。
本实验得出以下结论:脓毒症大鼠模型中,脓毒症组大鼠肺组织中HO-1 的表达与假手术组存在明显差异,脓毒症组大鼠肺组织中HO-1 的表达量明显比假手术组高,说明了HO-1 对脓毒症患者肺组织的病理形态学变化有极其密切的关系;脓毒症组中肺组织的病理形态学损伤随着肺组织中HO-1 的表达量的增加而逐渐减轻,说明HO-1 对脓毒症患者的肺组织病理形态有明显的保护作用和改善效果。
