脂蛋白相关磷脂酶A2基因多态性与子痫前期和妊娠期高血压的相关性*
2021-04-13张婵谭玉杰李希聪王灏
张婵,谭玉杰,李希聪,王灏
(1.郑州大学附属洛阳中心医院 生殖中心,河南 洛阳 471000;2.郑州大学附属洛阳中心医院 产科,河南 洛阳 471000)
妊娠期高血压(hypertensive disorder complicating pregnancy,HDCP)是全世界孕产妇和围产儿死亡的主要原因之一,发病率为2%~7%[1]。有研究表明内皮功能障碍、脂代谢异常是HDCP发病的重要环节之一,临床及早识别和发现、早期排查、筛选HDCP的危险因素、做好早预防及预警变得尤为重要[2]。目前,脂蛋白相关磷脂酶A2(lipoprotein-associated phospolipase A2,Lp-PLA2)被认为是心血管事件的独立因子[3-4],与高血压、血脂异常及高胆固醇血症等心血管事件具有一定的相关性[4],但关于Lp-PLA2基因位点多态与HDCP的相关研究未见报道。本研究通过分析Lp-PLA2基因多态性位点rs1051931、rs1421378、rs1805017及rs16874954在子痫前期及HDCP人群的分布,探讨其与子痫前期、HDCP的关系,为临床提供理论依据。
1 对象与方法
1.1 研究对象
选取2018年10月—2019年7月常规产检并住院232例待产孕妇,根据病情分为轻度子痫前期(mild preeclampsia,mPE)组68例,重度子痫前期(severe preeclampsia,sPE)组60例,HDCP组32例;选取同期待产的132例健康孕妇作为对照组。4组孕妇平均年龄分别为(29.53±5.12)岁、(31.12±4.23)岁、(31.34±4.43)岁及(30.32±4.34)岁,差异无统计学意义(P>0.05)。所有入组孕妇均同意并签署知情同意书参与本研究,孕前均无慢性高血压、心脏病、肾病、糖尿病及肝脏疾病,mPE、sPE及HDCP的诊断参考文献[5]。
1.2 方法
1.2.1标本采集及指标检测 孕妇入院时,采集晨起空腹外周静脉血5 mL,同时测量血压、收集24 h尿液进行24 h尿蛋白定量检测。外周静脉血采用乙二胺四乙酸(EDTA)抗凝、3 000 r/min离心10 min,检测空腹血糖(FPG)、空腹胰岛素(INS)、甘油三脂(TG)、总胆固醇(TC)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)水平,收集血细胞用于Lp-PLA2水平的检测。
1.2.2基因组DNA的提取及质量控制 取分离的血细胞,采用北京天根生化科技公司生产的血液基因组DNA提取试剂盒提取DNA,提取方法按照说明书进行操作。提取的DNA采用分光光度法检测浓度和纯度,取DNA溶液5 μL,采用 1%琼脂糖电泳鉴定DNA完整无降解,可以满足PCR要求。
1.2.3Lp-PLA2基因rs1051931、rs1421378、rs1805017及rs16874954位点的检测 采用Sanger测序法,首先使用美国AB Verity 96well仪器进行PCR扩增,PCR产物使用AB公司生产的3730XL测序仪进行测序验证。引物设计使用primer5软件,引物序列见表1。PCR 反应体系为20~50 μg/L模板DNA 1 μL,10 μmol/L上下游引物 2 μL,10 mmol/L DNTP mix 2 μL,10×Taq Buffer (with MgCl2) 5 μL,5 U/μL Taq酶 0.5 μL,加ddH2O补足体积至50 μL。PCR反应条件为95 ℃预变性3 min,94 ℃变性30 s、55 ℃退火30 s,35个循环,72 ℃ 8 min。测序反应体系为10 μg/L的纯化PCR产物1 μL,2.5×BigDye 4 μL,5×BigDye Seq Buffer 2 μL,3.2 nmol/L测序引物1 μL,加ddH2O补足体积至20 μL;测序反应条件为96 ℃ 1 min、96 ℃ 10 s、50 ℃ 5 s及60 ℃ 4 min,25个循环,4 ℃保温。

表1 Lp-PLA2基因4个多态位点的引物序列及扩增片段长度Tab.1 Primer sequences for detecting Lp-PLA2 polymorphism and amplified fragment lengths
1.3 统计学分析
2 结果
2.1 一般资料及血脂指标
结果显示,mPE组、sPE组及对照组孕妇入院时的收缩压及舒张压低于HDCP组(P<0.05),mPE组、sPE组及HDCP组孕妇TC、TG、LDLC高于对照组、HDLC低于对照组(P<0.05),mPE组、sPE组及HDLC组Lp-PLA 2 h和24 h蛋白尿含量高于对照组(P<0.05),mPE组Lp-PLA 2 h和24 h蛋白尿含量低于sPE组(P<0.05)。见表2。

表2 各组孕妇的一般资料及血脂指标Tab.2 Comparison of general data and the levels of blood lipid and urine protein in pregnant women in each group
2.2 Lp-PLA2基因分型测序结果
测序结果显示,Lp-PLA2基因rs1051931位点存在等位基因A和G,有AA(突变纯合子)、AG(突变杂合子)及GG(野生型) 3种基因型(图1A);rs1421378位点存在等位基因A和G,有AA(野生型)、AG(突变杂合子)、GG(突变纯合子) 3种基因型(图1B);rs1805017位点存在等位基因A和G,有AA(突变纯合子)、AG(突变杂合子)、GG(野生型)3种基因型(图1C);rs16874954位点存在等位基因A和C,有AC、CC,2种基因型(图1D)。
2.3 Lp-PLA2基因的基因型构成及等位基因频率
结果显示,4组孕妇Lp-PLA2基因rs1051931、rs1421378、rs1805017及rs16874954位点的基因型分布均符合Hardy-Weinberg平衡定律(χ2=0.047、2.058、0.120、1.210,P>0.05),见表3。如表4所示,Lp-PLA2基因rs1051931、rs1421378及rs1805017位点基因型AA、AG、GG频率分布在4组孕妇比较差异无意义(χ2=0.790、2.058、4.701,P>0.05),Lp-PLA2基因rs16874954位点基因型CC、AC在mPE组和对照组比较、差异有统计学意义(χ2=4.8,P=0.03)。进一步分析发现,携带CC基因发生妊娠期子痫和高血压疾病风险高于AC型(OR=2.139,95%CI为1.024~4.458)。

表3 Hardy-Weinberg平衡检测结果Tab.3 Hardy-Weinberg equilibrium result of Lp-PLA2 gene
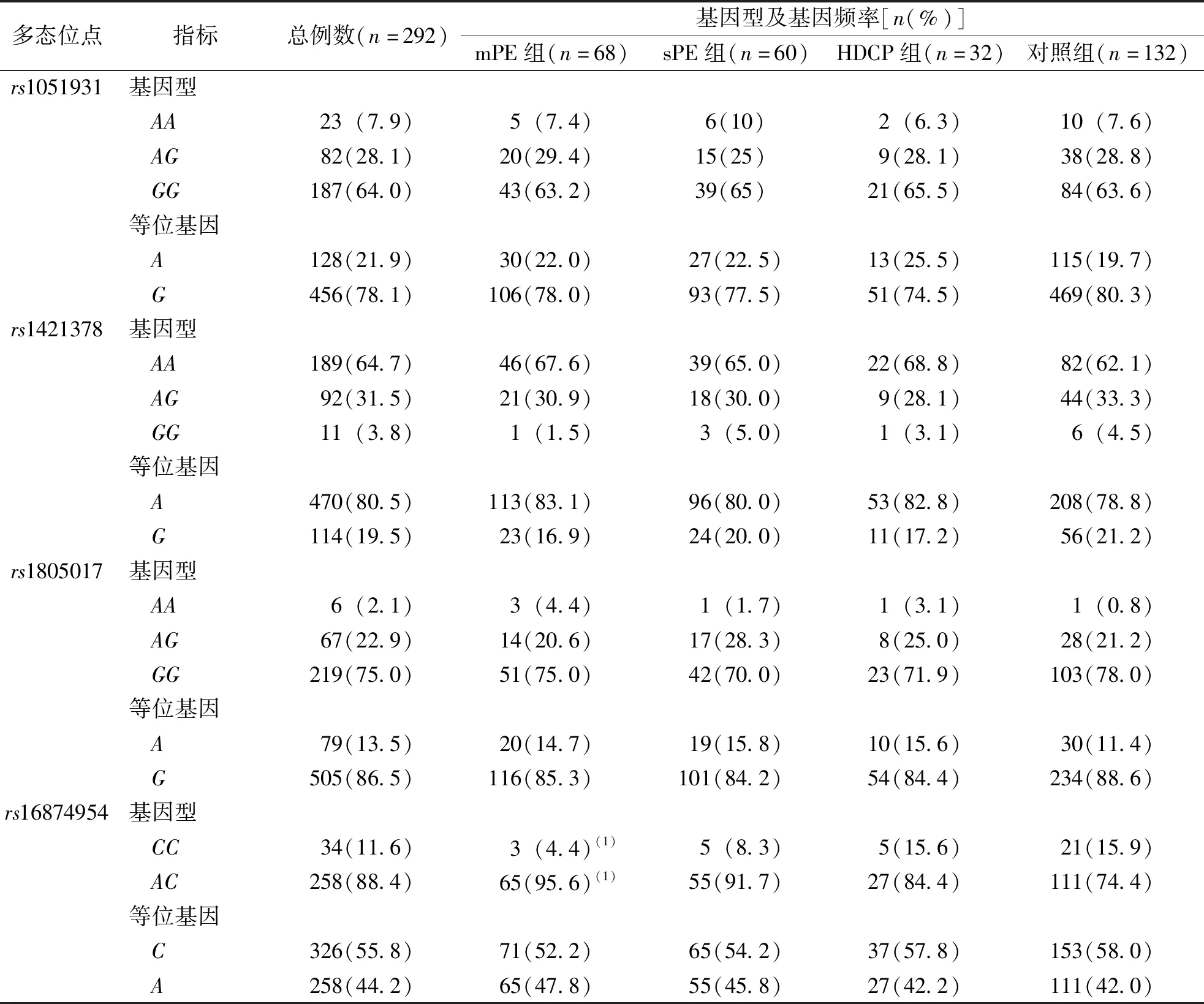
表4 各组孕妇Lp-PLA2基因4个多态位点的基因型构成及等位基因频率Tab.4 The frequencies of genotypes and alleles of Lp-PLA2 gene polymorphism in each group

注:A为rs1051931位点,B为rs1421378,C为rs16874954位点,D为rs1805017位点。图1 Lp-PLA2基因4个多态位点的测序结果Fig.1 The sequencing results of four SNP sites of Lp-PLA2 gene
2.4 子痫前期及HDCP孕妇Lp-PLA2基因4个位点的基因多态与血脂指标的关系
结果显示,rs1805017位点AG+AA基因型孕妇HDLC低于GG基因型、TG高于GG基因型(P<0.05);rs16874954位点CC基因型孕妇TG、Lp-PLA2高于AC型 (P<0.05)、HDLC低于AC型,其余血脂水平在不同基因型孕妇间比较,差异无统计学意义 (P>0.05)。见表5。

表5 子痫前期及HDCP孕妇Lp-PLA2基因4个位点的基因多态性与血脂指标的关系Tab.5 Correlation between genotypes of Lp-PLA2 gene polymorphism and blood lipid index
2.5 子痫前期和HDCP孕妇Lp-PLA2基因4个位点基因多态及血脂指标的多因素Logistic回归分析
结果显示,rs16874954位点突变与子痫前期、妊娠期高血压易感性密切相关,是子痫前期和妊娠期高血压发病的独立危险因素(OR=1.672,95%CI为1.187~2.231);其余3个位点基因多态与子痫前期、妊娠期高血压发病无相关性。见表6。
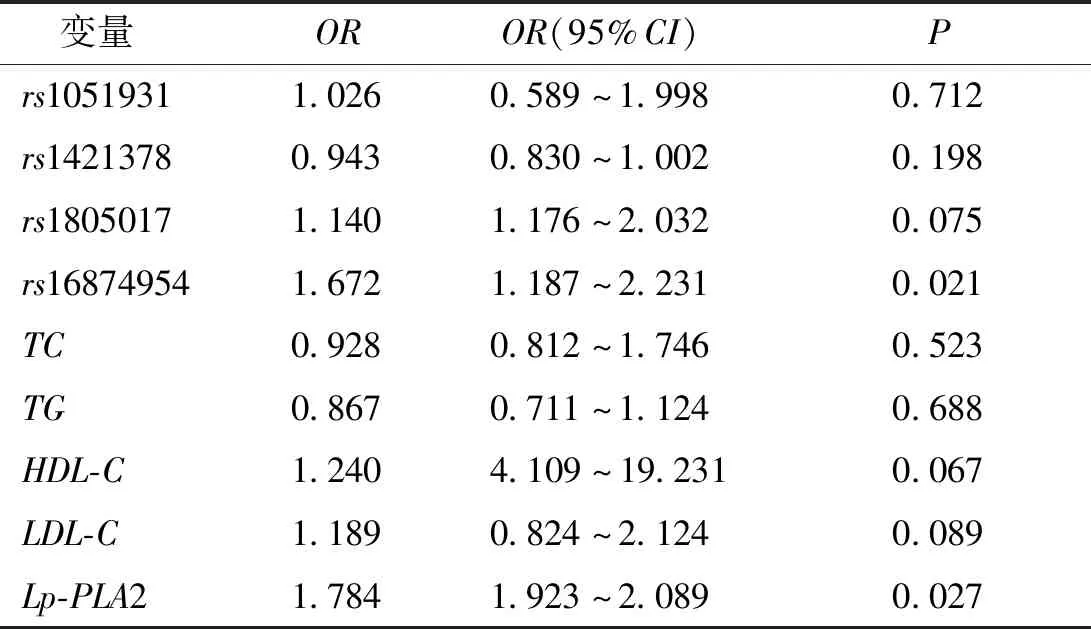
表6 Lp-PLA2基因多态性位点与子痫前期、妊娠期高血压易感性多因素Logistic回归分析Tab.6 Multivariate Logistic regression analysis of the risk factors among Lp-PLA2 gene polymorphism,lipid levels for the susceptibility to PE and HDCP
3 讨论
Lp-PLA2是一种新型的与AS相关的、由炎症细胞合成与分泌的炎症标记物,属于磷脂酶 A2超家族中的非钙离子依赖型磷脂酶A2(iPLA2),由441个氨基酸残基组成。Lp-PLA2由血管内膜浸润的巨噬细胞和淋巴细胞合成并分泌,大部分与LDL-C结合,少部分与HDL-C结合,以复合物形式在血浆中循环[6],通过水解氧化磷脂生成溶血磷脂胆碱和氧化非酯化脂肪酸,诱导慢性炎症反应的发生[7]。由于妊娠体内激素的改变,导致体内血脂有所改变,血脂水平过高,易导致氧化应激产物的增加,抗氧化物质无法清除而产生过多的氧化物质及自由基,导致子痫前期发生[8]。
根据大型的全基因组关联研究,Lp-PLA2被认为是可遗传的心血管危险因素[9-11]。子痫前期及HCDP和动脉粥样硬化具有相似的病理生理途径,并且Lp-PLA2与内皮功能障碍之间的关系在PE发病机制中得到关注。正常妊娠也表现出炎症反应,促进内皮细胞的结构和功能的变化,包括氧化应激、补体激活、分泌血管收缩剂、微血栓形成、梗塞及血栓烷水平升高。最近研究表明,这种炎症可导致局部和全身性变化,与子痫前期和HCDP相关,对血流和动脉压产生严重的影响[9]。
Lp-PLA2定位在6号染色体p21.2-p12,本研究调查了Lp-PLA2基因多态性与先兆子痫和妊高症患者相关性的关系。结果显示研究中人群中rs1051931、rs1421378、rs1805017位点的基因型主要为GG+AG,AA+AG,GG+AG[12-13]。rs1801517、rs1051931位点属于非同义突变,既往研究与冠心病有明显相关性[14]。上述3个位点在病例组和对照组分布差异无统计学意义(P>0.05)。rs16874954位点研究人群出现CC和AC两种基因型[15],有研究发现中国汉族人群rs16874954位点基因突变降低LP-PLA2的活性[16]。在此基础上,研究又进一步分析不同基因型PE和HCDP患者血脂水平的差异。rs1805017位点AG+AA基因型患者HDLC水平明显低于GG基因型患者,TG水平高于GG基因型患者(P<0.05);而rs16874954位点CC基因型患者TG、Lp-PLA2水平明显高于AC型患者(P<0.05);HDLC水平低于AC型。其余血脂水平在不同基因型患者之间差异无统计学意义(P>0.05)。说明rs1805017和rs16874954位点的基因多态性影响PE和HCDP患者的血脂水平[3,17-18],本研究发现子痫前期和HCDP孕妇的TG、TC及LDL-C水平高于对照组,与岑慧等[19]的研究一致。基因位点多态性会导致疾病发展程度不同,提示这部分基因分型可作为子痫前期和HCDP发病风险及严重程度的预测指标。
本研究结果显示,rs168749547位点突变与子痫前期、妊娠期高血压易感性密切相关,该rs16874954位点突变可能和环境共同作用下致病,提示rs16874954位点多态性突变可能是子痫前期和HCDP发病的因素。
综上所述,本次研究对子痫前期和HDCP人群进行Lp-PLA2基因多态性进行相关分析,发现rs16874954位点突变与子痫前期、HCDP易感性密切相关,rs16874954多态性位点影响血脂代谢可能与子痫前期和HDCP发生有关。另外rs1684954位点只发现2种基因型,而AA在人群中存在频率低。推测本研究由于样本量偏少,可进一步扩大样本量进行进一步验证。
