肝素脂质体温敏水凝胶的制备及其体外释放性能*
2021-04-13陈思忆李莉胡一新麦小斌黄家宇
陈思忆,李莉,胡一新,麦小斌,黄家宇*
(1.贵州医科大学 药学院,贵州 贵阳 550004;2.贵阳市第二人民医院 骨科,贵州 贵阳 550004;3.广东药科大学 生命科学与生物制药学院基础医学研究所,广东 广州 510006)
下肢深静脉血栓(lower extremity deep venous thrombosis,DVT)是一种静脉内血凝块阻塞而引起的周围血管病,常继发于创伤、分娩、肿瘤及手术等,是骨科手术患者常见的并发症[1-2],且易导致肺栓塞,严重者甚至危及生命[3-4]。肝素(heparin,Hep)是一种经典的抗凝血药物[5],临床上常用于预防血栓的形成和治疗急性静脉血栓[6-7],但是目前肝素在预防DVT时存在一些明显的缺陷,如注射后出血、药效作用时间短、给药频繁及病人顺应性差等[8],造成肝素的使用受到了限制,因此肝素缓释材料研究逐渐受到关注。目前肝素缓释材料主要有肝素缓释微球和载肝素组织工程材料,Amit等[9]利用肝素乳化工艺制得肝素缓释微囊,使得改良后肝素缓释微球的药物半衰期远高于一般肝素;国内研究结果表明,制备肝素缓释组织工程材料可达到良好的肝素缓释效果[10-11]。脂质体(liposomes)是指两亲性磷脂和胆固醇分子形成的相互间隔、定向排列组成的具有双分子层结构的封闭囊泡[12],将药物包封于类脂质双分子层内能让药物具有缓慢释放、降低毒性及改变给药途径等优点[13]。温敏水凝胶(thermosensitive hydrogels)是一类对温度变化敏感的高分子聚合物材料,在体外相较体温较低时呈液态,而在体内则呈固态,可通过局部注射到达人体病患部位,发挥靶向治疗作用,还可维持体内的血药浓度,降低不良反应,减少给药次数和血药浓度的波动,发挥缓慢释放的作用[14-15]。因此,本研究用大豆卵磷脂和胆固醇作为脂质体的膜材,用人体可降解吸收的天然高分子材料壳聚糖作为凝胶载体材料,制备一种安全无毒的肝素脂质体温敏水凝胶皮下缓释注射剂,期望能为肝素治疗DVT提供一种改良的给药途径。
1 材料与方法
1.1 材料
1.1.1药材来源 肝素钠(效价195.8 IU=1 mg,批号NHS180403,河北常山生化药业股份有限公司),亚甲基蓝(批号61734,大连美伦生物技术有限公司)。
1.1.2主要仪器 AUY120型电子分析天平、UV2700型紫外可见分光光度计(日本岛津公司),DK-98-ⅡA型电热恒温水浴锅(天津市泰斯特仪器有限公司),HNY-100B型智能恒温培养振荡器(天津欧诺仪器股份有限公司),B-490型旋转蒸发仪(瑞士步琦公司),TGL-16G型离心机(上海安亭科学仪器厂)。
1.1.3主要试剂 脱乙酰度95%的壳聚糖(chitosan,CS;批号9012764)和胆固醇(批号57885,大连美伦生物技术有限公司),β-甘油磷酸钠(β-sodium glycerophosphate,β-GP,批号1120H031)和大豆卵磷脂(批号420H021,北京索莱宝生物科技有限公司),二氯甲烷(分析纯,批号20160630,天津市科密欧化学试剂有限公司),实验用水均为纯化水。
1.2 方法
1.2.1肝素钠溶液和亚甲基蓝溶液的配制 精密称取肝素钠0.025 5 g和亚甲基蓝0.048 0 g,分别置于100 mL容量瓶中,纯水定容至刻度配制成50 000 IU/L和0.48 g/L储备液。取储备液加纯水分别稀释得1 000 IU/L肝素钠溶液和0.24 g/L亚甲基蓝溶液。
1.2.2专属性 取一定浓度的肝素钠、空白制剂分别与亚甲基蓝溶液进行反应,于紫外可见分光光度计400~800 nm波长进行紫外扫描,确定其最大吸收波长。
1.2.3线性关系与定量限、检测限 取“1.2.1”项下肝素钠溶液,纯水依次稀释浓度为250、200、150、100及50 IU/L,加亚甲基蓝溶液配成0.024 g/L浓度,得供试品;于664 nm处测定试剂空白吸光度值(A0),不同浓度肝素钠溶液吸光度值(An),△A=A0-An,以浓度(C)作为x轴,吸光度(△A)作为y轴,作线性回归,计算其定量限与检测限。
1.2.4稳定性、精密度与重复性 取“1.2.3”项下高、中及低(250、150及50 IU/L)浓度的肝素钠溶液,于664 nm处测定An值,12 h内重复6次,考察供试品的稳定性与精密度。各浓度溶液连续测定6次,考察重复性。
1.2.5加样回收率 精密称取空白制剂,配制肝素浓度分别为完全溶出时的80%、100%和120%的肝素溶液,用0.45 μm微孔滤膜过滤,精密量取续滤液,于664 nm处测定An值,计算回收率。
1.2.6肝素脂质体的制备 参考文献[16-20]和预实验结果,确定以卵磷脂与胆固醇的质量比(A因素)、卵磷脂与肝素的质量比(B因素)及水化时间(C因素)为本次正交试验的3因素,各设立3个水平,A因素为4 ∶1、6 ∶1及8 ∶1,B因素为10 ∶1、15 ∶1及20 ∶1,C因素为1、1.5及2 h,并以包封率为考察指标,进行L9(33)正交试验;初步条件摸索也考察了温度、转速及有机溶剂对包封率的影响。采用薄膜分散-超声法制备脂质体,根据处方按一定比例精密称取卵磷脂和胆固醇置于100 mL茄形瓶中,二氯甲烷10 mL溶解,水浴温度25 ℃减压旋转蒸发除去有机溶剂,至卵磷脂与胆固醇在茄形瓶内壁形成一层均匀的淡黄色薄膜,加PBS缓冲液(pH 7.4)溶解的肝素钠溶液,50 ℃水浴震荡至磷脂膜水化完全,超声处理10 min,即得淡黄色肝素脂质体。
1.2.7温敏水凝胶的制备 精密称取一定量CS和β-GP,分别溶于0.1 mol/L冰醋酸溶液和纯水中,配制成1.5%、1.8%、2.0%及2.2%的CS溶液和45%、50%、56%及60%的β-GP溶液。冰水浴条件下,边搅拌边向CS溶液中逐滴加β-GP溶液,得到一系列CS和β-GP质量比不同的澄清溶液,置于(37±0.5)℃恒温水浴锅中,采用目视结合试管倒转方法观察凝胶状态并记录胶凝时间,同时根据CS与β-GP最佳质量比配制含肝素温敏水凝胶,并考察不同缓释材料对温敏水凝胶释放性能的影响。
1.2.8肝素脂质体温敏水凝胶的制备 根据“1.2.6”项下正交试验确定肝素脂质体最佳制备工艺制备一定量的脂质体,常温备用;根据“1.2.7”项下筛选出制备温敏水凝胶的CS与β-GP最佳质量比,取一定量的肝素脂质体与2%CS溶液置于冰浴中,搅拌混合均匀,缓慢滴加56%β-GP溶液,用磁力搅拌器搅拌均匀,可制得肝素脂质体温敏水凝胶[21-22]。
1.2.9体外释放度测定 采用动态透析袋法,对肝素脂质体温敏水凝胶进行体外释放度测定。将制剂放入预先处理的透析袋中,置于盛有25 mL PBS溶液(pH 7.4)的烧杯,温度为(37±0.5)℃,振荡转速100 r/min,按时间点0.5、1、2、4、6、8、16、24、36、48、72、96、120、144、168、192、216、240、264、288、312、336及360 h依次取样,补充等温等体积的同批次PBS溶液;以空白脂质体CS/β-GP温敏水凝胶为对照,于664 nm处用紫外-可见分光光度法测定△A,根据标准曲线,计算不同时间点释放介质中肝素的含量,根据累积释放度公式F=Mt/M∞,Mt/M∞为t时间肝素累积释放百分率(%),来求出各时间点的累积释放度,绘制体外累积释药曲线。
1.3 统计学分析
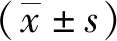
2 结果
2.1 方法学考察
2.1.1专属性 结果显示,亚甲基蓝与肝素于664和575 nm处均有吸收,且664 nm处吸收最大,同时在此条件下空白制剂均无干扰。
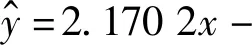
2.1.3稳定性、精密度及重复性 室温下,络合反应于0.5 h内反应完全,且此后的12 h稳定,肝素高、中、低浓度的稳定性RSD分别为1.2%、1.77%及1.09%,表明该方法稳定性较好;日内精密度RSD分别为1.56%、2.17%及1.16%,日间精密度RSD分别为2.08%、2.55%及1.48%,表示该方法精密度较良好;重复性考察的RSD分别为1.03%、0.45%及0.22%,表示该方法重复性好。
2.1.4加样回收率 肝素完全溶出80%、100%及120%的回收率分别为99.67%、100.79%及100.24%,RSD为0.56%,表明该方法回收率较好。
2.2 肝素脂质体温敏水凝胶的制备及体外释放度的测定
2.2.1脂质体的正交实验 正交实验结果表明(表1和表2),最优处方为A2B1C2,即卵磷脂与胆固醇的质量比为6 ∶1,卵磷脂与药物的质量比为10 ∶1,水化时间为1.5 h;方差分析结果显示(表2),B因素差异有统计学意义(P<0.05),且各因素对指标影响大小次序为B>C>A;处方工艺验证结果表明(表3),3批次脂质体RSD为2.07%,各批次间差异小,工艺重现性良好,制备工艺稳定、可靠。

表1 L9(33)正交试验结果Tab.1 Results of the L9(33)orthogonal design
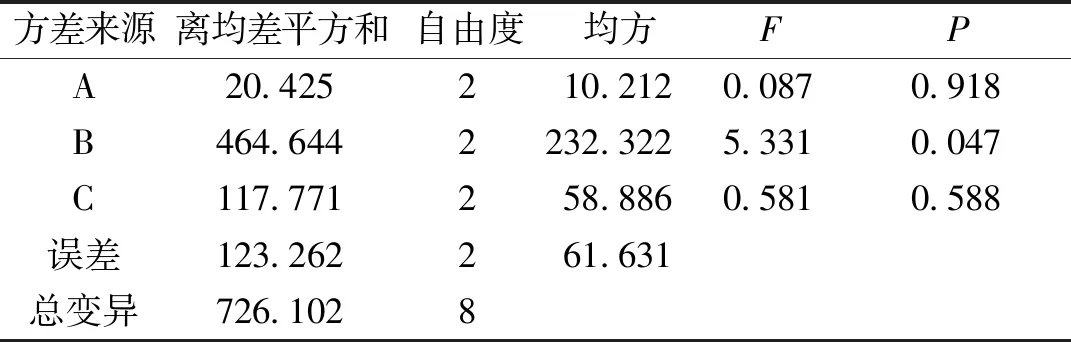
表2 正交试验方差分析结果Tab.2 Results of analysis of variance in the orthogonal test
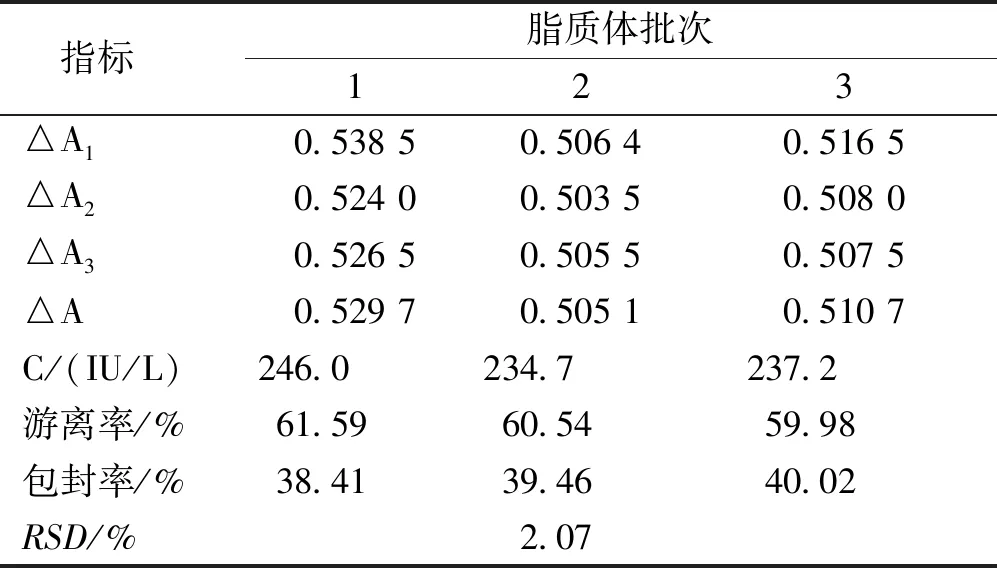
表3 各批脂质体处方工艺验证结果Tab.3 Results of three batches of liposomes of prescription process verification
2.2.2温敏水凝胶的筛选 在一定条件下,CS与β-GP的质量比减小,胶凝化过程缩短。制备好的温敏水凝胶在低温条件下,呈乳白、均匀、可流动的液体状(L);当温度接近正常生理体温,发生胶凝化转变,成胶后为乳白色不可流动的半固体凝胶(S);凝胶化前可用1 mL医用注射针头顺利吸取注射,成胶后不可注射。见表4。
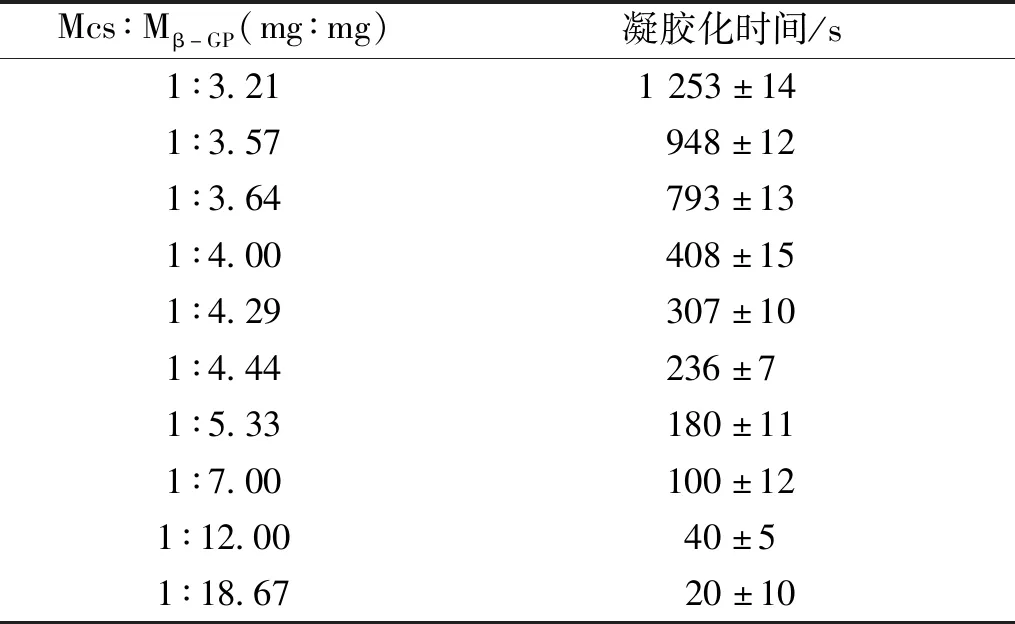
表4 CS与β-GP质量比对温敏水凝胶凝胶化时间的影响Tab.4 Effect of mass ratio of CS and β-GP on gelation time of CS/β-GP thermosensitive hydrogel
2.2.3肝素脂质体温敏水凝胶体外释药动力学 经脂质体与CS/β-GP双重包载的Hep可注射脂质体温敏水凝胶对Hep释放具有缓释作用,Hep在pH 7.4的释药介质中前0.5 h累积释放量不足3%、没有突释现象,释药144 h的累积释放量达到50%,说明通过脂质体与CS/β-GP温敏水凝胶双重包裹的肝素具有较好的缓释作用;将优化处方利用零级方程、一级方程、Higuchi模型及Ritger-Peppas模型进行释药行为拟合,结果表明,一级方程拟合的r较大,说明该方程能较好描述肝素脂质体温敏水凝胶的体外释放性能,即释药特点是按时间变化先多后少的非恒速释药;同时肝素温敏水凝胶的释药特性用Ritger-Peppas模型拟合亦较佳,且释药指数为0.529 2,药物释药机制为扩散和溶蚀协同作用,主要为扩散作用。见图1和表5。
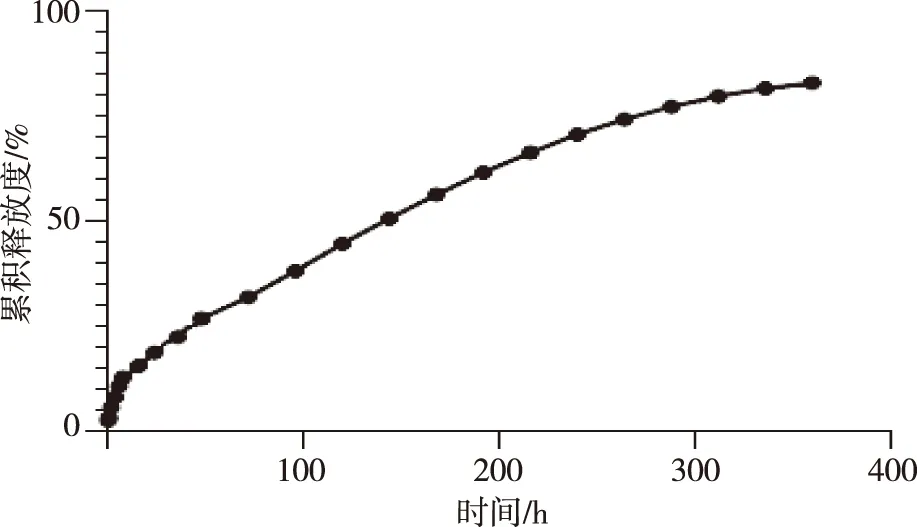
图1 肝素脂质体温敏水凝胶释药曲线Fig.1 Cumulative release curves of Hep from liposomes CS/β-GP thermosensitive hydrogels

表5 肝素脂质体温敏水凝胶中肝素释药模型拟合结果Tab.5 Hep liposomes thermosensitive hydrogels in vitro released in various models
3 讨论
临床上一般采用皮下注射肝素来治疗DVT,能极大降低致死率[23]。但肝素半衰期短,缓释效果不够理想,药效作用时间短,需连续多次注射才能有较好的治疗效果,导致病人的顺应性较差,且皮下注射易出现出血症状[8]。理想的肝素制剂应具备良好的生物相容性、可降解性、药物缓释及方便操作等性能,针对这一需求,本研究分析了一种缓释制剂,将肝素制成脂质体温敏水凝胶,使药物具有靶向性,控制药物释放速度,维持血药浓度稳定,增长药效作用时间,减少药物毒副作用,提高患者的依从性。
由于肝素是一种蛋白多糖,在紫外-可见区无紫外吸收[24],所以本次实验通过比色法来间接测定肝素的浓度,利用肝素与亚甲基蓝在一定浓度范围内的褪色反应,建立紫外可见分光光度法进行方法学考察;考察亚甲基蓝的浓度与肝素最大吸收波长,最终确定控制肝素于664 nm处有最大吸收峰,亚甲基蓝的浓度为0.024 g/L。
本实验采用薄膜分散-超声法[25-26]制备肝素脂质体,选用动态透析袋法进行体外释放度测定。通过前期三因素三水平正交实验,最终确定了卵磷脂与胆固醇的质量比为6 ∶1,卵磷脂与药物的质量比为10 ∶1,水化时间为1.5 h为最优处方,制备的脂质体具有最优的释药效能,其释药特性用Higuchi模型和Ritger-Peppas模型拟合较好。在制备肝素脂质体时,初步确定条件,考察温度(30、40、50及60 ℃)的影响,当温度较低时,肝素溶液不易将薄膜洗脱下来;温度过高则影响其磷脂化,造成水化不完全,包封率较低,最终采用温度为50 ℃。对离心转速(2 000、4 000、6 000、8 000、1 000及12 000 r/min)进行了考察,转速较小,脂质体并不能有效分离,会造成包封率偏小;转速过大,直接将以包裹的脂质体破坏,造成药物泄漏,包封率减小,较为严重的情况为达不到缓释作用,最终确定转速为8 000 r/min。卵磷脂与胆固醇的溶解采用有机溶剂。本实验考察了三氯甲烷、二氯甲烷、甲醇及无水乙醇等,最后采用毒性较小且溶解效果较好的二氯甲烷溶解。
在制备温敏水凝胶时,随着CS与β-GP的质量比减小,胶凝化过程缩短,这可能是β-GP为强碱弱酸盐,增大β-GP的量,该体系中pH值增大,由冰醋酸溶解的CS显酸性,使在体系中CS与β-GP结合的量增大,CS/β-GP间的静电引力作用增强,从而使在生理状态下,胶凝化过程缩短[22]。最终确定2%CS与56%β-GP为制备温敏水凝胶的最佳质量比。采用动态透析袋法进行体外释放度测定,其释药特性用一级方程、Higuchi模型和Ritger-Peppas模型拟合较好,药物释药机制按时间变化先多后少的非恒速释药,同时伴随扩散和溶蚀,主要为扩散作用。在制备温敏水凝胶的时候,考察了泊洛沙姆188、泊洛沙姆407、海藻酸钠及卡波姆940等缓释材料,考虑到温敏水凝胶的特殊性能,能随环境温度的改变而发生变化,最终选用壳聚糖作为凝胶载体。天然无毒可降解载体材料壳聚糖制备肝素温敏水凝胶,加入β-GP对其结构进行修饰,常温下具有可注射性,生理状态下化为半固体,可实现局部定位缓慢释放,发挥靶向制剂的作用,可维持血药浓度,减少给药剂量和次数,降低不良反应[27]。
通过将脂质体与壳聚糖两者的优势结合所制备的肝素脂质体温敏水凝胶,其体外释药特性用一级方程和Ritger-Peppas模型拟合较好,其释药特点按时间变化先多后少,其过程伴随着溶蚀和扩散,以扩散作用为主。
综上所述,本研究所制备肝素脂质体温敏水凝胶,结合脂质体与水凝胶的优势,将其释放性能更好地表现,为进一步开展体内实验打下基础,同时也为研究局部注射用肝素脂质体温敏水凝胶提供科学依据。
