大菱鲆谷胱甘肽过氧化物酶1基因的克隆及其对鳗弧菌金属蛋白酶胁迫后的响应
2021-04-12张文香李佩国华智杰李杜文河北科技师范学院动物科技学院
任 海,张文香,李佩国,华智杰,梅 静,李杜文 (河北科技师范学院 动物科技学院,
大菱鲆(Scophthalmusmaximus)是原产欧洲的名贵鱼种,是世界公认的优质比目鱼之一,在中国称“多宝鱼”或“瘤棘鲆”,是我国重要的海水养殖鱼类[1-2]。近几年,随着养殖规模不断增加,弧菌病常给大菱鲆养殖业带来巨大的经济损失,其中以鳗弧菌的危害作用最大,它的致病性与自身的毒力因子有关,其中胞外蛋白酶(金属蛋白酶)具有很强的致病性,该结果已经在INAMURA等[1]、陈吉祥等[2]和LEE等[3]的研究中被证实。陈吉祥等[2]从花鲈体内分离获得的鳗弧菌,纯化后的金属蛋白酶能够引起鲈鱼组织损伤和死亡。池政豪[4]研究证实鳗弧菌胞外金属蛋白酶对牙鲆鳃细胞具有明显的毒性作用,透射电镜观察发现鳃细胞内出现凋亡小体并出现崩解现象。GPxs是一个多酶家族的统称,目前在动物体内发现存在8种GPx,其中GPx1是第1个被发现的硒蛋白[5],它是以GSH为催化底物,通过催化氧化态的GSH生成还原态的GSH来阻断活性氧自由基(ROS)对生物体造成的进一步损伤,是体内重要的ROS清除剂[6]。目前,关于GPx1的基因克隆和表达相关研究在鱼类中已有报道,如蓝旗金枪鱼[7]、大黄鱼[8]、罗非鱼[9]和淇河鲫[10]等,然而大菱鲆GPx1基因的克隆及相关研究未见报道,因此深入了解大菱鲆GPx1基因的功能,探讨大菱鲆GPx对病原菌毒力因子的响应具有重要的理论和实践意义。
为了研究大菱鲆GPx在抵御鳗弧菌毒力因子中的作用,本研究首次利用cDNA末端快速扩增(RACE)技术克隆获得了大菱鲆GPx1全长cDNA序列,分析其生物学功能,通过qRT-PCR技术和酶活测定技术研究了GPx1基因在大菱鲆各组织中的表达以及经金属蛋白酶胁迫下GPx1基因以及GPx蛋白变化,同时检测脂质过氧化产物MDA在金属蛋白酶胁迫后的变化,为进一步阐明大菱鲆抗氧化防御系统对病原菌毒力因子的响应提供理论参考。
1 材料与方法
1.1 材料及试剂试验所用大菱鲆购自河北秦皇岛昌黎县某养殖场,挑选健康活泼的大菱鲆暂养在80 cm×40 cm×50 cm的玻璃缸中,每天投喂前吸取残饵粪便,每3 d换水1 次,每次换水量为总水量的1/2,养殖过程中盐度为19,温度为(16±1)℃,试验前暂养1周。
试验试剂:TRIzol试剂盒购自Invitrogen公司;SYBR®Premix Ex TaqTMⅡ试剂盒、反转录酶(M-MLV)、TaKaRa LA Taq®、pMD19-T Vector、感受态细胞DH5a、DNA胶回收试剂盒和SYBR Premix Ex TaqTMⅡ均购自宝生物工程(大连)有限公司;SMARTTMRACE Amplification Kit和Advantage 2PCR Kit购自Clontech公司;本试验所用引物均由生工生物工程(上海)股份有限公司北京分公司合成,其余试剂均为国产分析纯。
1.2 总RNA提取和cDNA合成取健康大菱鲆肝组织经过液氮研磨后转入盛有1 mL TRIzol的1.5 mL无RNA酶离心管中,按照试剂盒说明书提取大菱鲆肝脏组织总RNA,核酸定量测定仪(Thermo,NANO DROP-2000)检测RNA浓度,1.0%琼脂糖凝胶电泳检测完整性。以总RNA为模板,采用PrimerScript®RT reagent Kit With gDNA Eraser试剂盒去除基因组DNA后,经过37℃ 15 min延伸和85℃ 5 s逆转录反应获得cDNA第1链。按照Clontech公司生产的SMARTTMRACE Amplification Kit的说明书合成5′和3′RACE cDNA,-20℃冰箱保存备用。
1.3 大菱鲆GPx1基因cDNA片段的克隆从GenBank数据库中(http://www.ncbi.nlm.nih.gov)搜索牙鲆(EU095498.1)、塞内加尔鳎(HM068301.1)、条石鲷(AY734530.1)和大黄鱼(KY689025.1)的GPx1基因,利用DNAMAN软件进行同源性比对,在保守区域设计兼并引物(GPx-F2,GPx-R1)(表1),以大菱鲆肝脏组织cDNA为模板,进行PCR扩增,PCR扩增体系10 μL,反应条件:94℃ 5 min;94℃ 45 s,57℃ 45 s,72℃ 1 min 10 s,33个循环;72℃延伸10 min,4℃保存。1.0%琼脂糖凝胶电泳检验扩增片段正确性,使用SanPrep柱式DNA胶回收试剂盒回收纯化,与pMD19-T载体连接4 h以上后转到DH5α感受态细胞中,经菌落PCR鉴定选取阳性克隆送北京三博远志生物技术有限责任公司进行双向测序。
1.4 大菱鲆GPx1基因全长克隆经NCBI比对证实测序结果为大菱鲆GPx1基因片段后,利用Primer Primer 5.0设计GPx1基因5′和3′RACE特异性引物(GPx1-5-3和GPx1-3-2)(表1)。按照SMARTTMRACE Amplification Kit说明书进行该基因的5′-RACE和3′-RACE PCR扩增,1.0%琼脂糖凝胶电泳检测所扩增的片段大小,将扩增正确的PCR产物进行纯化和测序等,具体方法同1.3。

表1 本试验所用的引物序列
1.5 生物信息学分析利用DNAMAN进行全序列拼接,DNAStar软件预测开放阅读框(ORF)并翻译成氨基酸;ProtParam程序(http://web.expasy.org/protparam)和(http://www.expasy.org/too/protparam.html)分析蛋白质基本物理化学参数;利用(http://cn.expasy.org/prosite)对蛋白质序列功能位点进行预测;通过在线软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白质跨膜结构;通过在线软件SignalP(http://www.cbs.dtu.dk/services/SignalP)预测蛋白质信号肽;利用在线软件NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc)分析蛋白质糖基化位点;利用DNAMAN软件对大菱鲆及其他物种的GPx1氨基酸序列进行比对,然后利用MEGA 4.0构建系统进化树。
1.6 GPx1基因在不同组织中的转录水平根据GPx1基因和内参基因β-actin全长序列,利用Primer Primer 5.0软件设计荧光定量特异性引物GPx1-F、GPx1-R、Actin-F 和Actin-R(表1),按照SYBR®Premix Ex TaqTMⅡ(TaKaRa)试剂盒说明书进行PCR扩增,利用Bio-rad CF X96 荧光定量PCR仪检测GPx1基因在大菱鲆各组织(肝脏、肾脏、心脏、胃、肌肉、肠和鳃)中的表达情况,每个样品平行测定3次,采用Real-time PCR(SYBR Green)2-△△Ct相对定量法计算GPx1基因mRNA的相对表达量。
1.7 金属蛋白酶胁迫试验试验分为对照组(0.00 g/L)和金属蛋白酶组(0.15 g/L),金属蛋白酶来自本实验室,该蛋白酶制备方法参考文献[1],具体方法略作修改。将大菱鲆随机分为2组,每组3个平行,试验组注射100 μL的金属蛋白酶,对照组注射等体积无菌PBS。于注射后3、6、12、24、48和72 h 分别取肝脏和肾脏,每个时间点取3尾大菱鲆,提取总RNA反转录为cDNA。GPx1基因mRNA的相对表达量具体操作同1.3。同时,将上述时间点肝脏和头肾经液氮研磨成细粉后取50 mg 加入450 μL 生理盐水,配成1∶10的溶液,用于后续酶活测定。
1.8 肝脏和头肾组织GPx活力和MDA含量测定按照南京建成生物工程研究所试剂盒说明书测定GPx 活力和MDA 含量。
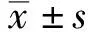
2 结果
2.1 大菱鲆GPx1基因全长cDNA的序列分析大菱鲆GPx1基因cDNA序列全长为975 bp,5′非编码区为200 bp,3′非编码区为346 bp,该基因ORF长度429 bp,编码1个由142个氨基酸残基组成的蛋白质,起始密码子ATG,终止密码子TAA,加尾信号AATAAA(图1)。预测该基因相对分子质量为16.30 kDa,理论等电点为7.20。软件分析发现该基因包括GPx家族标签序列LGVPCNQF和WNFEKF,Se 结合活性位点(Q、W和 N)和PGNG结构域,另外在3′端非编码区还包括硒代半胱氨酸插入序列。

起始密码子ATG、终止密码子TGA和PolyA加尾信号分别用黑色阴影标出;GPx家族标签序列LGVPCNQF和WNFEKF用下划线标出;Se 结合活性位点(Q、W和 N)用方框标出;PGNG结构域用虚线标出;3′端非编码区硒代半胱氨酸插入序列用双下划线标出
2.2 大菱鲆GPx1基因的同源性和系统进化分析通过BLASTP对大菱鲆GPx1基因进行同源性分析,结果显示大菱鲆GPx1与棘头梅童鱼(Collichthyslucidus)和墨西哥丽脂鲤(Astyanaxmexicanus)同源性最高,分别为85.2%和84.5%;与鱇鱼(Anabariliusgrahami)、白斑狗鱼(Esoxlucius);虹鳟(Oncorhynchusmykiss)和北极红点鲑(Salvelinusalpinus)同源性分别为82.4%、83.8%、80.9%和80.1%;与黄牛(Bostaurus)、家鼠(Musmusculus)和人(Homosapiens)的同源性最低,分别为69.7%、68.3%和69.0%(图2)。通过MEGA 4.0的Neighbor-Joining进行系统进化分析,所有动物的GPx1分为低等脊椎动物鱼类和陆生脊椎动物两支,其中,大菱鲆的GPx1与低等脊椎动物鱼类中底鳉和攀鲈聚为一支,与黄牛、家鼠、马和人等哺乳动物聚为另一支,说明大菱鲆与鱼类亲缘关系最近,与陆生哺乳动物亲缘关系最远(图3)。

图2 大菱鲆GPx1序列与其他物种GPx1氨基酸序列比对

图3 大菱鲆GPx1与其他脊椎动物GPx1核苷酸序列的NJ进化树分析
2.3 大菱鲆GPx1基因的组织转录水平RT-qPCR结果显示,GPx1基因在大菱鲆不同组织中均有表达,其中在肝脏内相对表达水平最高,其次是心、肠、胃、鳃、头肾组织,而在肌肉中的表达量最低(图4)。

图4 大菱鲆GPx1基因在不同组织中的表达分布
Real-time PCR检测大菱鲆在注射金属蛋白酶后不同时间肝脏中GPx1基因的表达情况(图5)。结果显示,与对照组相比,大菱鲆肝脏中GPx1基因在6~48 h均显著低于对照组(P<0.05),其中在24 h表达量最低(P<0.05),但是随着时间的推移,金属蛋白酶组GPx1表达逐渐增加,于72 h恢复到初始水平。

*表示同一时间点金属蛋白酶组与对照组之间差异显著(P<0.05)。下同
大菱鲆在注射金属蛋白酶后头肾中GPx1基因的表达情况结果表明,与对照组相比,在金属蛋白酶胁迫后GPx1基因表达在3和48 h均显著高于对照组(P<0.05),其中在3 h时达到最大值,在12~24 h 显著低于对照组(P<0.05),于72 h达到对照组水平。金属蛋白酶组在整个胁迫过程中均呈现先升高后下降再升高的波浪式变化趋势(图6)。
图6 注射金属蛋白酶后大菱鲆头肾GPx1基因的表达情况
2.4 金属蛋白酶对大菱鲆肝脏和头肾组织GPx活力的影响大菱鲆注射金属蛋白酶后,肝脏组织中GPx活力在6 h显著高于对照组(P<0.05),之后逐渐下降,在12~72 h均显著低于对照组(P<0.05)(图7)。

图7 金属蛋白酶对大菱鲆肝脏GPx活力的影响
在整个试验过程中,金属蛋白酶注射组头肾组织中GPx活力在3 h显著高于对照组(P<0.05),而在12~72 h均显著低于对照组(P<0.05)(图8)。
2.5 金属蛋白酶对大菱鲆肝脏和头肾组织MDA含量的影响注射金属蛋白酶后大菱鲆肝脏组织中MDA含量整体呈现先升高后下降的变化趋势,除3 h 金属蛋白酶处理组与对照组无显著性差异外,其他时间点均显著高于对照组(P<0.05),且在48 h 达到最大值(图9);而头肾组织中MDA含量出现先升高后下降再升高的波浪式变化趋势,在整个试验过程中,金属蛋白酶处理组在3~6 h与对照组无显著性差异,而在12~72 h均显著高于对照组(P<0.05)(图10)。

图9 金属蛋白酶对大菱鲆肝脏MDA含量的影响
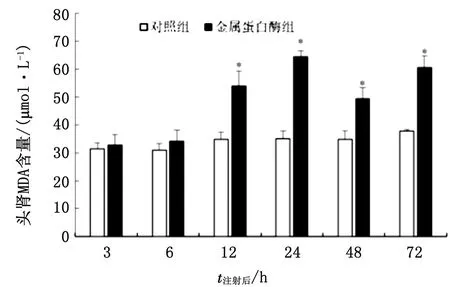
图10 金属蛋白酶对大菱鲆肾脏MDA含量的影响
3 讨论
本试验利用RACE技术首次克隆了大菱鲆GPx1基因序列,该基因全长975 bp,包含429 bp的开放阅读框,编码1个由142个氨基酸残基组成的蛋白质。序列分析发现,与其他鱼类的GPx1一样,大菱鲆GPx1基因编码的氨基酸序列包括GPx家族标签序列(LGVPCNQF和WNFEKF)以及PGNG结构域,另外在3′端非编码区还包括硒代半胱氨酸插入序列[11-12]。与其他动物氨基酸序列的比对发现,大菱鲆GPx1序列与其他鱼类GPx1的同源性较高,均大于80%。系统进化分析表明大菱鲆GPx1与其他鱼类聚为一支,其中与底鳉和攀鲈亲缘关系最近,以上结果表明该序列为大菱鲆GPx1基因。
大菱鲆GPx1 mRNA的表达具有组织特异性,RT-qPCR结果显示,大菱鲆GPx1基因在胃、心脏、肠、肝脏、鳃、肾脏和肌肉中均有表达(图4),其中,在肝脏和肠中表达量最高。有研究认为在肝脏中相对表达量最高可能是由于肝脏是生物体内的脂质代谢主要场所,该结果与淇河鲫GPx1基因表达结果相似[13]。而在肠中表达量高可能与大菱鲆是肉食性鱼类容易造成氧化应激有关[14],具体机制还需要进一步探讨。
GPx是体内普遍存在的一种过氧化物分解酶,该酶具有保护细胞膜的结构、功能以及防止过氧化物的损害作用[15]。目前关于GPx1基因在病原菌侵染鱼类的影响中已有相关报道[11,13],但是关于GPx1在病原菌毒力因子胁迫下的影响未见相关报道。本试验首次研究鳗弧菌金属蛋白酶对大菱鲆肝脏和头肾组织抗氧化酶和MDA含量的影响。结果显示,注射金属蛋白酶后大菱鲆肝脏和头肾中GPx1的表达量均有明显的时间差异性,大菱鲆肝脏中GPx1基因在3 h出现短暂上调后,在6~48 h显著下调,分析原因可能是由于肝脏作为生物体内主要的解毒器官,该基因表达量的降低可能是为其他相关基因的表达提供能量[16]。肾脏作为鱼类免疫器官,在鱼类的免疫应答过程中起主要作用[17]。本试验发现大菱鲆在注射金属蛋白酶后头肾中GPx1基因首先在胁迫3 h表达量显著升高即达到最大值,分析原因可能是由于金属蛋白酶的毒性诱导大菱鲆体内活性氧增加,通过机体免疫系统短暂反馈性增强抗氧化酶相关基因的表达以清除体内多余的ROS,STEBBING等[17]称该效应为“毒物的兴奋效应”。之后GPx1基因表达逐渐下降,在胁迫12~24 h 显著降低,吕昆伦等[10]认为头肾中GPx1 mRNA表达出现下调的原因可能是机体要控制ROS稳定在一个适度的水平。而在48 h GPx1 mRNA表达再一次显著上调,有研究指出头肾是鱼类的主要造血器官,其抗氧化酶的表达上调有助于在造血过程中消除过量ROS带来的损伤[18]。
近年来,采用GPx作为胁迫或免疫反应生物标记的研究报道屡见不鲜,主要通过测定其酶活性变化或mRNA转录水平来评估动物的抗氧化或健康状态[19-20]。本课题组前期研究发现,中、高浓度组金属蛋白酶均能够引起大菱鲆GPx活性发生变化[21]。本试验结果也显示,注射金属蛋白酶后头肾和肝脏组织中GPx活性分别于3 和6 h达到最大值,且显著高于对照组,推测可能是由于机体通过短暂提高GPx活性来抑制机体产生过多的ROS[22]。但随着时间的推移,两种组织均在12~72 h 显著低于对照组,分析可能是因为体内的ROS产生较多,故在该时间段内GPx一直处于被抑制的结果。有研究认为鱼类在长时间受到氧化胁迫,一些组织器官由于氧化应激产生的自由基会持续聚集,轻则引起细胞生物膜脂质过氧化、酶失活和DNA 损伤,重则引起机体组织病变[23]。本试验还发现注射金属蛋白酶后大菱鲆头肾组织GPx1基因/酶活力比肝脏先上调,推测可能是由于头肾组织作为机体免疫器官对毒物刺激较肝脏更敏感。王卓等[2]研究认为主要与肾脏和肝脏组织器官的生理功能不同有关。本试验还发现金属蛋白酶胁迫下大菱鲆同一组织对GPx基因转录以及酶活性影响的变化趋势不同,这一现象与重金属对淇河鲫鱼GPx的影响类似[24],导致这种现象的原因可能是由于组织中检测到的酶活性为不同同工酶的总酶活性,但mRNA的转录水平仅限于编码单一同工酶的特定抗氧化基因亚型[25]。
超量ROS能够导致机体脂质过氧化程度加剧,脂质过氧化产物增加,作为机体脂质过氧化产物的MDA,其含量可以间接反映机体细胞受损伤程度[26]。本试验结果显示,肝脏和头肾组织中MDA 均有不同程度的升高,分别在6~72 h和12~72 h显著高于对照组(P<0.05)。推测可能是由于高浓度金属蛋白酶随着胁迫时间的延长引起了机体氧化损伤,产生大量ROS,最终导致大菱鲆不同组织中脂质过氧化产物MDA增加。苏秀梅[27]研究也发现鱼源嗜麦芽寡养单胞菌胞外蛋白酶对小鼠和斑点叉尾鮰均能致死,病理组织检测证实该蛋白酶对小鼠和斑点叉尾鮰多器官都造成明显的损伤。进一步推测鳗弧菌金属蛋白酶胁迫下MDA的积累引起的氧化损伤可能是该蛋白酶对大菱鲆产生毒害作用的主要原因。另外,本试验还发现肝脏中MDA含量升高较头肾组织早,分析可能与肝脏是机体主要的解毒代谢器官有关。
