E种肠道病毒HY12毒株非结构蛋白3C单克隆抗体的制备与鉴定
2021-04-12蔡梦露宋亚伟王玮玉王浴光王新平吉林大学动物医学学院教育部人兽共患病研究重点实验室吉林长春130062
蔡梦露,章 凡,宋亚伟,王玮玉,王浴光,董 坤,王新平 (吉林大学 动物医学学院 教育部人兽共患病研究重点实验室,吉林 长春 130062)
牛肠道病毒感染是由牛肠道病毒(bovine Enterovirus,BEV)引起的一种临床上以消化道和呼吸道症状为主要特征的传染病。牛群感染该病毒后常表现为发热、咳嗽、呼吸困难、腹泻等症状,严重者甚至出现突然死亡[1]。根据病毒最新分类,肠道病毒属分为12个肠道病毒种和3个鼻病毒种,其中,E、F以及G种肠道病毒的感染均能够给畜牧业的发展造成严重危害[2]。1959年,MOLL等[3]首次报道了BEV感染的病例,随后BEV感染在世界许多国家发生和流行[4-5]。本实验室于2012年从吉林省某牛场的病牛体内分离到了国内首株E种肠道病毒,并通过分子生物克隆技术获得其全基因组序列[6]。
肠道病毒是呈二十面体对称且无囊膜包裹的单股、正链RNA病毒,其全基因组长度约为7.5 kb,包含1个大的开放阅读框(ORF),可翻译出1个前体多聚蛋白[7-8]。翻译出的多聚蛋白在蛋白水解酶的裂解作用下,可被水解为前体蛋白P1、P2和P3。前体蛋白P1又可经水解作用加工形成病毒衣壳蛋白VP1、VP2、VP3和VP4,它们负责病毒的进入、包壳以及病毒粒子的组装。前体蛋白P2和P3可水解生成7种非结构蛋白2A、2B、2C、3A、3B、3C和3D,具有参与病毒翻译和复制,促进细胞凋亡等作用[9-12]。其中,非结构蛋白3C约包含184个氨基酸,是肠道病毒中不可缺少的蛋白酶,可裂解前体蛋白P2和P3生成其他非结构蛋白;同时,3C具有RNA结合活性,可抑制宿主体内的Ⅰ型干扰素反应从而干扰宿主的天然免疫,在病毒复制以及诱导宿主细胞凋亡的过程中都扮演着重要的角色[13-14]。
由于BEV感染为国内新发传染病,现在对此病尚无有效的免疫制剂进行预防,也无有效的药物用于临床治疗;同时,有关该病毒各蛋白功能及致病机理等方面尚缺乏深入研究[6]。因此,本研究以HY12毒株非结构蛋白3C作为研究对象,制备其单克隆抗体,为今后探究BEV非结构蛋白3C的功能及其作用机理奠定基础。
1 材料与方法
1.1 试验试剂Trizol试剂、反转录试剂盒、TaqDNA聚合酶、BamHⅠ和SalⅠ限制性内切酶、T4DNA连接酶、DL2000 DNA Marker和DL5000 DNA Marker均购自TaKaRa公司;胶回收试剂盒购自北京聚合美生物有限公司;Protein Marker购自北京全式金生物技术有限公司;氨苄青霉素(Amp)、琼脂糖、IPTG诱导剂以及SDS-PAGE凝胶电泳相关试剂均购自宝泰克生物公司;弗式完全佐剂、弗式不完全佐剂、PEG4000、HRP标记羊抗鼠IgG购自Sigma公司;RMPI1640购自Gibco;96孔培养板及其他用于细胞培养的耗材、酶标板均购自Corning;FBS胎牛血清购自海克隆生物化学制品有限公司;鼠单克隆抗体亚型鉴定试剂盒购自Sino Biological公司;其他试剂均为分析纯。
1.2 实验动物、病毒、细胞及菌株SPF级BALB/c小鼠购自辽宁长生生物制品研究所;BEV HY12毒株是本实验室从吉林省某牛场发病牛体内分离得到,通过分子生物克隆技术获得其全基因组序列并经过分析,确定为国内首株E种肠道病毒,于-80℃ 冻存备用;Vero细胞、SP2/0骨髓瘤细胞均为本实验室冻存;Top10感受态细胞、BL21感受态细胞均为本实验室制备,保存于-80℃备用;pGEX-4T-1原核表达载体为本实验室冻存。
1.3 病毒的培养将Vero细胞置于37℃、5% CO2培养箱内,用含有5%胎牛血清的DMEM培养。待细胞生长至80%左右,接种适量的BEV HY12病毒液并摇晃均匀,放置于培养箱中培养,每隔4~6 h观察1次,待30%~40%的细胞出现细胞病变(CPE)时提取细胞总RNA。
1.4 细胞总RNA的提取将出现病变的细胞弃掉培养液置于冰上,加入600 μL Trizol试剂,轻轻晃动培养皿以充分裂解细胞,将裂解细胞刮下置于1.5 mL EP管中;向管中加入350 μL氯仿,颠倒混匀后于4℃ 12 000 r/min,离心10 min。将上层透明上清吸出,加入等体积的异丙醇(或2倍体积的无水乙醇)轻轻上下颠倒混匀后,4℃,12 000 r/min,离心10 min。弃掉上清,用75%的乙醇洗涤沉淀块2~3次,瞬时离心并尽量去除管底残余液体,置于冰盒上开盖晾干,最后溶于无RNase的H2O中,测定浓度后置于-80℃中保存备用。
1.5 目的基因的合成应用反转录试剂盒,以提取的总RNA作为模板合成病毒的cDNA。参照BEV HY12毒株的全基因组核苷酸序列,选取非结构蛋白3C序列中免疫原性较好且无信号肽干扰的一段序列设计合成引物,并在引物的5′端和3′端分别插入BamHⅠ和SalⅠ酶切位点。利用PCR技术,以cDNA为模板扩增出目的片段,应用1%琼脂糖凝胶电泳来验证目的片段的扩增结果。
1.6 重组质粒的构建将目的片段和原核表达载体pGEX-4T-1分别用BamHⅠ和SalⅠ限制性内切酶进行双酶切,经1%琼脂糖凝胶电泳后用胶回收试剂盒回收酶切好的目的片段和表达载体。按照合适的比例把回收的目的片段连接到表达载体pGEX-4T-1的BamHⅠ/SalⅠ酶切位点上,连接产物转化Top10感受态细胞,冰浴30 min后在42℃水浴锅中热激1 min,再冰浴3 min后加入1 mL无抗性的LB液体培养基,置于37℃摇床中振荡培养45 min后,10 000 r/min离心1 min。弃上清,用100 μL LB液体培养基重悬细菌沉淀并均匀涂布于含有Amp抗性的LB琼脂平板上,倒置于37℃温箱中培养12 h。待平板上长出菌落后,挑取琼脂平板上的单个菌落进行扩增培养,抽提质粒,用BamHⅠ/SalⅠ限制性内切酶进行酶切验证,经验证连接成功的重组质粒命名为pGEX-4T-1-3C,并送由上海生工生物有限公司测序。
1.7 重组蛋白的表达及纯化将鉴定成功的阳性重组质粒pGEX-4T-1-3C转化到BL21感受态细胞中,涂板后倒置于37℃温箱中培养,12 h后,挑取板上单个菌落置于含有Amp抗性的200 mL LB液体培养基中扩增培养。待细菌处于对数生长期时,加入1.0 mmol/L的IPTG诱导剂于37℃中诱导表达。3 h后,离心收集菌体并溶解于适量的PBS缓冲液中,10 000 r/min,离心10min,洗涤3次后置于-80℃反复冻融3次。将冻融好的菌液放置于冰上进行超声裂解20 min,裂解后于4℃,10 000 r/min,离心10 min。收集上清和沉淀后,用1.5 mol/L的尿素溶解沉淀,于4℃的环境下静置15 min后再次离心,反复3次,最后用8 mol/L的尿素溶解沉淀并分装,冻存于-80℃保存备用。
1.8 SDS-PAGE凝胶电泳将获得的上清和沉淀分别进行SDS-PAGE凝胶电泳后,用考马斯亮蓝染色液对凝胶进行染色30 min,倒掉染色液后加入考马斯亮蓝脱色液进行脱色处理。根据凝胶上呈现的结果,验证目的蛋白的表达、大小等情况是否与预期一致以及观察蛋白的纯化效果。
1.9 免疫动物及单克隆抗体的制备将纯化好的pGEX-4T-1-3C重组蛋白与弗氏完全佐剂等体积乳化混合后,于6周龄的BALB/c小鼠腹部皮下进行多点注射,保证每只小鼠注射100 μg蛋白。14 d后再次取重组蛋白与弗氏不完全佐剂等体积混合乳化,以相同的免疫剂量和免疫途径对小鼠分别进行第2次和第3次免疫;第3次免疫后7 d,对小鼠进行尾部静脉采血,应用间接ELISA方法检测免疫小鼠的血清抗体效价。当小鼠的血清效价高于104时,取100 μg蛋白直接注射于小鼠腹腔内进行冲击免疫。3~5 d后,即可对其进行眼球采血收集血清,作为鼠源抗3C蛋白多克隆抗体,并在无菌条件下采集其脾细胞与SP2/0骨髓瘤细胞按照适当的比例(一般1∶4~10)进行融合。在进行融合前的1~2 d 内,还需采集未免疫、健康小鼠的腹腔巨噬细胞作为饲养层细胞,为杂交瘤细胞提供细胞生长因子以及发挥吞噬衰老细胞和微生物的作用。
1.10 杂交瘤细胞的筛选定期对融合后的杂交瘤细胞进行观察,并在融合后5 d进行第1次半换液,此后每隔3~5 d换液1次。待杂交瘤细胞长至96孔培养板单孔面积的50%左右,应用间接ELISA方法检测其细胞上清中的抗体效价。将其D490的检测值与阴、阳性对照进行比较,筛选出D490值较高的阳性细胞孔进行后续的亚克隆试验。通过有限稀释法至少进行3次亚克隆,直到筛选出能够稳定分泌HY12非结构蛋白3C抗体的单克隆杂交瘤细胞株;并对其进行扩大培养和冻存,以备后续应用。
1.11 单克隆抗体的亚型鉴定应用Sino Biological公司生产的鼠单克隆抗体亚型鉴定试剂盒对本单克隆抗体进行亚型鉴定。根据此产品说明书进行间接ELISA试验,即以不同亚型的抗体作为包被抗原,杂交瘤细胞上清作为一抗,辣根过氧化物酶(HRP)标记的羊抗鼠IgG作为二抗,显色后借助酶标仪判定D450值。
1.12 单克隆抗体反应原性的鉴定以免疫过氧化物酶单层细胞试验(IPMA)对本单克隆抗体的反应原性进行鉴定。用适量的HY12毒株病毒液感染Vero细胞;待接毒细胞出现30%~40%的病变后,弃去培养液,加入丙酮/甲醇(1∶1)混合物置于-20℃环境下固定20 min。弃掉液体,加入5%的脱脂奶粉于37℃温箱封闭1 h,用PBST缓冲液洗涤3次,每次5 min;洗涤结束后,以阳性杂交瘤细胞的培养上清作为一抗在37℃温箱中孵育1 h;用PBST缓冲液按相同方式洗涤后,以HRP标记的羊抗鼠IgG作为二抗置于37℃温箱中孵育45 min;PBST缓冲液洗涤后,使用AEC底物显色液于37℃避光显色5~10 min,弃去显色液后用显微镜进行观察。
1.13 单克隆抗体特异性的鉴定同时以GST蛋白和HY12-3C蛋白作为抗原包被ELISA酶标板,以阳性杂交瘤细胞上清作为一抗,HRP标记的羊抗鼠IgG作为二抗进行间接ELISA检测,根据ELISA检测结果来评价本单克隆抗体的特异性。
2 结果
2.1 重组质粒pGEX-4T-1-3C的构建及鉴定以BEV HY12毒株病毒液感染Vero细胞后,用TRIzol法提取细胞总RNA并经反转录取得cDNA,以cDNA作为模板应用PCR方法扩增出HY12-3C的目的片段。如图1所示,扩增出了与预期大小相符的目的片段,约为552 bp。将扩增得到的目的片段插入到pGEX-4T-1原核表达载体中,转化Top10感受态细胞,挑取单菌落扩增培养,抽提质粒,并用BamHⅠ/SalⅠ限制性内切酶进行酶切验证。如图2所示,双酶切后获得与预期大小相一致的目的片段和原核表达载体,表明成功构建了pGEX-4T-1-3C重组质粒。经核苷酸序列测定显示,所插入的由HY12-3C氨基酸序列与原核表达载体中的GST序列处于同一读码框架中,且未发生读码移位和突变现象。
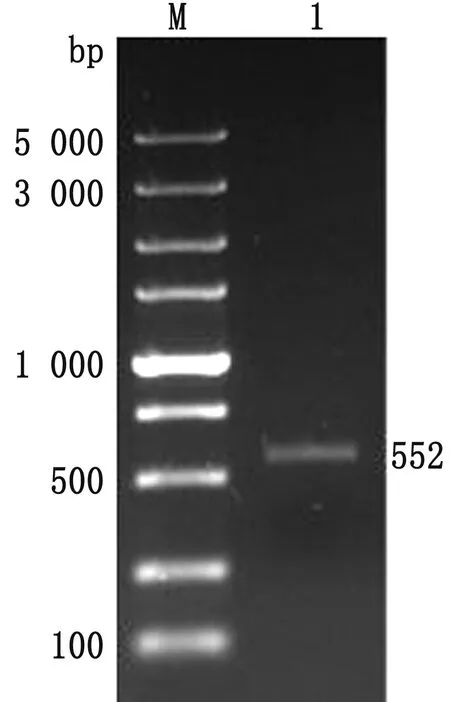
M.DL5000 DNA Marker;1,2.PCR扩增3C基因片段的电泳结果
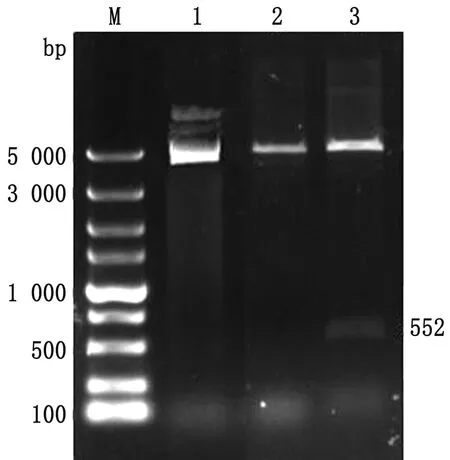
M.DL5000 DNA Marker;1.pGEX-4T-1-3C质粒对照;2.pGEX-4T-1-3C单酶切;3.pGEX-4T-1-3C双酶切
2.2 重组蛋白的表达与纯化将构建成功的重组质粒pGEX-4T-1-3C转化到BL21感受态细胞中,挑取单菌落后置于含有Amp抗性的LB液体培养基里扩增培养;待细菌生长至对数生长期时,加入1.0 mmol/L 的IPTG诱导剂进行诱导表达,并应用包涵体纯化法对诱导表达的蛋白进行纯化。经SDS-PAGE凝胶电泳,用考马斯亮蓝染色液和脱色液进行染色和脱色处理后,从凝胶上呈现的结果可以看出:加入IPTG诱导剂诱导表达的菌液表达出了与预期大小相符的蛋白,大约为46 kDa;并且对表达蛋白进行纯化后获得了1条较为明显的单一条带,表明蛋白纯化效果良好且表达的蛋白大部分来自于包涵体中(图3)。

M.蛋白Marker;1.未加IPTG诱导;2.IPTG诱导的3C重组蛋白;3.纯化后的上清;4.纯化后的包涵体
2.3 血清效价的检测小鼠经过3次腹部皮下免疫后,从其尾部静脉采血并收集血清,对血清进行倍比稀释后作为一抗,二抗选用HRP标记的羊抗鼠IgG,应用间接ELISA方法测定小鼠血清中的抗体效价。结果如图4所示,小鼠免疫前的阴性血清D490平均值为0.075;经3C蛋白免疫过的小鼠其血清稀释倍数达到1.6×104时,相应的D490值仍高于阴性血清的2倍。此时可采集小鼠的脾细胞与SP2/0骨髓瘤细胞融合制备鼠源抗3C蛋白单克隆抗体。

图4 BALB/c小鼠第3次免疫后血清抗体效价检测结果
2.4 杂交瘤细胞的制备选取效价高的小鼠与骨髓瘤细胞进行融合。经观察,本次试验的融合率大约为50%,阳性率达10%。从筛出的阳性细胞孔中选择了2株D490值较高的细胞株进行3次亚克隆,最终获得1株能够稳定分泌3C抗体的杂交瘤细胞株,并将其命名为3C9。
2.5 抗体亚型鉴定根据Sino Biological公司的鼠单克隆抗体亚型鉴定试剂盒的鉴定结果得出,本试验中获得1株单克隆抗体3C9其抗体亚型为IgM。
2.6 抗体反应原性检测应用IPMA试验对制备的3C单克隆抗体进行反应原性测定。根据结果可观察到(图5),与阴性对照和阳性对照相比,本研究制备的3C单克隆抗体可特异性地识别出肠道病毒HY12毒株感染细胞中的病毒抗原,表明本研究制备的单克隆抗体具有良好的特异性。
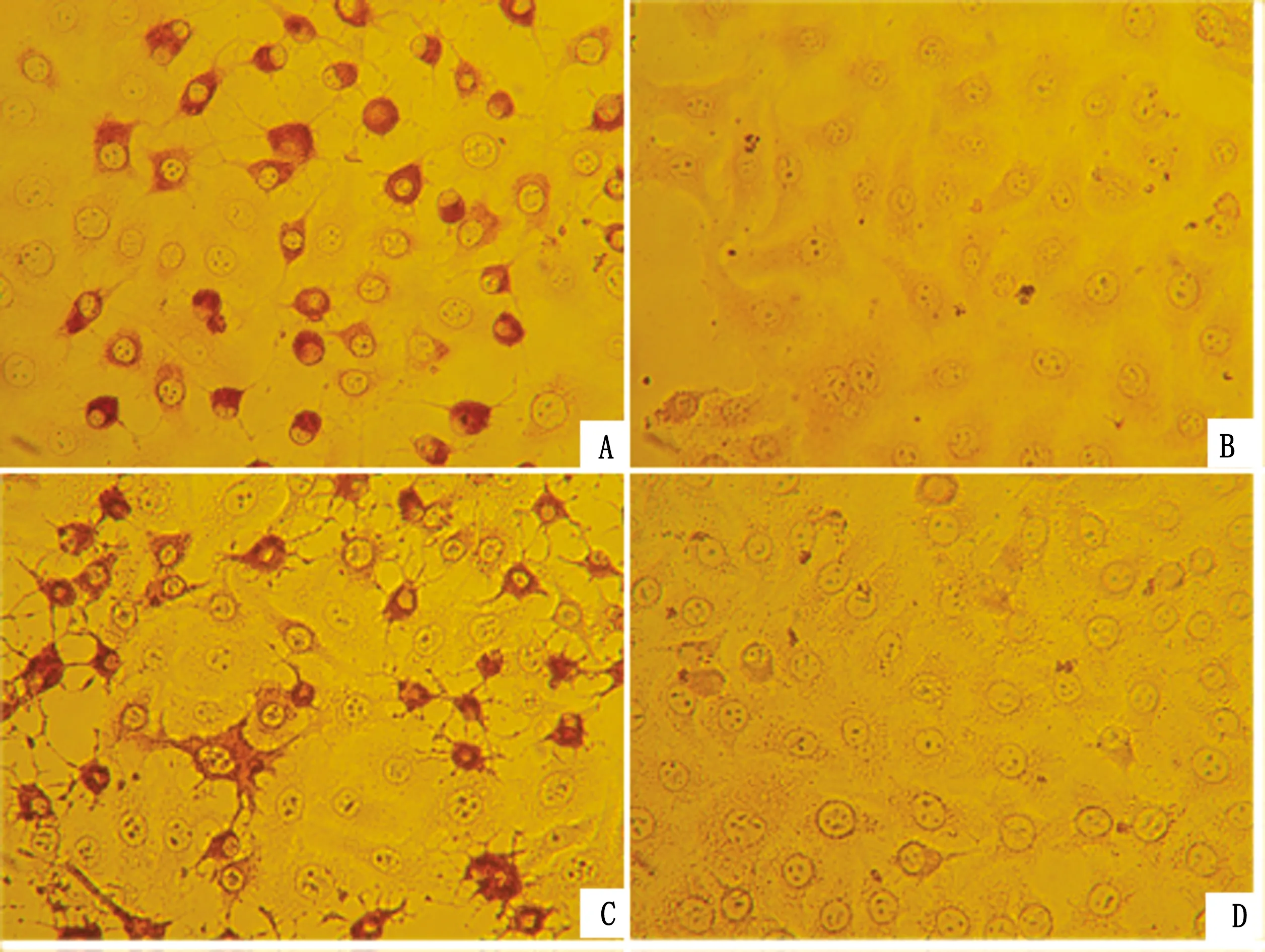
A.鼠源抗3C蛋白单克隆抗体孵育的肠道病毒HY12感染细胞;B.鼠源抗3C单克隆抗体孵育的未接毒细胞;C.阳性对照;D.阴性对照
2.7 抗体特异性检测分别以GST标签蛋白和HY12-3C蛋白作为包被抗原的间接ELISA检测结果显示,本试验获得的单克隆抗体仅与HY12-3C产生特异性反应,而与GST标签蛋白未发生任何免疫反应,表明本试验所制备的单克隆抗体具备较好的反应特异性。
3 讨论
BEV系小RNA病毒科肠道病毒的成员,在临床上可引起牛的以呼吸系统、消化系统和神经系统为主要症状的疾病。BEV感染作为国内外新发动物传染病,在牛群中的感染率较高,且常与其他病原体一起造成混合感染或继发感染,给养牛业带来了严重的经济损失[15]。BEV自1959年首次报道后,相继在国内外的许多地区发生和流行,并且该病的流行正呈现出逐步扩大的态势[3,16]。目前,临床上针对BEV的感染尚无有效的药物和疫苗进行防治,对该病毒的致病机理及各蛋白的功能等方面也缺乏进一步的研究[6]。
2012年本实验室从吉林地区某牛场病牛体内分离到首株E种肠道病毒HY12并获得了其全基因组序列[6]。本实验室邢泽黎等[17]、刘丹等[18]分别制备了E种肠道病毒结构蛋白VP1和VP2的单克隆抗体,为进一步研究肠道病毒结构蛋白的生理学特性和蛋白功能、建立肠道病毒检测方法等奠定了前期基础。同时,肠道病毒的非结构蛋白在病毒的致病过程中也发挥了及其重要的作用,尤其是非结构蛋白3C。因此,本试验通过合成HY12毒株非结构蛋白3C的特异性引物,应用PCR方法扩增出目的片段,并将其克隆到pGEX-4T-1原核表达载体上,使其诱导表达出高效的重组蛋白,以此作为抗原免疫小鼠获得特异性良好的抗3C蛋白单克隆抗体。该单克隆抗体特异性良好,为进一步建立诊断BEV感染的方法打下基础,为研究3C蛋白的生物学特性和功能奠定基础。
因大肠杆菌表达系统具有遗传背景清晰、便于操作、表达量高、产物稳定性较好、适用范围广及成本低等优点被广泛应用于基因蛋白表达[19]。本试验在使用大肠杆菌表达系统表达蛋白的过程中,摸索到的最佳表达条件是加入1.0 mmol/L的IPTG诱导剂在37℃环境下诱导表达3 h[20]。对诱导表达的蛋白超声裂解后进行了蛋白可溶性分析,结果表明该重组蛋白主要以包涵体的形式存在。包涵体表达的蛋白质没有活性,在之后的细胞裂解和蛋白纯化步骤中不用担心蛋白质是否失活;同时以包涵体形式表达的蛋白相较其他形式的蛋白在分离和纯化方面操作更为简便且成本低廉。使用包涵体纯化法对本蛋白进行纯化后用1.5 mol/L的尿素进行洗涤,最后溶解于8 mol/L的尿素中分装冻存备用。通过SDS-PAGE凝胶电泳的鉴定结果,显示该蛋白的大小与预期大小一致并且纯化效果良好。将重组蛋白与弗式佐剂乳化混合后分3次免疫BALB/c小鼠,待免疫小鼠血清效价达到104以上时即可采集小鼠脾细胞与SP2/0骨髓瘤细胞进行融合制备抗3C单克隆抗体。IPMA试验,即免疫过氧化物酶单层细胞试验,是免疫学上常用于检测病毒感染的试验之一,具有较好的特异性和较强的敏感性,且可以更为直观的观察到病毒对细胞的致病变作用。在IPMA试验中,用BEV HY12毒株感染Vero细胞,以3C杂交瘤细胞培养上清作为一抗,结果证明本试验制备的鼠源抗3C单克隆抗体可特异性地识别到病毒抗原,且该单克隆抗体特异性良好。
综上所述,本试验成功制备了特异性和反应原性较好的抗3C单克隆抗体,为进一步研究BEV非结构蛋白的功能、开发治疗药物和疫苗奠定了基础。
