兔原始生殖细胞(PGCs)体外培养和生物学特性
2021-04-12丁雪粉张德芳吕海淼闫琛博杨德新王新庄河南农业大学牧医工程学院河南郑州450000河南省科技信息研究院河南郑州450000
丁雪粉,张德芳,吕海淼,彭 展,闫琛博,杨德新,王新庄* (.河南农业大学 牧医工程学院,河南 郑州 450000;.河南省科技信息研究院,河南 郑州 450000)
在体外特定的培养条件下,兔原始生殖细胞(primordial germ cells,PGCs)可以重编程为生殖干细胞(embryonic germ cells,EGCs),EGCs具有和胚胎干细胞(embryonic stem,ES)相似的生物学特性,为再生医学的研究提供合适的种子细胞[1]。在体外,培养液中加入特定的诱导因子,PGCs可以定向分化为成熟的生殖细胞,这方面的研究在生殖生物学上有着举足轻重的地位[2]。PGCs在体外培养过程中很容易发生凋亡和分化,因此需要对PGCs的体外培养条件进行探索和优化,以促进PGCs转分化为EGCs,并阻止其分化和凋亡。有很多学者探索PGCs的体外培养条件,这对大规模培养PGCs非常有意义。本研究以胎兔为研究对象,比较了胎龄、血清(fetal bovine serum,FBS)、血清替代物(knockout serum replacement,KSR)、维甲酸(retinoic acid,RA)、福司柯林(forskolin,FK)和三苯氧胺(4-hydroxytamoxifen,4OHT)等因素对PGCs分离培养的影响,并探究其生物学特性,完善兔PGCs体外分离培养条件,为下一步的建系工作奠定基础。
1 材料与方法
1.1 实验动物6月龄以上日本大耳白兔购自河南省实验动物中心。
1.2 主要试剂H-DMEM干粉培养基、胎牛血清、双抗、非必需氨基酸(NEAA)和Knockout-DMEM购自Gibco公司;FK、4OHT、RA和转铁蛋白和白血病抑制因子(LIF)购自北京索莱宝科技有限公司;Trizol试剂、反转录试剂盒、DNA Maker等购自TaKaRa公司。
1.3 PGCs基础培养液的配制PGCs基础培养液的配制方法详见表1。

表1 PGCs基础培养液的配制
1.4 不同成份PGCs培养液的配置基础培养液标记为A培养液;在A中加入3 μmol/L RA,记为B培养液;在A中加入100 nmol/L 4OHT,记为C培养液;在A中加入20 μmol/L FK,记为D培养液;在A中加入3 μmol/L RA和20 μmol/L FK,记为E培养液;在A中加入3 μmol/L RA和100 nmol/L 4OHT,记为F培养液;在A中加入100 nmol/L 4OHT和20 μmol/L FK,记为G培养液;在A中同时加入100 nmol/L 4OHT、20 μmol/L FK和3 μmol/L RA,记为H培养液。
1.5 不同胎龄兔PGCs分离培养分别取妊娠E10.5、E11.5、E12.5、E13.5、E14.5和E15.5的孕兔子宫,分离生殖嵴。以24孔板每孔接种2个生殖嵴密度为宜。24 h进行第1次换液,之后隔天换液。
1.6 胎龄对PGCs体外培养的影响从不同胎龄的兔生殖嵴中分离PGCs,加入含有15% KSR的基础培养液。每个胎龄重复接种3次,取3次的平均值记为当天的集落数量。每天在显微镜下观察细胞生长状态,记录形成集落数量,细胞集落数量为纵坐标,时间为横坐标,用Graphpad Prism 7制作细胞生长曲线图。
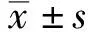
1.9 兔PGCs的传代培养原代PGCs在体外培养7~10 d,对其进行传代培养,玻璃细针小心挑出集落,离心重悬后接种到新制备的饲养层上。
1.10 分化能力检测PGCs体外培养形成集落后,用玻璃细针小心地挑出集落,转移到含有2 mL消化液的离心管中。离心后用不含LIF的基础液A(加入15% KSR),去除饲养层,接种在96孔板上。
1.11 兔PGCs多能性的鉴定
1.11.1形态学观察 PGCs接种之后,每24 h在显微镜下观察PGCs的状态并拍照。
1.11.2碱性磷酸酶(AKP)染色 按照AKP染色试剂盒的说明书进行操作,以饲养层细胞为阴性对照,染色后PGCs集落中的AKP呈红黑色,为阳性;无色或浅红色则为阴性。
1.11.3RT-PCR检测 引物由尚亚生物技术公司合成(表2)。收取未分化的集落,提取RNA,反转录为cDNA后进行DNA凝胶电泳。PCR 20 μL反应体系为:PrimeScript RT Enzyme Mix 10 μL,上、下游引物各1 μL,cDNA 1 μL,dd H2O 7 μL。PCR反应条件为:95℃ 30 s;95℃ 5 s(40个循环);60℃ 30 s。

表2 PCR扩增引物
2 结果
2.1 兔PGCs生长行为观察在倒置显微镜下,兔PGCs表现出相互吸附、聚集和迁移的生物学特征,呈条索状(图1A)。随后PGCs继续迁移及增殖,铺满24孔板底部。呈现1个较大集落,似ES形态,有1个大的半透明核,1个突出的单个核仁,相对较少的细胞质,PGCs聚集成岛屿状或巢状,集落中细胞之间排列致密,界线不清,表面光滑,但集落边缘清晰,立体感强(图1B)。PGCs迁移过程中,也会有空泡状的集落出来(图1C),同时进行大量的增殖(图1D)。
2.2 传代后的PGCs传代之后单个PGCs仍可以聚集形成集落,但是传代后的集落形态没有原代立体。第1次传代后PGCs迁移聚集成集落样生长的能力较强,细胞活性较好(图2A);第2次传代后PGCs仍可以聚集成集落样生长,但细胞的活力有所降低,有很多单细胞没有聚集成明显的集落(图2B)。这表明随着传代次数的增加,细胞活力会逐渐降低。本试验只进行了2次传代。
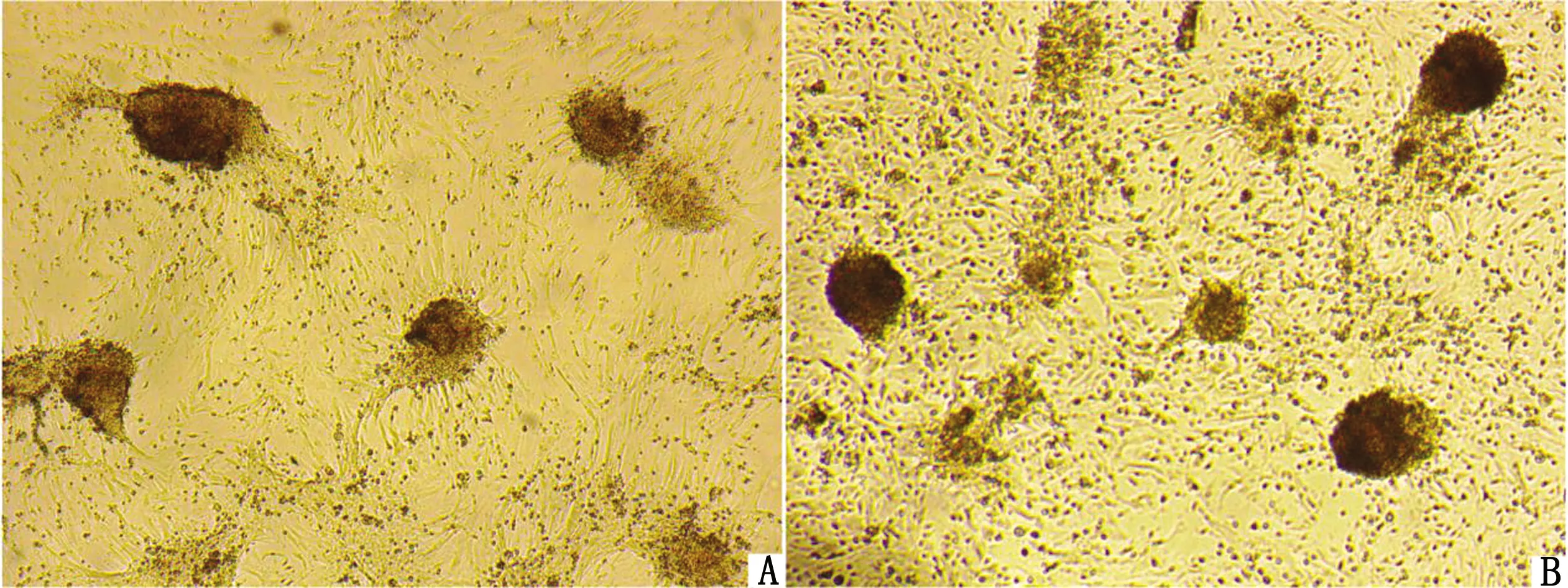
A.第1次传代后的PGCs;B.第2次传代后的PGCs(40×)
2.3 兔PGCs多能性鉴定将集落进行AKP染色,为红黑色,呈阳性,集落内的细胞展现出很高的AKP活性,饲养层不着色(图3A),这是多能性细胞的标志。PGCs可以自发分化为成纤维样、上皮样、神经样等细胞(图3B、C)。形成的PGCs克隆(EGCs),消化为单细胞悬液,撤去LIF和饲养层后,培养5 d可形成拟胚体(图3D)。拟胚体在显微镜下观察呈球状。这也表明PGCs在体外特定的培养条件下可以重编程为具有多能性EGCs,多能性OCT-4基因呈阳性表达(图4)。

A.AKP染色呈阳性;B.PGCs分化为神经样细胞;C.PGCs分化为上皮样细胞(40×);D.拟胚体
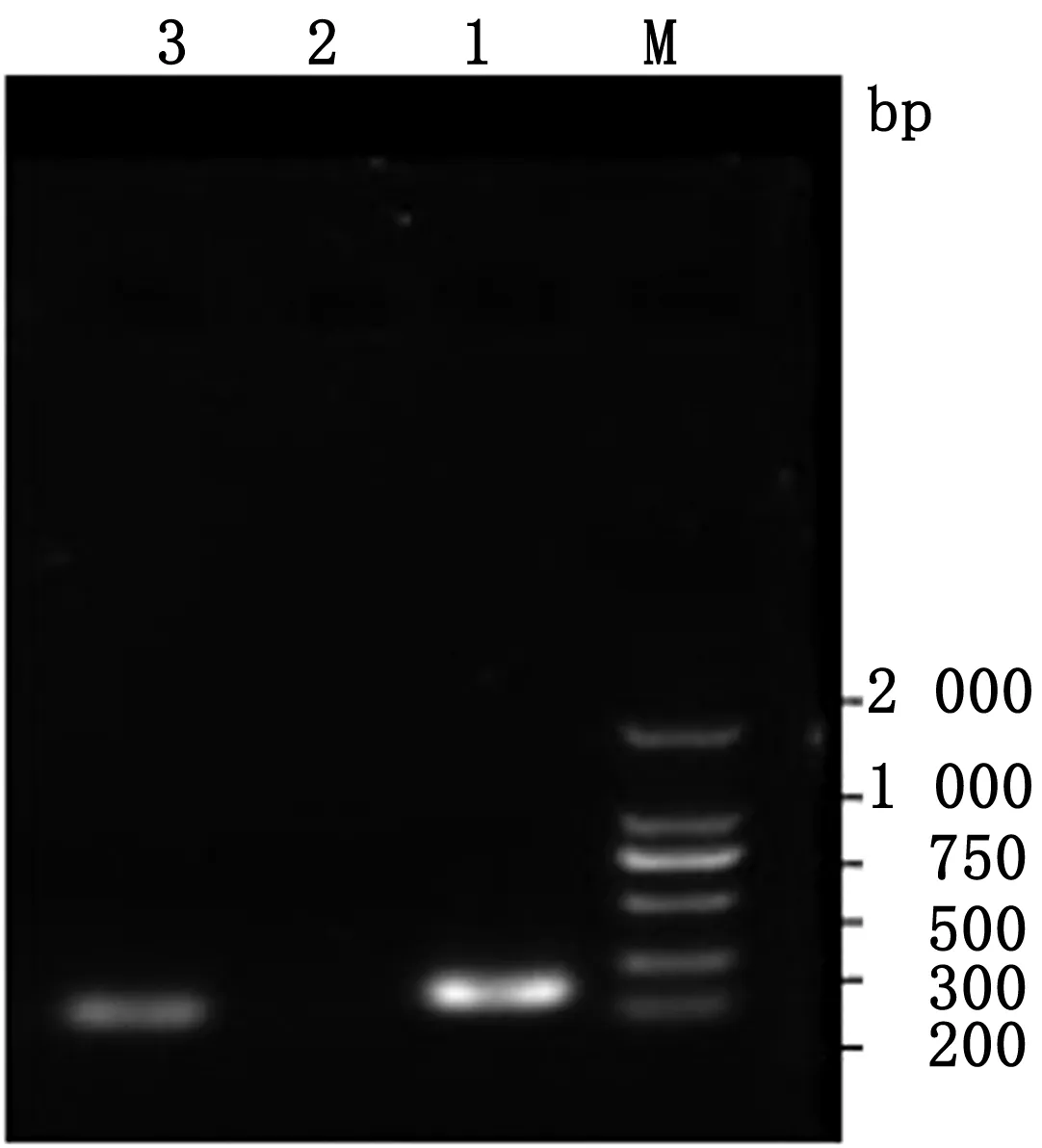
M.DL2000 DNA Marker;1.GAPDH;2.阴性对照;3.OCT-4
2.4 胎龄对PGCs体外培养的影响E10.5和E11.5的PGCs集落数基本一致,生长曲线也基本一致。E12.5的PGCs集落数大于E13.5的PGCs集落数。E14.5和E15.5的PGCs集落数基本一致。E10.5和E11.5的PGCs集落数要明显大于E12.5、E13.5、E14.5和E15.5。PGCs形成的集落数随胎龄的增加依次减少(图5)。

图5 不同胎龄的PGCs生长曲线图
2.5 RA、FK、4OHT对PGCs体外培养的影响E10.5、E13.5和E15.5的PGCs在不同培养液中培养,24 h后均没有集落形成,72 h后均出现集落。H组培养液中的集落数量相对于其他组数量较多(表3~5)。E15.5的PGCs增殖缓慢,只有很少的集落形成。相对于E13.5和E15.5的PGCs,E10.5的PGCs在同样培养液中的集落数量较多,尤其在H组培养液中的集落数量较多。

表3 E10.5胎兔PGCs集落个数
2.6 有无血清对兔PGCs体外培养的影响在15% FBS组中,以A组培养液集落数量为对照,其中E、F、G和H的培养液集落数量均显著多于A组,H组培养液中的集落数量较多;在15% KSR组中,以A组培养液集落数量为对照,其中E、F、G和H的培养液集落数量均显著多于A组,H组培养液中的集落数量较多。且含15% KSR培养液中的集落数量均多于含15% FBS培养液中的集落数量(图6)。
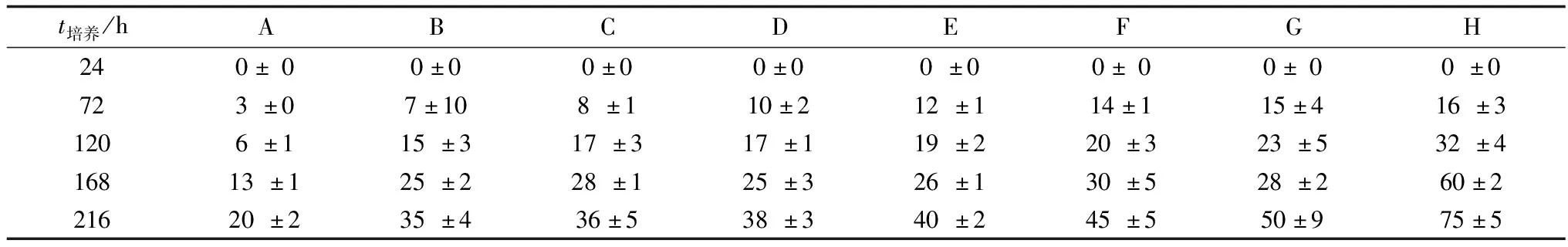
表4 E13.5胎兔PGCs集落个数
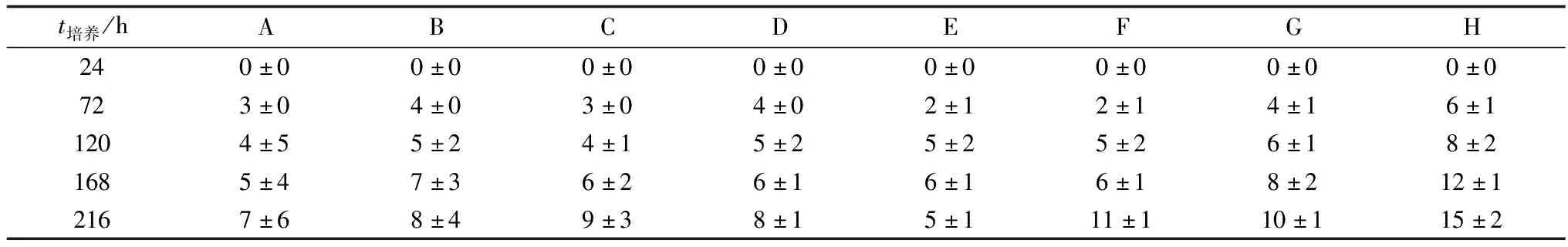
表5 E15.5胎兔PGCs集落个数
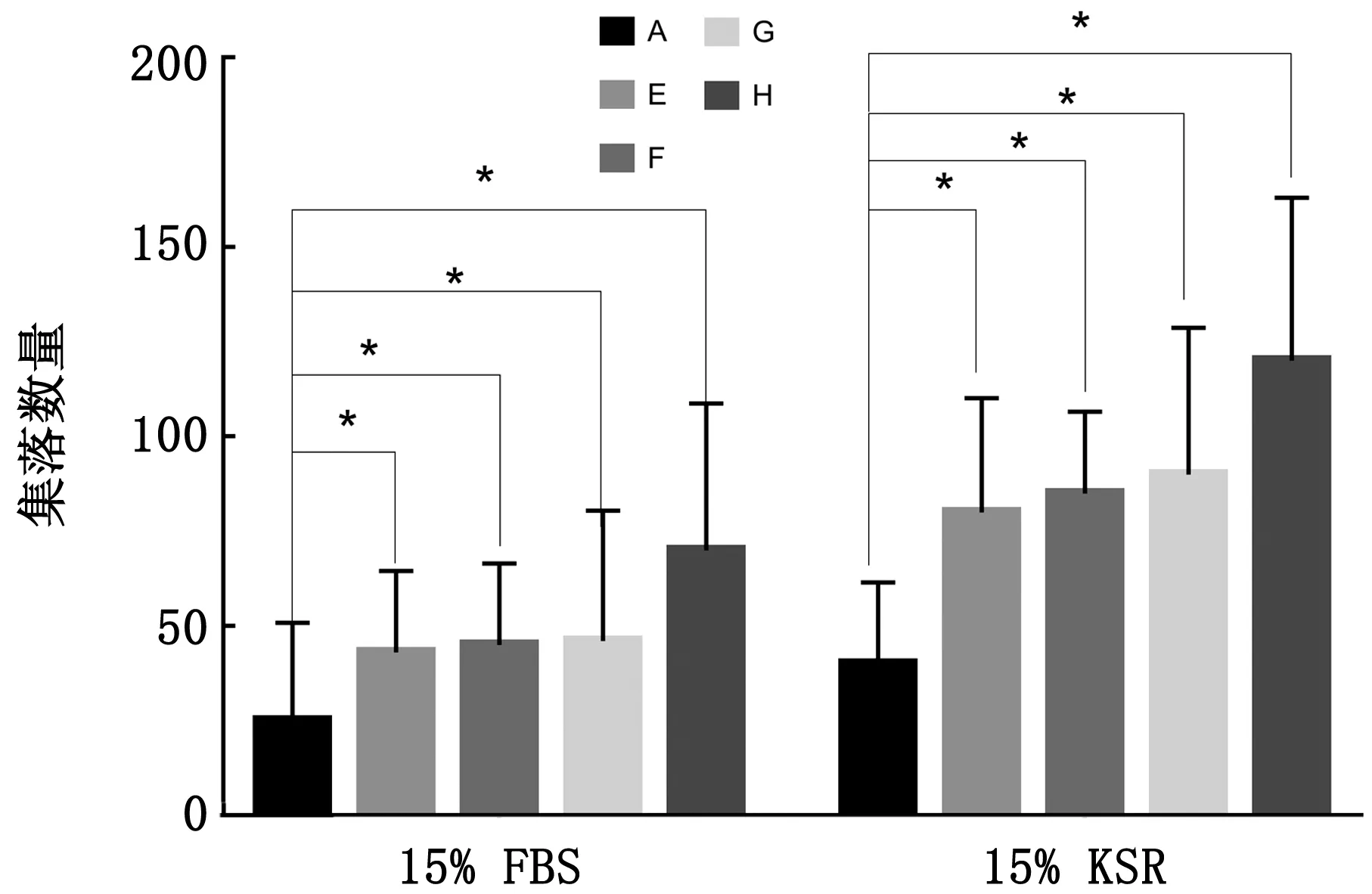
A~F.A~F组培养液
3 讨论
3.1 体外培养过程中PGCs的生物学特性本研究发现PGCs在体外培养过程成中会相互吸附、迁移、聚集成集落状,最后形成EGCs集落。EGCs可以分化为神经样细胞、上皮样细胞和拟胚体。PGCs迁移过程中有空泡状的集落出现,马倩等[3]在研究猪PGCs生物学特性中发现,试验初期原代PGCs有大量“出芽”或“发泡”状的细胞。有学者在研究爪蟾胚胎24期时发现,PGCs会呈现小的泡状结构,随着胚胎的发育,泡状结构也在变大,细胞伸展变得更加细长,此时PGCs的活性很高[4]。也有研究表明,PGCs泡状结构的出现可能与细胞的迁移行为有关,如变形虫等。当变形虫移动时,它的前端会出现一个气泡,推动作用的产生依赖于肌动球蛋白收缩[5]。纤维状肌动蛋白出现在拉伸的爪蟾PGCs的后半段[4]。
3.2 胎龄对PGCs体外培养的影响PGCs特化形成后,开始向生殖嵴的方向迁移,在迁移的过程中PGCs会进行快速、大量增殖,同时PGCs的遗传学和表观遗传学特性也会发生变化,不同胎龄的PGCs的基因表达谱是不一样的[6]。因此,选择合适的胎龄对PGCs的体外培养至关重要。本研究结果显示E10.5和E11.5兔胚胎PGCs体外培养时,重编程为EGCs集落的效率较高,与之前的研究结果一致[7]。胚胎的早期阶段PGCs重编程为EGCs展示出较高的效率,但是PGCs的这种能力随着胎龄的增长会逐渐降低,在E15.5之后,PGCs不能重编程为EGCs[8]。
3.3 RA、FK和4OHT对PGCs体外培养的影响RA作为生殖功能必要调节因子,显著增加PGCs在体外迁移阶段的细胞数量,延缓PGCs在体外衰老[9-10]。RA生物学功能是通过RA受体RARs所介导,主要有RAR的异二聚体和维甲酸X受体(retinoid X receptor,RXR)。FK和RA作为PGCs的“促分裂剂”,可刺激PGCs的体外增殖和延缓衰退。FK可激活蛋白激酶A下游通路从而明显促进鸡PGCs增殖[11]。RA和FK联合使用会增加PGCs集落的形成并有利于长期体外培养[12]。另外在培养液中添加4OHT,可激活PGCs内的AKT反应,激活AKT-MER蛋白,从而上调或下调一些关键基因的表达,促进PGCs重编程为EGCs,如AKT的激活会使BAX基因表达下调,BAX是BCL2基因家族的一个成员,它的生理功能是促进多种细胞凋亡,包括PGCs。AKT的激活可以替代bFGF在PGCs重编程为EGCs中的作用。本试验在培养液中加入RA、FK和4OHT 3种小分子复合物比不加入或只加入其中2种的PGCs集落数量要多。
总之,小分子复合物会启动细胞内信号通路,参与表观遗传修饰和代谢过程,调节细胞的生长、命运和功能。小分子复合物被广泛的用于重编程和转分化领域,可以促进靶细胞向目标细胞转化[13]。小分子复合物具有细胞渗透性和非免疫原性[14-16],此外,它们价格低廉、易于合成和保存。
3.4 FBS和KSR对PGCs体外培养的影响血清中含有已知的和未知的动物源性病原体[17],这可能会导致人类胚胎干细胞(human embryonic stem cells,hESCs)的异物污染,从而阻碍干细胞的临床应用[18]。因此许多研究者尝试建立新的培养系统或优化现有培养系统以减少干细胞的污染[17]。本研究结果证明,无血清培养体系更有利于PGCs集落的形成,更有利于体外重编程为EGCs。
