猪囊孢球虫和毕氏肠微孢子虫双重巢式PCR检测方法的建立
2021-04-12王朋林陈凯丽刘林科王荣军张龙现宁长申菅复春河南农业大学牧医工程学院河南郑州450046
王朋林,陈凯丽,郑 玲,刘林科,王荣军,张龙现,宁长申,菅复春 (河南农业大学 牧医工程学院,河南 郑州 450046)
猪囊孢球虫(Cystoisosporasuis)原名猪等孢球虫(Isosporasuis),归类于真球虫目(Eucoccidiorida)、肉孢子球虫科(Sarcosporidae)、囊等孢球虫属(Cystoisospora)。猪囊孢球虫可感染不同品种和不同年龄阶段的猪,尤其对哺乳仔猪的危害最为严重,临床症状可表现为非出血性腹泻[1],治疗不当会导致僵猪或死亡,严重影响我国养猪业的发展。毕氏肠微孢子虫(Enterocytozoonbieneusi)是一种可感染人和多种动物胃肠道的人兽共患病原。1985年首次在艾滋病(HIV)患者中发现[2]。一般情况下,感染此病原后免疫功能正常的机体无明显的临床症状,但对HIV患者和免疫功能低下的儿童会造成持续性腹泻并伴有发热、食欲下降和体质量减轻等症状[3]。此外,毕氏肠微孢子虫感染宿主广泛,如非人灵长类动物(NHP)、反刍动物、哺乳动物、啮齿动物等,并对它们的胃肠道造成严重损伤,因此引起世界各国研究者的高度关注[4]。近年来,随着分子生物学技术的快速发展,具有简便、快速、准确等优点的PCR检测技术已被广泛应用于各种肠道原虫的分子流行病学调查[5-7]。目前尚无关于猪囊孢球虫和毕氏肠微孢子虫的双重nest-PCR方法,本研究旨在建立一种快速、准确、简便、可同时诊断猪囊孢球虫和毕氏肠微孢子虫的双重nest-PCR方法,以期能快速鉴定两种病原,为猪肠道原虫病的防控提供技术支持。
1 材料与方法
1.1 病原猪囊孢球虫、毕氏肠微孢子虫、安氏隐孢子虫、十二指肠贾第虫、芽囊原虫均由本实验室分离鉴定;大肠杆菌菌株由本院微生物学实验室馈赠。
1.2 试剂KOD plus DNA聚合酶、TAE缓冲液、琼脂糖、双蒸水、DL2000 DNA Marker购自TaKaRa有限公司;E.Z.N.A.®D4015-02粪便全基因组DNA提取试剂盒购自OMEGA有限公司。
1.3 引物合成使用DNAStar等工具对2对nest-PCR引物兼容性进行检测,避免各组引物间形成二聚体。2对引物均由上海生物工程公司合成。

表1 双重nest-PCR引物序列及扩增产物大小
1.4 DNA 模板的制备取待检猪的阳性粪便20~50 g,置灭菌烧杯充分搅匀,称取搅拌后的粪便样本180~220 mg至1.5 mL离心管中,按E.Z.N.A.®D4015-02粪便全基因组DNA提取试剂盒提取说明书提取模板DNA。
1.5 双重nest-PCR反应条件的优化在猪囊孢球虫和毕氏肠微孢子虫单病原检测nest-PCR检测方法稳定反应的基础上,将猪囊孢球虫和毕氏肠微孢子虫的DNA等量混匀物作为模板,对双重nest-PCR中的引物比、Buffer、dNTPs、酶、Tm值、循环数等各项反应条件进行优化,筛选双重nest-PCR扩增的最佳反应体系和条件。
1.6 特异性试验将分别用传统镜检及nest-PCR鉴定后确定的猪囊孢球虫与毕氏肠微孢子虫混合物、猪囊孢球虫、毕氏肠微孢子虫、安氏隐孢子虫、十二指肠贾第虫、芽囊原虫和大肠杆菌等DNA为模板,进行PCR扩增,PCR反应结束后取5 μL产物用于1 %琼脂糖凝胶电泳分析。
1.7 敏感性试验使用Nano Drop 2000超微量分光光度计分别测量猪囊孢球虫和毕氏肠微孢子虫质粒标准品的浓度,并进行PCR扩增。猪囊孢球虫质粒标准品的原始质量浓度为209 mg/L(D260/D280=1.86),毕氏肠微孢子虫质粒标准品的原始质量浓度为527 mg/L(D260/D280=1.84),D260/D280=1.80~2.00时,证明核酸纯度较好。分别将两种病原的质粒标准品进行10倍倍比稀释(猪囊孢球虫:209~209×10-8mg/L;毕氏肠微孢子虫:527~527×10-8mg/L)后作为模板,进行猪囊孢球虫和毕氏肠微孢子虫双重nest-PCR方法的敏感性试验。
1.8 重复性试验使用建立的双重nest-PCR方法随机选择3个混合感染猪囊孢球虫和毕氏肠微孢子虫DNA样品进行重复性检测,以保证该方法对猪囊孢球虫和毕氏肠微孢子虫检测的稳定性与可行性。
1.9 临床样品的检测用本试验建立的双重nest-PCR方法对采自河南信阳的48份猪粪便DNA样品进行PCR检测,并与猪囊孢球虫和毕氏肠微孢子虫的单病原nest-PCR方法进行比较。检测结果通过双向测序,对基因序列进行比对分析以排除假阳性。
2 结果
2.1 双重nest-PCR引物比优化结果将毕氏肠微孢子虫和猪囊孢球虫引物比分别按照1.00∶0.25、1.00∶0.50、1.00∶0.75、1.00∶1.00进行扩增。结果显示毕氏肠微孢子虫和猪囊孢球虫的引物量的比为1.0∶0.25时有稳定双条带出现。图1为3个不同的毕氏肠微孢子虫和猪囊孢球虫DNA混合物在两者引物量比为1.00∶0.25时的扩增结果。
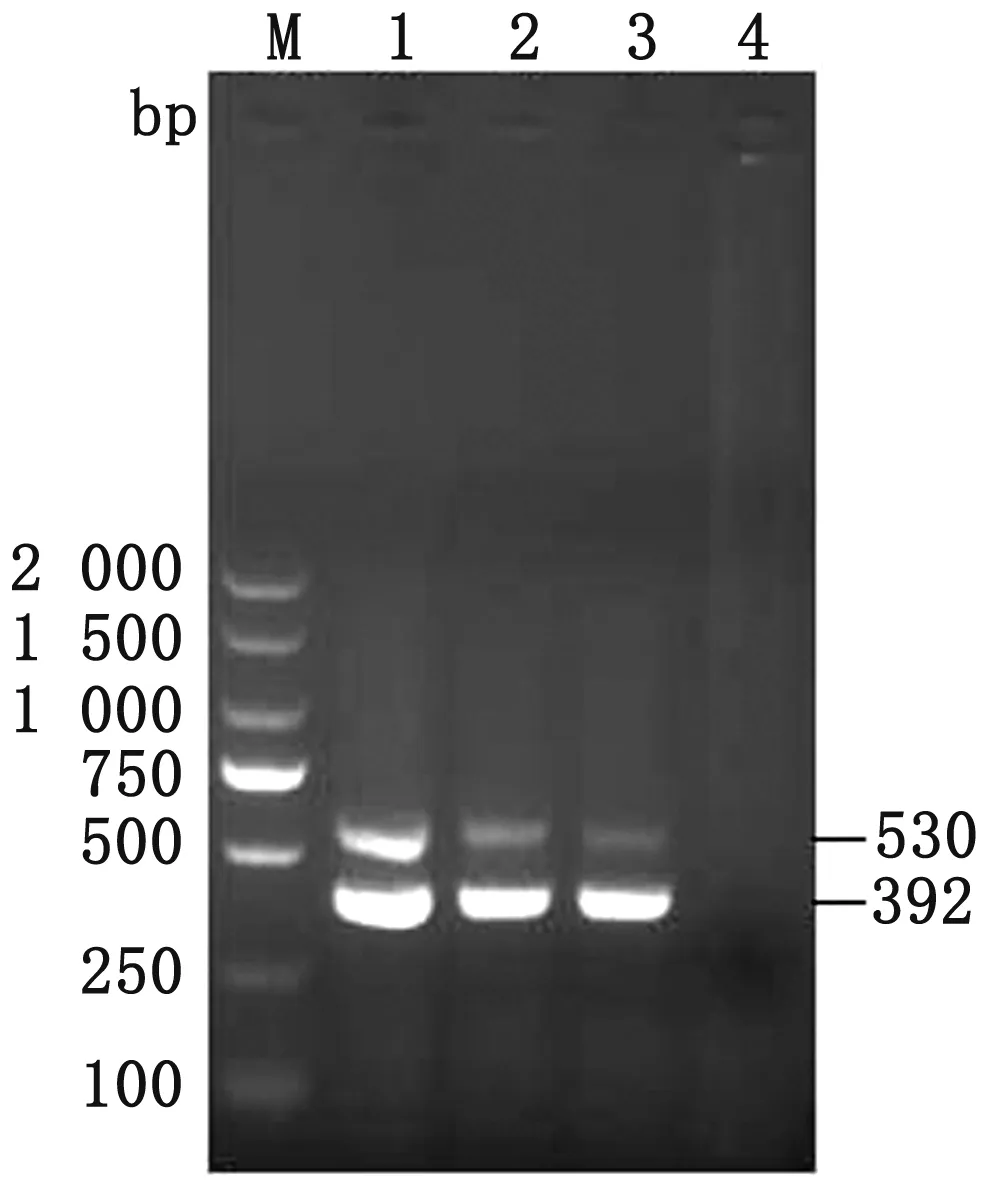
M.DL2000 DNA Marker;1~3.毕氏肠微孢子虫和猪囊孢球虫DNA混合物;4.阴性对照
2.2 双重nest-PCR退火温度优化结果结果显示,双重nest-PCR在50~60℃范围内扩增效率变化不大,由于猪囊孢球虫和毕氏肠微孢子虫单重nest-PCR 2次扩增的退火温度分别为57和55℃,因此本试验选择将第1轮、第2轮退火温度分别确定为57、55℃(图2、3)。

M.DL2000 DNA Marker;1~9.分别为60.0、59.2、58.0、57.0、56.1、53.8、51.9、50.7、50.0℃;10.阴性对照
2.3 双重nest-PCR特异性试验结果琼脂糖凝胶电泳结果显示,猪囊孢球虫和毕氏肠微孢子虫混合物、猪囊孢球虫、毕氏肠微孢子虫均扩增出相应的特异性条带,而安氏隐孢子虫、十二指肠贾第虫、芽囊原虫、大肠杆菌均未扩增出特征性条带,证明本试验特异性良好(图4)。

M.DL2000 DNA Marker;1~7.微孢子虫+猪囊孢球虫、猪囊孢球虫、微孢子虫、安氏隐孢子虫、十二指肠贾第虫、芽囊原虫、E.coli;8.阴性对照
2.4 双重nest-PCR敏感性试验结果按照已优化的反应条件及体系进行双重nest-PCR敏感性试验,DNA模板与猪囊孢球虫、毕氏肠微孢子虫单病原nest-PCR试验相同。结果显示,猪囊孢球虫的最低检测限为209×10-5mg/L,毕氏肠微孢子虫的最低检测限为527×10-7mg/L(图5)。
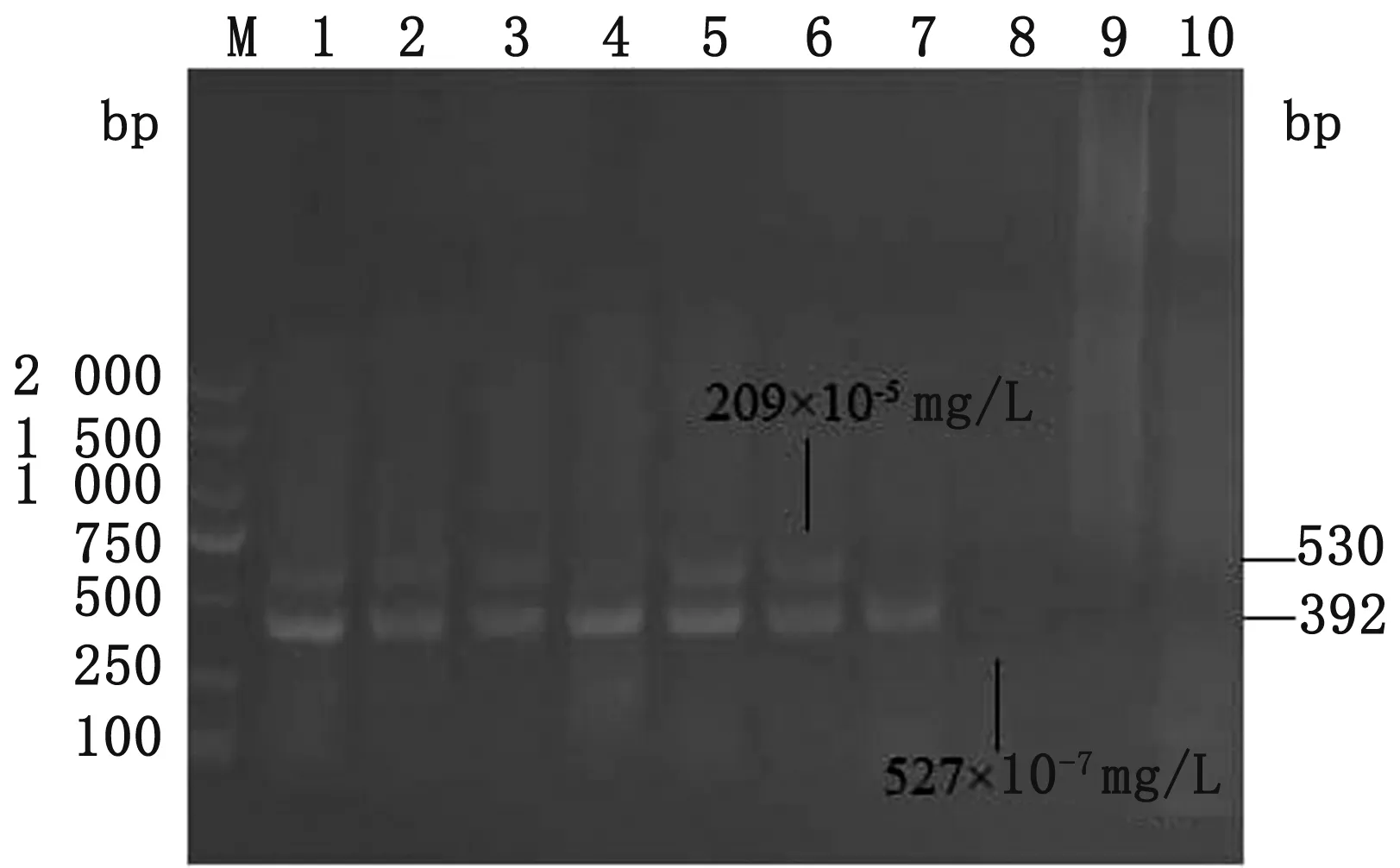
M.DL2000 DNA Marker;1~9.分别为2种病原质粒10倍倍比稀释100、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8;10.阴性对照;6.209×10-5 μg/L;8.527×10-7 μg/L
2.5 双重nest-PCR重复性试验结果用建立的双重nest-PCR方法随机选择3个猪囊孢球虫和毕氏肠微孢子虫的阳性DNA样品进行重复性检测,结果显示,双重nest-PCR方法检测猪囊孢球虫和毕氏肠微孢子虫具有良好的重复性和稳定性(图6)。
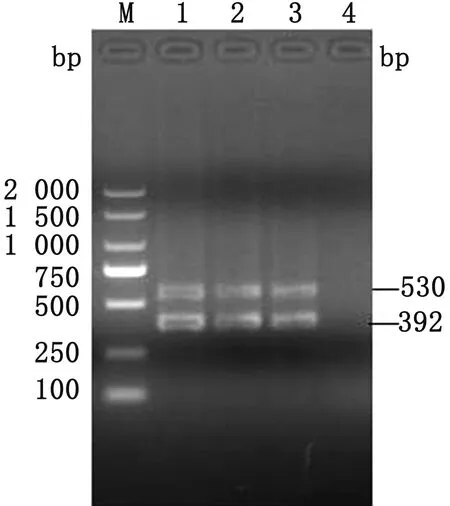
M.DL2000 DNA Marker;1~3.样品;4.阴性对照
2.6 双重nest-PCR临床样品检测用本试验建立的猪囊孢球虫和毕氏肠微孢子虫双重nest-PCR方法对采自信阳的48份猪粪便DNA样品进行PCR扩增,单病原nest-PCR扩增猪囊孢球虫和毕氏肠微孢子虫感染阳性率分别为12.50%(6/48)和22.92%(11/48),混合感染阳性率为4.17%(2/48);双重nest-PCR猪囊孢球虫和毕氏肠微孢子虫感染阳性率分别为20.83%(10/48)和8.33%(4/48),混合感染阳性率为4.17%(2/48);单重nest-PCR和双重nest-PCR检测结果无统计学差异(P>0.05)。表明建立的双重nest-PCR可用于临床检测。
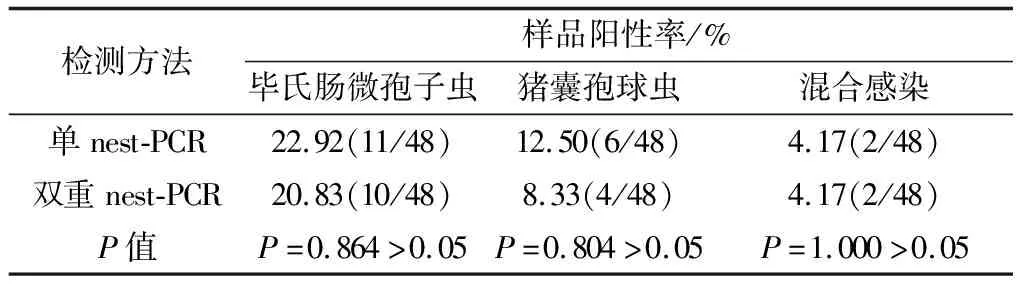
表2 单重nest-PCR和双重nest-PCR对猪临床粪便样品检测结果比较
3 讨论
多重nest-PCR反应是在同一反应体系中,同时加入多个特异性引物进行扩增,但多对引物之间的配比、相互竞争及抑制等均会影响多重nest-PCR的扩增结果[8],因此,筛选合适的引物并调整最佳引物配比,是保证试验顺利进行的基本要素。此外,合适的多重nest-PCR引物不但要求能特异和敏感地扩增出目的条带,各引物间还要有相近的退火温度和循环数。本试验所选择的2对引物,其GC%含量和Tm值相近,为猪囊孢球虫和毕氏肠微孢子虫均能得到良好的扩增以及双重nest-PCR方法的建立奠定了基础。本试验初期进行双重nest-PCR反应时,将猪囊孢球虫和毕氏肠微孢子虫引物按等量加入,同时扩增两个特异性基因时,猪囊孢球虫的扩增效率高于毕氏肠微孢子虫的扩增效率。因此,可通过调整加入的引物量比来实现使各引物的扩增效率相近的产物[9]。
猪囊孢球虫单病原nest-PCR的敏感度为209×10-6mg/L,敏感性比双重nest-PCR高10倍;毕氏肠微孢子虫单病原nest-PCR最低检测限限为527×10-9mg/L,与双重nest-PCR敏感性相比高100倍,这与彭武丽等[10]报道的单PCR敏感性高于多重PCR敏感性一致,但处于可接受水平。造成此敏感性差异的原因众多,比如引物之间的互作和反应参数的差异等。本研究同时使用单nest-PCR方法和建立的双重nest-PCR方法对采自信阳的48份粪便DNA样品进行检测。结果表明,单nest-PCR的检出率略高于双重nest-PCR,经统计学分析,单nest-PCR和双重nest-PCR检测结果差异并不显著(P>0.05)。这一结论与MORIO等[11]对首个商业化检测粪样中的隐孢子虫、肠毕氏微孢子虫和肠脑炎微孢子虫多重PCR试剂盒的评估结果相一致。究其原因可能是因为双重nest-PCR中同时加入了两种肠道病原引物,增加了干扰因素,在一定程度上降低了目的基因片段的扩增效率,但误差仍处于可接受范围内。双重nest-PCR方法与单重nest-PCR方法相比,只做1次nest-PCR扩增就可同时检测出2种病原,大大节省试验时间、精力和试剂消耗,显著提高检测效率。综上所述,本研究所构建的双重nest-PCR方法具有良好的敏感性、特异性,可用于临床样品的检测。
