富血小板血浆在兔外伤性视神经损伤中的修复作用及其机制
2021-04-10李琳玲邢怡桥
李琳玲 邢怡桥
武汉大学人民医院眼科 430061
李琳玲现在深圳市妇幼保健院 518000
外伤性视神经病变(traumatic optic neuropathies,TON)是由于外伤直接或间接导致的视神经损伤,是颅脑损伤后视力永久性丧失的主要原因之一[1]。寻求视神经损伤后视神经和视网膜修复再生的方法、探索改善视神经功能的治疗策略是眼科研究的热点[2]。富血小板血浆(platelet-rich plasma,PRP)是全血经过离心分离而得到的血液制品,含有多种生长因子,如血小板衍生生长因子、表皮生长因子、胰岛素样生长因子-1、血管内皮生长因子等,在肌肉和骨骼等多种组织的损伤修复和再生过程中起重要作用[3]。此外,PRP可作为组织工程应用的自体来源,作为骨髓干细胞颅内给药的支架,可显著改善诱导性脑出血实验动物的神经功能[4]。随着PRP在临床的应用越来越广泛,也有研究发现PRP可改善接受体外人工受孕治疗患者的子宫内膜厚度,从而实现对子宫内膜生长不良导致不孕症的治疗[5]。然而,PRP对视神经损伤修复作用的研究较少。目前常用的视神经损伤动物模型主要有视神经横断伤、视神经撞击伤、视神经牵拉伤、视神经挤压伤、视神经钳夹伤等动物模型。视神经横断伤动物模型可造成所有视网膜神经节细胞(retinal ganglion cells,RGCs)轴突完全切断[6]。视神经撞击伤动物模型接近临床的间接视神经损伤,但是致伤设备复杂、操作繁琐、对实验动物创伤较大,死亡率高[7]。视神经牵拉伤动物模型致伤装置复杂、手术步骤较多且操作难度较大[8]。视神经挤压伤动物模型手术操作简单,但难以保证造成损伤程度均一[9]。视神经钳夹伤模型是目前实验研究中应用最广泛的方法,具有设计简单、易于操作、创伤性小、造模成功率高,且能够保证视神经髓鞘的完整性等特点[10-11]。本研究观察兔视神经钳夹伤模型中视网膜和视神经受损情况,并探索PRP对视神经损伤的修复作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 清洁级新西兰白兔52只,购于湖北省疾病预防控制中心,体质量2.3~2.5 kg,雌雄不限,饲养于武汉大学中南医院动物实验中心。兔自由摄食饮水,全价兔颗粒饲料喂养。实验动物的使用和喂养遵循美国视觉与眼科学研究协会制定的科研动物使用规范。本实验方案经武汉大学动物实验伦理委员会批准(批文号:E2019072805)。
1.1.2主要试剂及仪器 B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)抗体(12789-1-AP,武汉三鹰生物技术有限公司);caspase-3抗体(ab4051,英国Abcam公司);TRIpure总RNA提取试剂盒、M-MLV逆转录试剂盒、EnTurboTMSYBR Green PCR扩增试剂盒(武汉科鹿生物技术有限公司);鼠抗兔脑源性神经生长因子(brain-derived neurotrophic factor,BDNF)抗体(bs-0248R,北京博奥森生物技术有限公司);鼠抗兔生长相关蛋白43(growth associated protein-43,Gap-43)抗体(A6376,武汉爱博泰克生物科技有限公司);山羊抗兔IgG抗体(AS-1107)、山羊抗鼠IgG抗体(AS-1106)(美国Aspen公司)。倒置显微镜(德国Olympus公司);StepOneTMReal-Time PCR仪(美国Life生物科技公司);Nanodrop紫外分光光度计(美国Thermo公司)。
1.2 方法
1.2.1兔视神经钳夹伤模型制备 取40只实验兔以质量分数1%戊巴比妥钠沿耳缘静脉按0.3 ml/100 g剂量注射麻醉,沿右眼球后向深部分离视神经约5 mm,避免损伤邻近血管,于球后3 mm处用同一显微血管夹夹持视神经30 s。观察术眼瞳孔散大且无视网膜出血,逐层缝合后于上眼睑及结膜囊内涂左氧氟沙星眼膏。待实验兔麻醉苏醒,观察瞳孔散大、直接对光反应消失、术眼角膜透明、玻璃体腔无积血、视网膜无出血或剥脱、眼压正常、无眼球突出或眼睑闭合不全者判定为造模成功并纳入实验。
1.2.2PRP的制备 以注射器沿兔耳中央动脉取血,1次约10 ml,置于无菌离心管内,离心半径10 cm,2 000 r/min离心10 min;获得上层血浆层、血小板层和下层红细胞层,抽提去除下层红细胞后摇匀,置于离心机内,2 200 r/min离心10 min;去除上层血浆层,获得兔自体PRP,于-80 ℃冰箱保存备用。
1.2.3实验分组 实验兔因麻醉意外死亡4只,将造模成功的36只实验兔按照随机数表法随机分为模型对照组、生理盐水组和PRP组,每组12只。PRP组和生理盐水组术眼造模后每隔1 d于球后近视神经损伤处分别注射PRP和生理盐水各20 μl,共注射10次。模型对照组除常规抗感染外不做特殊处理。另取12只正常新西兰大白兔作为正常对照组,不做造模和PRP注射处理。
1.2.4实验兔视网膜及视神经常规组织病理学检查 于造模后30 d、60 d各组任意选取3只实验兔耳缘静脉注射过量1%戊巴比妥钠(100 mg/kg)处死,摘取动物右侧眼球及球后视神经,将视网膜和视神经分段,于眼球12:00方向及视神经近钳夹处缝线标记,置于-80 ℃冰箱保存。取眼球和钳夹处远侧视神经组织置于质量分数4%多聚甲醛中固定24~72 h,制作石蜡切片,分别沿视网膜经视神经处12:00方向矢状切片及视神经钳夹处远端垂直于视神经长轴方向切片,切片厚度为4 μm,采用苏木精-伊红法进行染色,倒置显微镜下观察并摄像,任意选择3个200倍视野下区域计数RGCs,测定视网膜神经纤维层(retinal nerve fiber layer,RNFL)厚度。
1.2.5甲苯胺蓝染色及免疫组织化学染色法测定视神经内轴突和视网膜组织细胞凋亡情况 取造模后30 d、60 d正常对照组、模型对照组和PRP组的视神经组织石蜡切片,采用甲苯胺蓝染色,倒置显微镜下观察视神经内轴突瓦解及修复情况并摄像。取模型对照组和PRP组视网膜组织石蜡切片滴加Bcl-2(1∶ 300)或caspase-3(1∶ 100)一抗,4 ℃条件下孵育过夜,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤,滴加山羊抗兔二抗(1∶ 200),于室温下静置15 min,用PBS洗涤后,进行3,3’-二氨基联苯胺(3,3’-diaminobenzidine,DAB)染色,然后用水冲洗,苏木素复染。使用Image Pro plus软件测定各组阳性染色区的吸光度(A)值。计算单位面积平均A值=阳性染色积分A值/总目标组织面积A值。
1.2.6实时荧光定量PCR法检测视神经和视网膜中BDNF和Gap-43 mRNA表达 造模后30 d和60 d各组分别处死3只大鼠,迅速取出实验兔眼球,分离视网膜,立即置于液氮中冻存,提取视网膜总RNA,采用Nanodrop紫外分光光度计测定总RNA含量及纯度;将mRNA逆转录成cDNA,使用PCR扩增试剂盒进行PCR扩增,每个样本设置3个复孔。反应体系为2倍Master Mix 5.0 μl、引物(2.5 μmol/L)1.0 μl、cDNA模板1.0 μl、双蒸馏水2.0 μl和Rox参比染料1.0 μl,各基因引物序列见表1。反应条件:95 ℃预变性1 min;95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸45 s,共40个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照,采用2-△△CT法分别计算视网膜中BDNF和Gap-43 mRNA相对表达量。
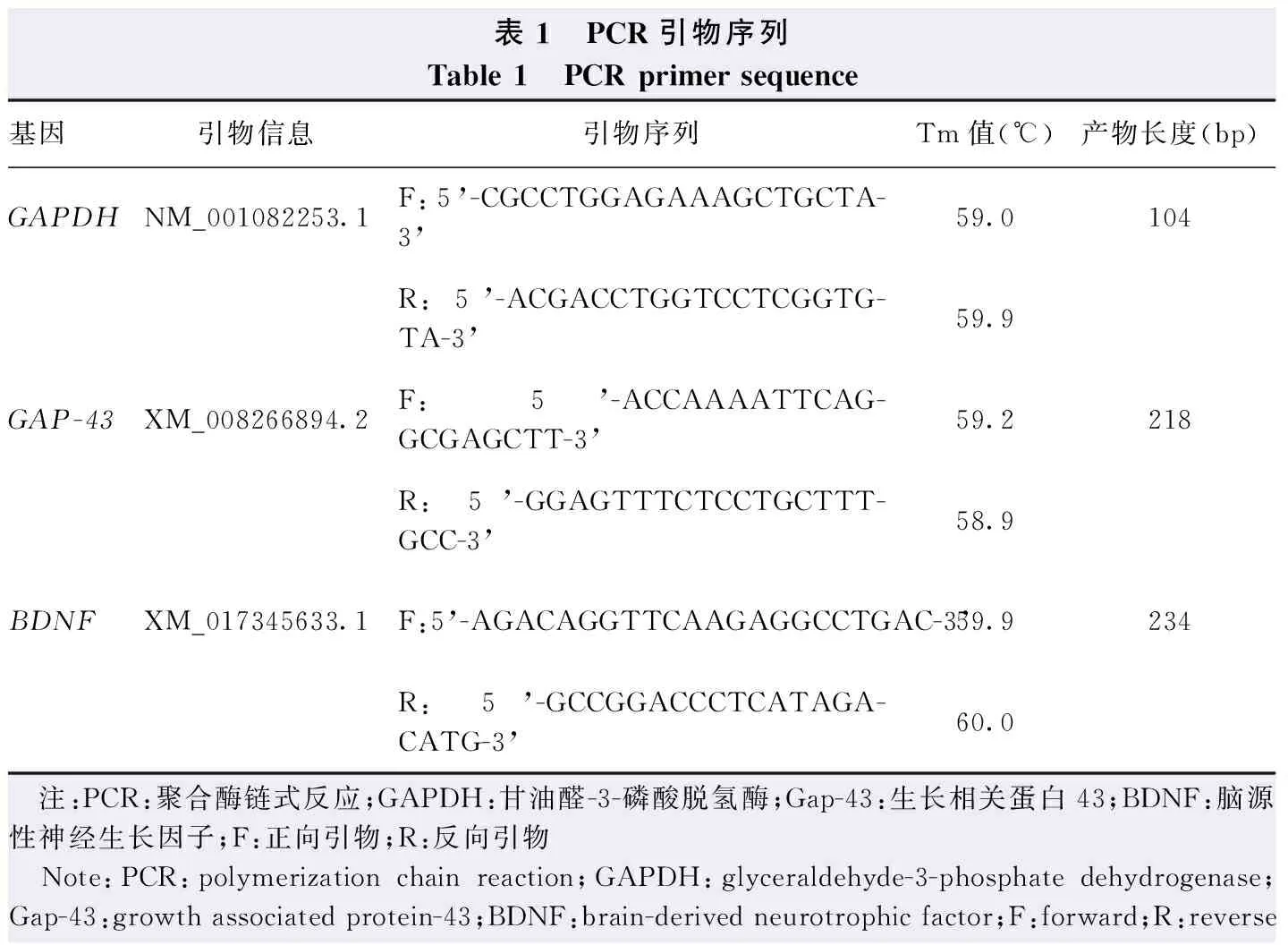
表1 PCR引物序列Table 1 PCR primer sequence基因引物信息引物序列Tm值(℃)产物长度(bp)GAPDHNM_001082253.1F:5’-CGCCTGGAGAAAGCTGCTA-3’59.0104R:5’-ACGACCTGGTCCTCGGTG-TA-3’59.9GAP-43XM_008266894.2F:5’-ACCAAAATTCAG-GCGAGCTT-3’59.2218R:5’-GGAGTTTCTCCTGCTTT-GCC-3’58.9BDNFXM_017345633.1F:5’-AGACAGGTTCAAGAGGCCTGAC-3’59.9234R:5’-GCCGGACCCTCATAGA-CATG-3’60.0 注:PCR:聚合酶链式反应;GAPDH:甘油醛-3-磷酸脱氢酶;Gap-43:生长相关蛋白43;BDNF:脑源性神经生长因子;F:正向引物;R:反向引物 Note:PCR:polymerization chain reaction;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;Gap-43:growth associated protein-43;BDNF:brain-derived neurotrophic factor;F:forward;R:reverse
1.2.7Western blot法检测实验兔视网膜和视神经中BDNF和Gap-43蛋白表达 取各组兔实验眼视网膜和钳夹处远侧的视神经,预冷的PBS漂洗,加入10倍体积的含蛋白酶抑制剂的组织蛋白提取试剂,冰浴下彻底匀浆,4 ℃条件下13 000×g离心5 min,收集上清,即为总蛋白溶液。采用BCA法测定样品蛋白浓度。聚丙烯酰胺凝胶电泳分离蛋白,上样后按浓缩胶80 V、分离胶120 V进行恒压电泳,按300 mA恒流转膜至PVDF膜,加入封闭液37 ℃封闭1 h,分别滴加鼠抗兔BDNF一抗(1∶ 500)和鼠抗兔Gap-43一抗(1∶ 500)。TBST洗膜3次,每次5 min,滴加山羊抗鼠IgG二抗(1∶ 10 000),37℃摇床孵育0.5 h,TBST洗膜4次,每次5 min。ECL显色,暗室中曝光,将胶片扫描,AlphaEaseFC软件处理系统分析目标条带的灰度值。以GAPDH为内参,计算各目的蛋白相对表达量。
1.3 统计学方法
采用Graphpad Prism 6软件进行统计分析,计量资料采用Shapiro-Wilk检验证实符合正态分布,以mean±SD进行表达。采用随机分组单因素干预多水平研究设计,正常对照组、模型对照组、生理盐水组和PRP组造模后不同时间点各检测指标的总体差异比较采用两因素方差分析,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组实验兔视神经大体观及甲苯胺蓝染色
模型对照组视神经直径均较正常对照组变细,钳夹处视神经明显凹陷,且模型对照组造模后60 d视神经萎缩程度较造模后30 d更严重(图1)。PRP组造模后60 d视神经直径较造模后30 d有所恢复,钳夹夹痕逐渐消失。甲苯胺蓝染色结果显示,造模后30 d,模型对照组兔视神经轴突丢失,大多数轴突瓦解,未见正常轴突,PRP组兔视神经仅中央部分有部分轴突水肿,纤维膜稍增厚,周边可见排列紧密的正常轴突;造模后60 d,模型对照组兔视神经内散在分布蓝色染料,视神经轴突丢失更为明显,多数轴突瓦解,仅剩部分残留的小轴突,纤维膜增厚明显,轴突束直径变小,PRP组视神经中央水肿程度逐渐减轻,组织排列更为紧密(图2)。
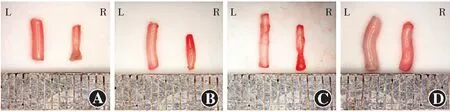
图1 各组实验兔不同时间点视神经外观变化 A:造模后30 d正常对照组(L)和模型对照组(R)视神经外观 B:造模后30 d正常对照组(L)和PRP组(R)视神经外观 C:造模后60 d正常对照组(L)和模型对照组(R)视神经外观 D:造模后60 d正常对照组(L)和PRP组(R)视神经外观Figure 1 Appearance changes of optical nerve in different groups at different time points A:The optic nerve in normal control group (L) and model control group (R) at 30 days after modeling B:The optic nerve in normal control group (L) and PRP group (R) at 30 days after modeling C:The optic nerve in normal control group (L) and model control group (R) at 60 days after modeling D:The optic nerve in normal control group (L) and PRP group (R) at 60 days after modeling
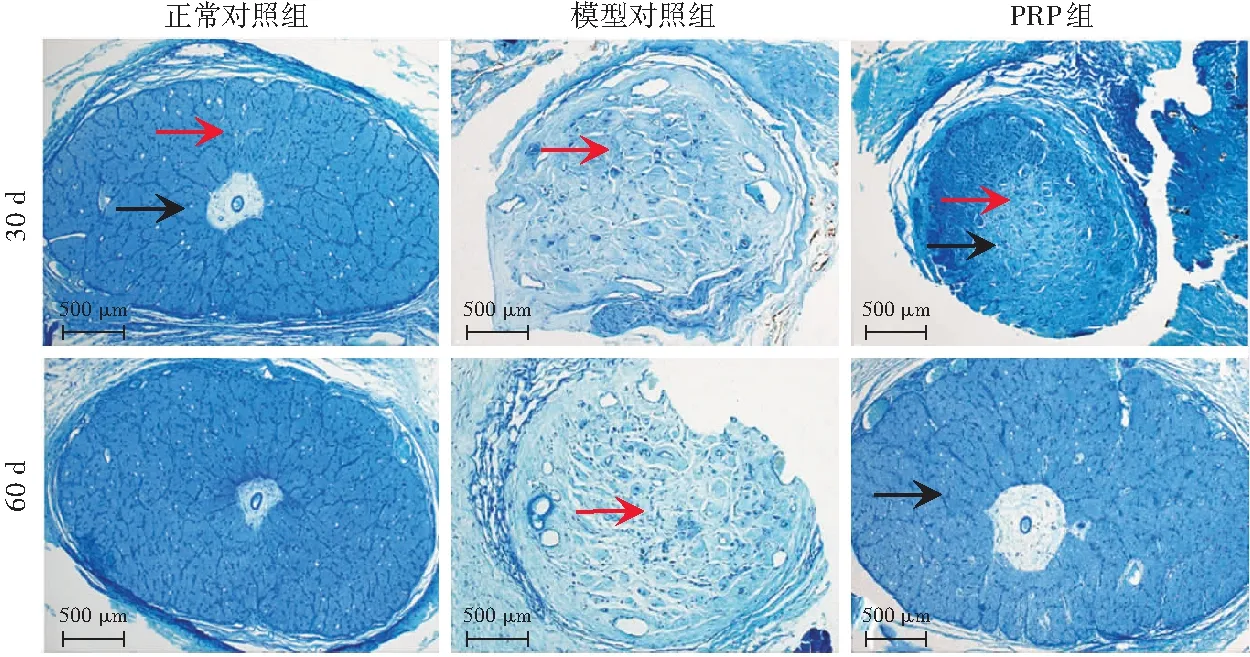
图2 正常对照组、模型对照组和PRP组兔眼视神经组织学变化(甲苯胺蓝染色 ×400,标尺=500 μm) 正常对照组可见轴突束由纤维膜包绕,排列均匀;造模后30 d和60 d,模型对照组兔视神经轴突丢失,大多数轴突瓦解,未见正常轴突,PRP组兔视神经仅中央有部分轴突水肿,纤维膜稍增厚,周边可见排列紧密的正常轴突 黑色箭头示轴突束,红色箭头示纤维膜 PRP:富血小板血浆Figure 2 Histological changes of optic nerve in the normal control group,model control group and PRP group (Toluidine blue ×400,bar=500 μm) In the normal control group,axon bundles surrounded by fibrous membrane and evenly arranged were observed.At 30 and 60 days after modeling,the axons of the optic nerve in the model control group were lost,and most axons disintegrated and no normal axon was observed.Only part of the axons in the central part of the optic nerve were edematous,and the fibrous membrane was slightly thickened,and normal axons were closely arranged around in the PRP group Black arrows indicated axon bundles,and red arrows indicated fibrous membrane PRP:platelet-rich plasma
2.2 各组实验兔视网膜组织病理学变化
造模后30 d,正常对照组视网膜可见清晰的3层细胞层结构,RGCs层呈现单层、整齐且排列密集,细胞核数目清楚,相对较少,可见光滑完整且无褶皱核膜,细胞核内染色质均匀。模型对照组视网膜组织结构紊乱,RGCs形态异常,感光细胞层及双极细胞层细胞数目均明显减少,各细胞层厚度变薄。PRP组视网膜各层细胞数较模型对照组增多,但仍少于正常对照组,细胞排列较模型对照组整齐(图3)。
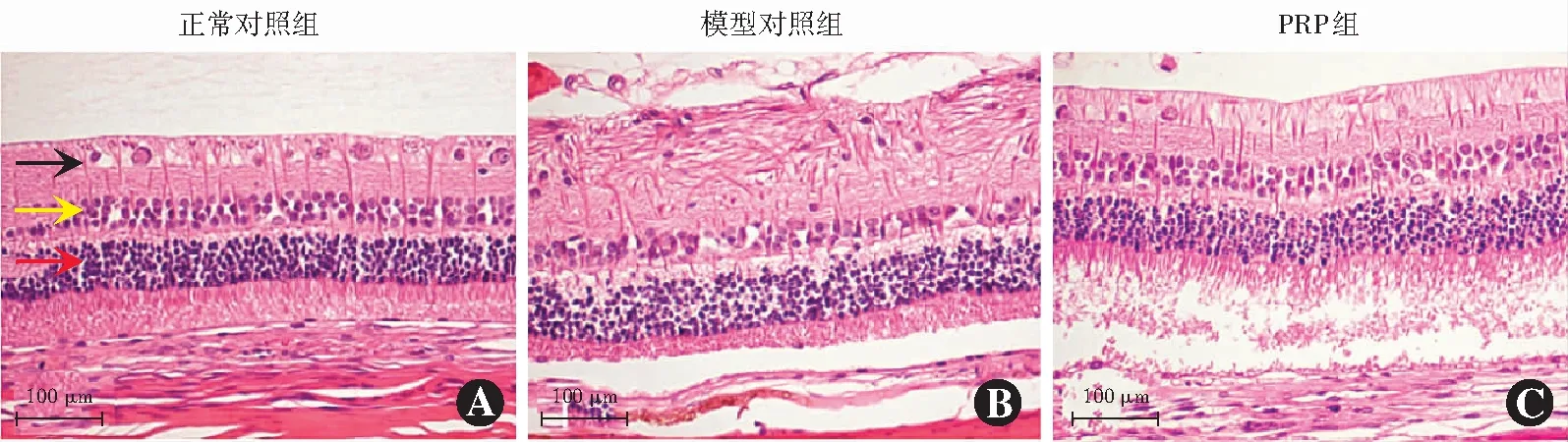
图3 正常对照组、模型对照组和PRP组造模后30 d视网膜组织形态(HE ×200,标尺=100 μm) A:正常对照组视网膜组织形态 视网膜各层排列规则,可见感光细胞层(红色箭头)、双极细胞层(黄色箭头)和RGCs层(黑色箭头) B:模型对照组视网膜组织形态 可见视网膜组织结构紊乱,RGCs形态异常,感光细胞层及双极细胞层细胞数目均明显减少 C:PRP组兔视网膜组织形态 可见细胞排列较模型对照组整齐,各层细胞数较模型对照组增多 PRP:富血小板血浆Figure 3 Retinal tissue morphology in the normal control group,model control group and PRP group (HE ×200,bar=100 μm) A:The morphology of retinal tissue in the normal control group Layers of the retina were arranged regularly,and the photoreceptor cell layer (red arrow),bipolar cell layer (yellow arrow) and RGCs layer (black arrow) were visible B:The morphology of retinal tissue in the model control group Layers of the retina were disordered,and the RGCs layer was abnormal,and the cells number of photoreceptor cell layer and bipolar cell layer were decreased C:The morphology of retinal tissue in the PRP group The cells arrangement was more regular and the cells number of different layers were more than those of the model control group PRP:platelet-rich plasma
2.3 各组造模后不同时间点RGCs数量和RNFL厚度变化
各组造模后不同时间点RGCs数量总体比较,差异均有统计学意义(F分组=80.33,P<0.001;F时间=2.64,P<0.001);造模后30 d和60 d,PRP组RGCs数量均较生理盐水组和模型对照组明显增多,差异均有统计学意义(均P<0.01),PRP组造模后60 d RGCs数量较造模后30 d明显增多,差异有统计学意义(P<0.05)(表2)。
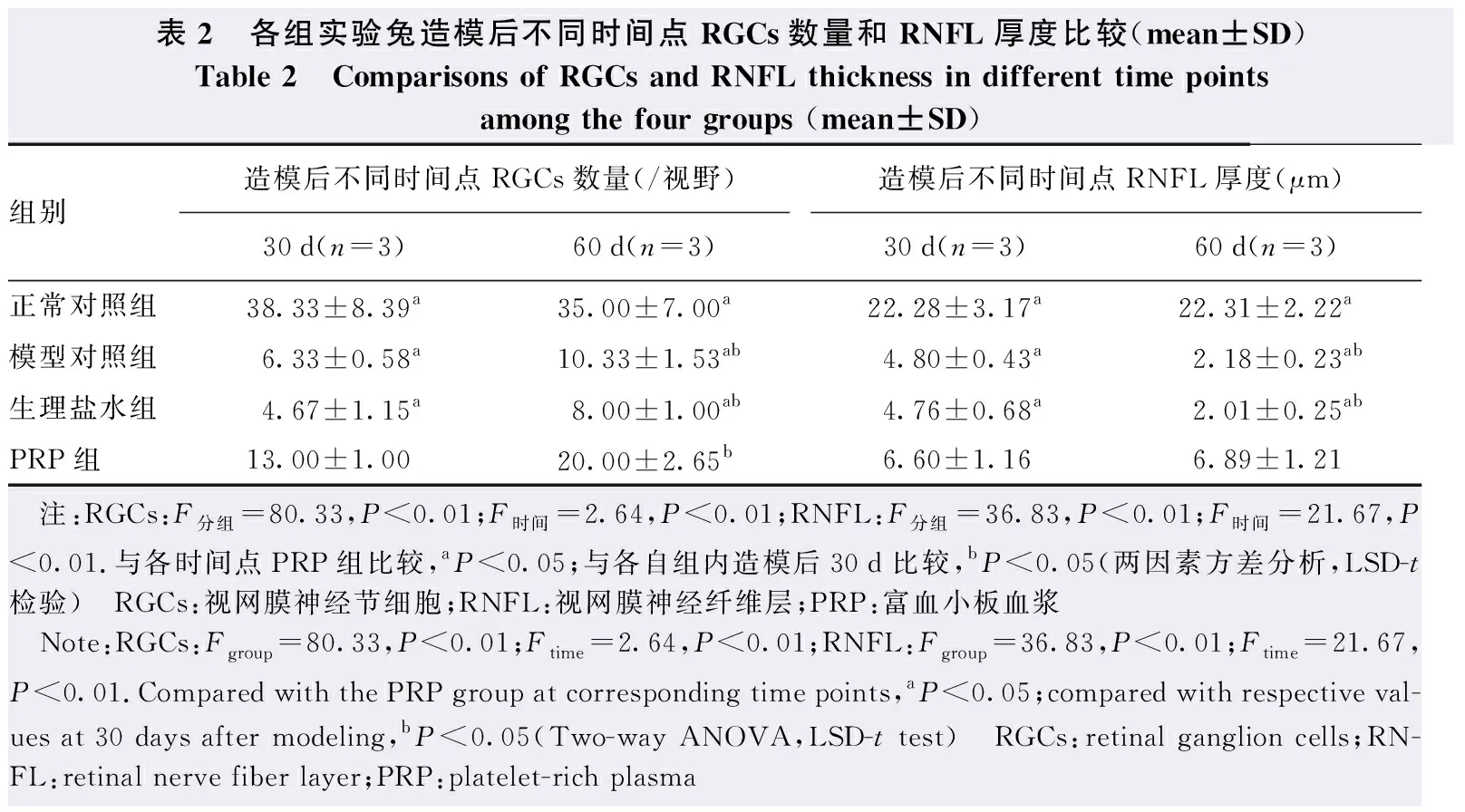
表2 各组实验兔造模后不同时间点RGCs数量和RNFL厚度比较(mean±SD)Table 2 Comparisons of RGCs and RNFL thickness in different time points among the four groups (mean±SD)组别造模后不同时间点RGCs数量(/视野)造模后不同时间点RNFL厚度(μm)30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组38.33±8.39a35.00±7.00a22.28±3.17a22.31±2.22a模型对照组6.33±0.58a10.33±1.53ab4.80±0.43a2.18±0.23ab生理盐水组4.67±1.15a8.00±1.00ab4.76±0.68a2.01±0.25abPRP组13.00±1.0020.00±2.65b6.60±1.166.89±1.21 注:RGCs:F分组=80.33,P<0.01;F时间=2.64,P<0.01;RNFL:F分组=36.83,P<0.01;F时间=21.67,P<0.01.与各时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) RGCs:视网膜神经节细胞;RNFL:视网膜神经纤维层;PRP:富血小板血浆 Note:RGCs:Fgroup=80.33,P<0.01;Ftime=2.64,P<0.01;RNFL:Fgroup=36.83,P<0.01;Ftime=21.67,P<0.01.Compared with the PRP group at corresponding time points,aP<0.05;compared with respective val-ues at 30 days after modeling,bP<0.05(Two-way ANOVA,LSD-t test) RGCs:retinal ganglion cells;RN-FL:retinal nerve fiber layer;PRP:platelet-rich plasma
各组造模后不同时间点RNFL厚度总体比较,差异均有统计学意义(F分组=36.83,P<0.01;F时间=21.67,P<0.01);造模后30 d,PRP组RNFL厚度较模型对照组和生理盐水组明显增加,模型对照组和生理盐水组造模后60 d RNFL厚度较造模后30 d减少,差异均有统计学意义(均P<0.05);PRP组造模后60 d RNFL厚度与造模后30 d比较,差异无统计学意义(P>0.05)(表2)。
2.4 各组造模后不同时间点凋亡相关蛋白表达变化
各组造模后不同时间点Bcl-2蛋白阳性表达A值总体比较,差异均有统计学意义(F分组=128.50,P<0.01;F时间=21.55,P<0.01);造模后30 d和60 d,PRP组Bcl-2蛋白阳性表达A值均较模型对照组和生理盐水组明显升高,差异均有统计学意义(均P<0.05)。模型对照组和生理盐水组造模后60 d Bcl-2蛋白阳性表达A值明显低于造模后30 d,PRP组造模后60 d Bcl-2蛋白阳性表达A值明显高于造模后30 d,差异均有统计学意义(均P<0.05)(图4,表3)。
Caspase-3蛋白阳性主要表现在RGC层和内核层,而在视网膜外核层中未见表达。各组间视网膜caspase-3蛋白阳性表达A值总体比较,差异有统计学意义(F分组=121.00,P<0.01),不同时间点间视网膜caspase-3蛋白阳性表达A值总体比较,差异无统计学意义(F时间=0.554,P>0.05)。造模后30 d和60 d,生理盐水组和模型对照组视网膜caspase-3蛋白阳性表达A值均明显高于正常对照组和PRP组,差异均有统计学意义(均P<0.05)(图4,表3)。
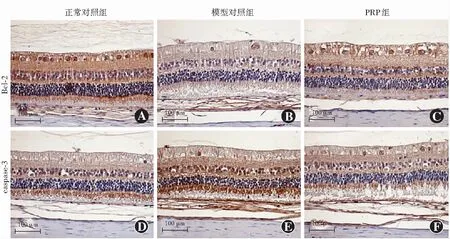
图4 正常对照组、模型对照组和PRP组造模后30 d视网膜中Bcl-2和caspase-3蛋白表达分布(DAB ×200,标尺=100 μm) 正常对照组和PRP组Bcl-2阳性染色强度明显强于模型对照组,caspase-3阳性染色强度明显弱于模型对照组 PRP:富血小板血浆Figure 4 Distribution of Bcl-2 and caspase-3 protein expression in retina of normal control group,model control group and PRP group at 30 days after modeling (DAB ×200,bar=100 μm) The positive staining intensity of Bcl-2 was stronger,while the positive staining intensity of caspase-3 was weaker in the normal control group and PRP group than those in the model group PRP:platelet-rich plasma
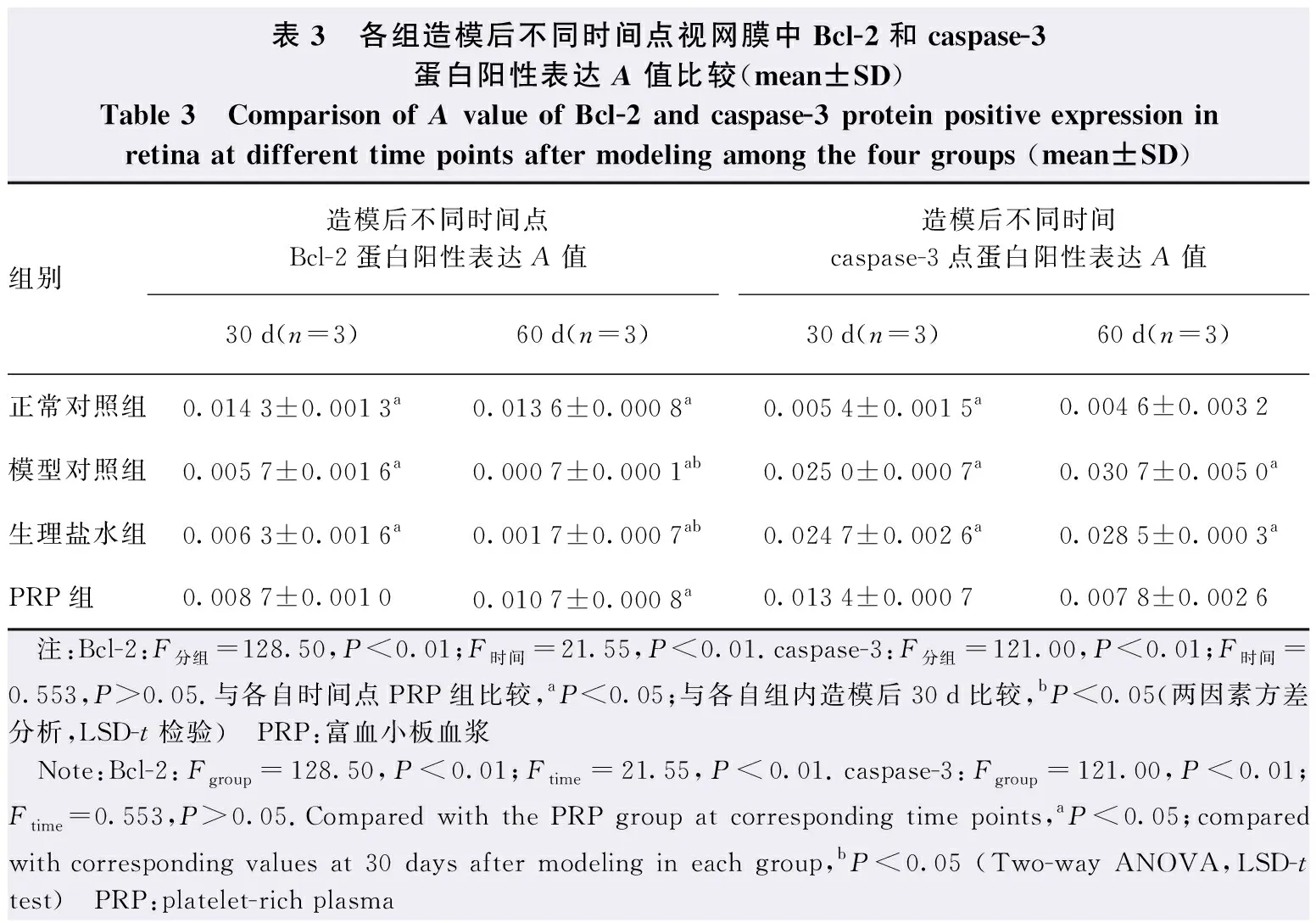
表3 各组造模后不同时间点视网膜中Bcl-2和caspase-3蛋白阳性表达A值比较(mean±SD)Table 3 Comparison of A value of Bcl-2 and caspase-3 protein positive expression in retina at different time points after modeling among the four groups (mean±SD)组别造模后不同时间点Bcl-2蛋白阳性表达A值造模后不同时间caspase-3点蛋白阳性表达A值30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组0.0143±0.0013a0.0136±0.0008a0.0054±0.0015a0.0046±0.0032模型对照组0.0057±0.0016a0.0007±0.0001ab0.0250±0.0007a0.0307±0.0050a生理盐水组0.0063±0.0016a0.0017±0.0007ab0.0247±0.0026a0.0285±0.0003aPRP组0.0087±0.00100.0107±0.0008a0.0134±0.00070.0078±0.0026 注:Bcl-2:F分组=128.50,P<0.01;F时间=21.55,P<0.01.caspase-3:F分组=121.00,P<0.01;F时间=0.553,P>0.05.与各自时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) PRP:富血小板血浆 Note:Bcl-2:Fgroup=128.50,P<0.01;Ftime=21.55,P<0.01.caspase-3:Fgroup=121.00,P<0.01;Ftime=0.553,P>0.05.Compared with the PRP group at corresponding time points,aP<0.05;compared with corresponding values at 30 days after modeling in each group,bP<0.05 (Two-way ANOVA,LSD-t test) PRP:platelet-rich plasma
2.5 各组造模后不同时间点视网膜和视神经中BDNF和Gap-43 mRNA相对表达量变化
各组造模后不同时间点视网膜中BDNF和Gap-43 mRNA相对表达量总体比较,差异均有统计学意义(BDNF:F分组=1 164.00,P<0.01;F时间=240.90,P<0.01.Gap-43:F分组=1 477.00,P<0.01;F时间=758.50,P<0.01),视神经中BDNF和Gap-43 mRNA相对表达量总体比较,差异均有统计学意义(BDNF:F分组=729.30,P<0.01;F时间=148.40,P<0.01.Gap-43:F分组=580.00,P<0.01;F时间=217.00,P<0.01)。造模后30 d和60 d,PRP组视网膜和视神经中BDNF和Gap-43 mRNA相对表达量均较模型对照组和生理盐水组明显升高,差异均有统计学意义(均P<0.05)。PRP组造模后60 d视网膜和视神经中BDNF和Gap-43 mRNA相对表达量较造模后30 d明显降低,差异均有统计学意义(均P<0.01)(表4,5)。
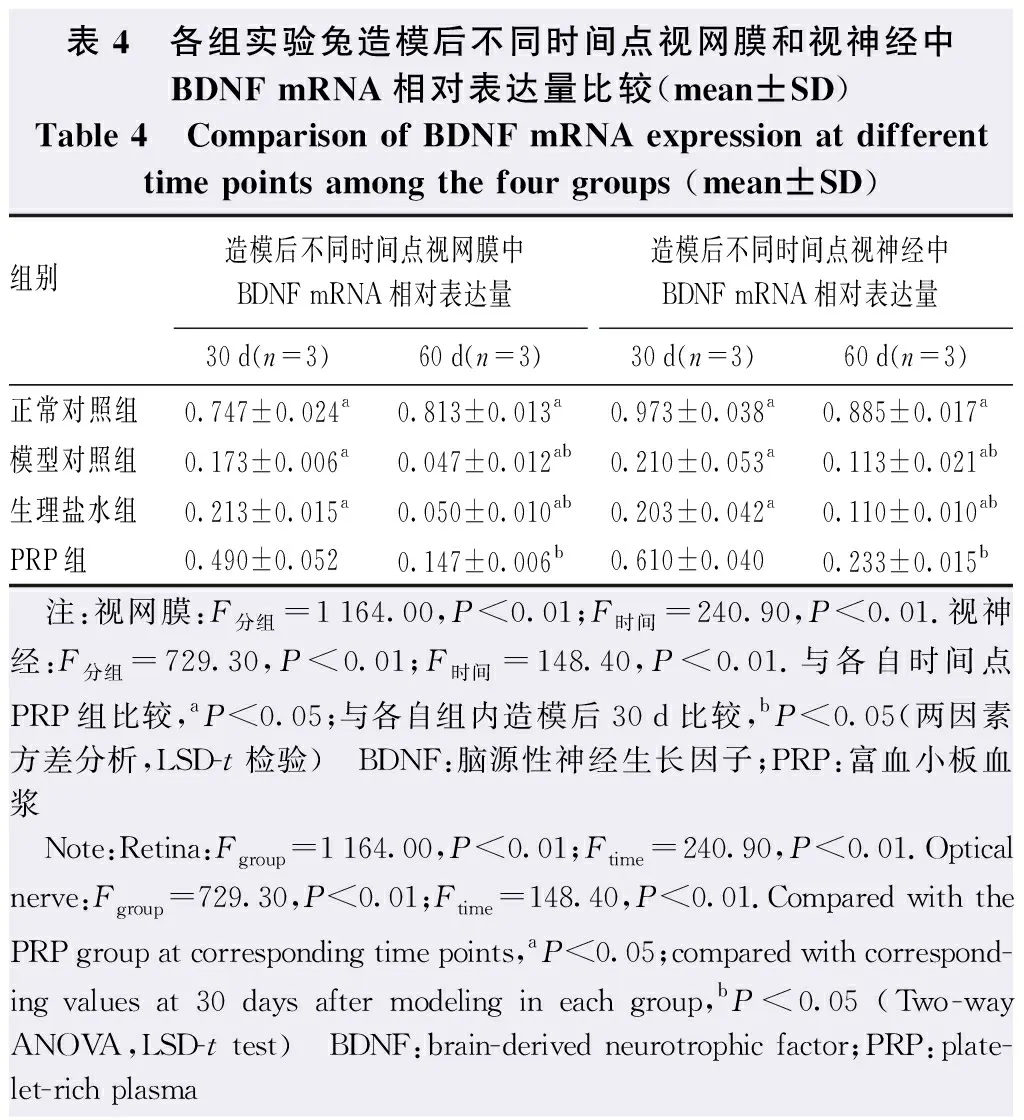
表4 各组实验兔造模后不同时间点视网膜和视神经中BDNF mRNA相对表达量比较(mean±SD)Table 4 Comparison of BDNF mRNA expression at different time points among the four groups (mean±SD)组别 造模后不同时间点视网膜中BDNF mRNA相对表达量造模后不同时间点视神经中BDNF mRNA相对表达量30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组0.747±0.024a0.813±0.013a0.973±0.038a0.885±0.017a模型对照组0.173±0.006a0.047±0.012ab0.210±0.053a0.113±0.021ab生理盐水组0.213±0.015a0.050±0.010ab0.203±0.042a0.110±0.010abPRP组0.490±0.0520.147±0.006b0.610±0.0400.233±0.015b 注:视网膜:F分组=1164.00,P<0.01;F时间=240.90,P<0.01.视神经:F分组=729.30,P<0.01;F时间=148.40,P<0.01.与各自时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) BDNF:脑源性神经生长因子;PRP:富血小板血浆 Note:Retina:Fgroup=1164.00,P<0.01;Ftime=240.90,P<0.01.Optical nerve:Fgroup=729.30,P<0.01;Ftime=148.40,P<0.01.Compared with the PRP group at corresponding time points,aP<0.05;compared with correspond-ing values at 30 days after modeling in each group,bP<0.05 (Two-way ANOVA,LSD-t test) BDNF:brain-derived neurotrophic factor;PRP:plate-let-rich plasma

表5 各组实验兔造模后不同时间点视网膜和视神经中Gap-43 mRNA相对表达量比较(mean±SD)Table 5 Comparison of Gap-43 mRNA expression at differenttime points among the four groups (mean±SD)组别 造模后不同时间点视网膜中Gap-43 mRNA相对表达量造模后不同时间点视神经中Gap-43 mRNA相对表达量30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组1.325±0.032a1.374±0.024a0.734±0.028a0.706±0.016a模型对照组0.323±0.059a0.087±0.012ab0.277±0.038a0.153±0.032ab生理盐水组0.527±0.055a0.093±0.006ab0.297±0.015a0.157±0.006abPRP组1.030±0.0170.170±0.010b0.573±0.0150.287±0.025b 注:视网膜:F分组=1477.00,P<0.01;F时间=758.50,P<0.01.视神经:F分组=580.00,P<0.01;F时间=217.00,P<0.01.与各自时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) Gap-43:生长相关蛋白43;PRP:富血小板血浆 Note:Retina:Fgroup=1477.00,P<0.01;Ftime=758.50,P<0.01.Optical nerve:Fgroup=580.00,P<0.01;Ftime=217.00,P<0.01.Compared with the PRP group at corresponding time points,aP<0.05;compared with correspond-ing values at 30 days after modeling in each group,bP<0.05 (Two-way ANOVA,LSD-t test) Gap-43:growth associated protein-43;PRP:platelet-rich plasma
2.6 各组造模后不同时间点视网膜和视神经中BDNF和Gap-43蛋白相对表达量变化
各组造模后不同时间点视网膜中BDNF和Gap-43蛋白相对表达量总体比较,差异均有统计学意义(BDNF:F分组=85.91,P<0.01;F时间=29.50,P<0.01.Gap-43:F分组=136.20,P<0.01;F时间=23.73,P<0.01),视神经中BDNF和Gap-43蛋白相对表达量总体比较,差异有统计学意义(BDNF:F分组=132.30,P<0.01;F时间=37.23,P<0.01.Gap-43:F分组=114.30,P<0.01;F时间=20.60,P<0.01)。造模后30 d和60 d,PRP组视神经和视网膜中BDNF和Gap-43蛋白相对表达量均较模型对照组和生理盐水组明显升高,PRP组造模后60 d视神经和视网膜中BDNF和Gap-43蛋白相对表达量均较造模后30 d明显降低,差异均有统计学意义(均P<0.05)(图5,表6,表7)。
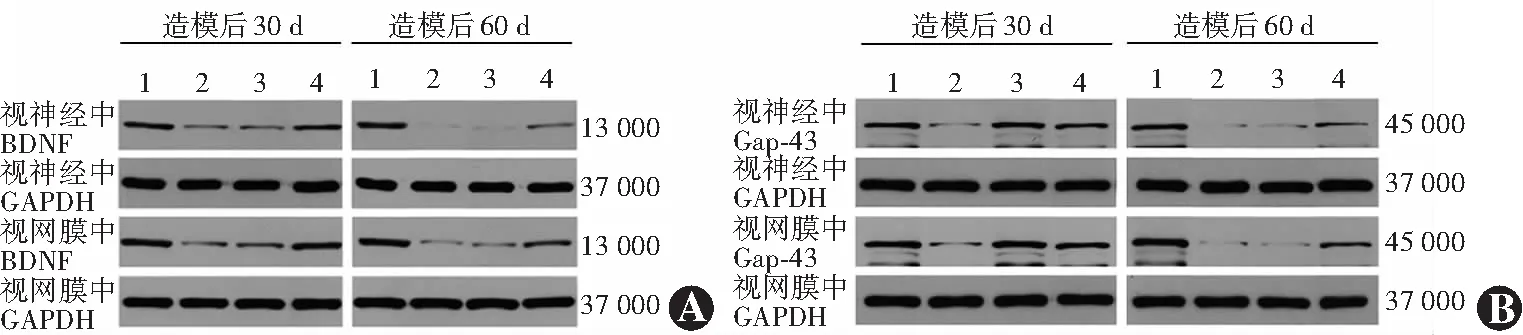
图5 各组造模后不同时间点视网膜和视神经中BNDF和Gap-43蛋白表达电泳图 A:BNDF蛋白表达电泳图 B:Gap-43蛋白表达电泳图 1:正常对照组;2:模型对照组;3:生理盐水组;4:PRP组;BDNF:脑源性神经生长因子;GAPDH:甘油醛-3-磷酸脱氢酶;PRP:富血小板血浆;Gap-43:生长相关蛋白43Figure 5 Electrophoretogram of BNDF and GAP-43 protein expression in retina and optic nerve at different time points after modeling in the four groups A:Electrophoretogram of BNDF protein expression B:Electrophoretogram of GAP-43 protein expression 1:normal control group;2:model control group;3:normal saline group;4:PRP group;BDNF:brain-derived nerve growth factor;GAPDH:glyceraldehyde-3-phosphate dehydrogenase;PRP:platelet-rich plasma;GAP-43:growth associated protein-43

表6 各组造模后不同时间点视网膜和视神经中BDNF蛋白相对表达量比较(mean±SD)Table 6 Comparison of BDNF protein expression at differenttime points among the four groups (mean±SD)组别 造模后不同时间点视网膜中BDNF蛋白相对表达量造模后不同时间点视神经中BDNF蛋白相对表达量30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组0.731±0.116a0.692±0.119a0.665±0.077a0.621±0.015a模型对照组0.242±0.068a0.095±0.026ab0.200±0.042a0.062±0.015ab生理盐水组0.283±0.058a0.104±0.027ab0.199±0.048a0.089±0.024abPRP组0.560±0.0720.366±0.031b0.551±0.0730.319±0.076b 注:视网膜:F分组=85.91,P<0.01;F时间=29.50,P<0.01.视神经:F分组=132.30,P<0.01;F时间=37.23,P<0.01.与各自时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) BDNF:脑源性神经生长因子;PRP:富血小板血浆 Note:Retina:Fgroup=85.91,P<0.01;Ftime=29.50,P<0.01.Optical nerve:Fgroup=132.30,P<0.01;Ftime=37.23,P<0.01.Compared with the PRP group at corresponding time points,aP<0.05;compared with cor-responding values at 30 days after modeling in each group,bP<0.05 (Two-way ANOVA,LSD-t test) BDNF:brain-derived neurotrophic factor;PRP:platelet-rich plasma
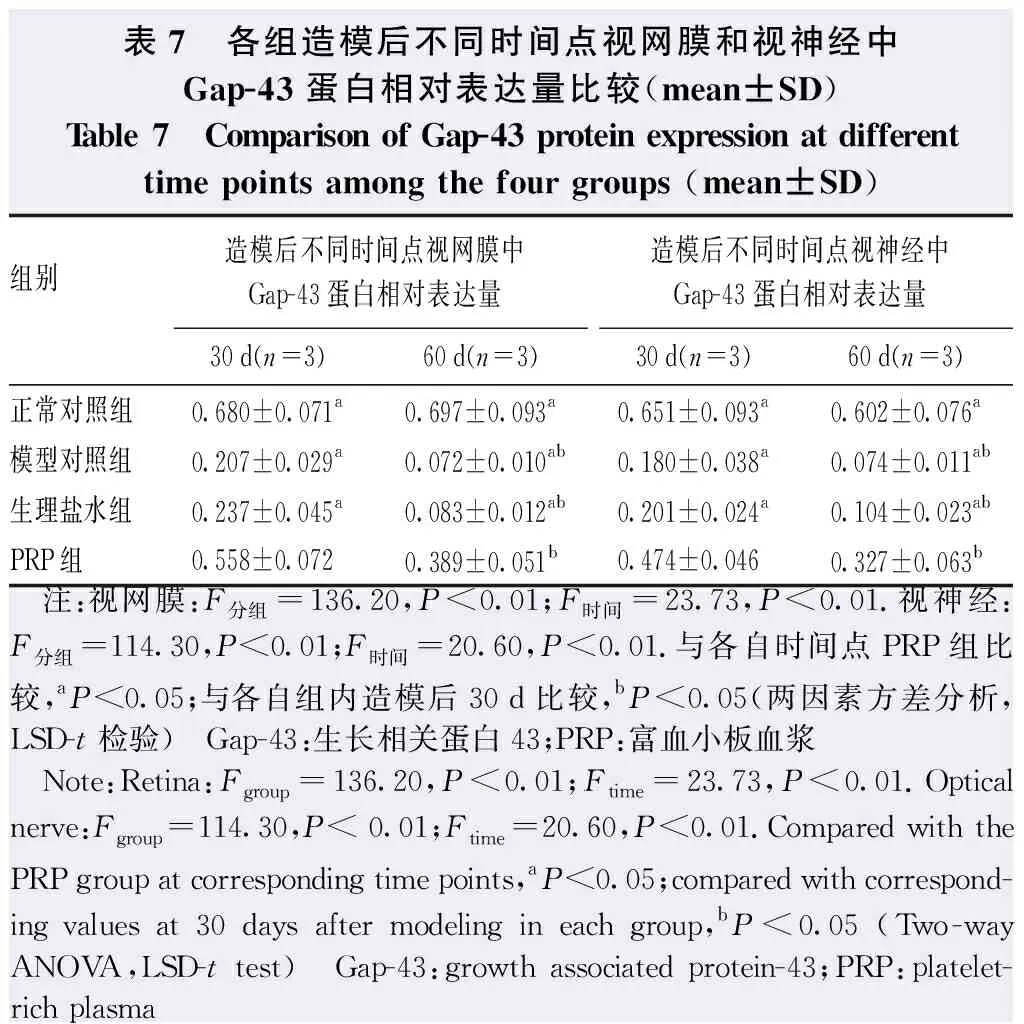
表7 各组造模后不同时间点视网膜和视神经中Gap-43蛋白相对表达量比较(mean±SD)Table 7 Comparison of Gap-43 protein expression at differenttime points among the four groups (mean±SD)组别 造模后不同时间点视网膜中Gap-43蛋白相对表达量造模后不同时间点视神经中Gap-43蛋白相对表达量30d(n=3)60d(n=3)30d(n=3)60d(n=3)正常对照组0.680±0.071a0.697±0.093a0.651±0.093a0.602±0.076a模型对照组0.207±0.029a0.072±0.010ab0.180±0.038a0.074±0.011ab生理盐水组0.237±0.045a0.083±0.012ab0.201±0.024a0.104±0.023abPRP组0.558±0.0720.389±0.051b0.474±0.0460.327±0.063b 注:视网膜:F分组=136.20,P<0.01;F时间=23.73,P<0.01.视神经:F分组=114.30,P<0.01;F时间=20.60,P<0.01.与各自时间点PRP组比较,aP<0.05;与各自组内造模后30d比较,bP<0.05(两因素方差分析,LSD-t检验) Gap-43:生长相关蛋白43;PRP:富血小板血浆 Note:Retina:Fgroup=136.20,P<0.01;Ftime=23.73,P<0.01.Optical nerve:Fgroup=114.30,P< 0.01;Ftime=20.60,P<0.01.Compared with the PRP group at corresponding time points,aP<0.05;compared with correspond-ing values at 30 days after modeling in each group,bP<0.05 (Two-way ANOVA,LSD-t test) Gap-43:growth associated protein-43;PRP:platelet-rich plasma
3 讨论
视神经损伤主要表现为RGCs的轴突损伤,由于轴突再生的缺乏,导致视觉出现不可逆转的损害。轴突无法再生可部分归因于神经胶质瘢痕和髓磷脂所形成的神经生长抑制环境,以及轴突再生能力不足[12]。此外,RGCs在视神经损伤后发生细胞凋亡[13]。死亡的RGCs可激活视网膜内神经胶质细胞,尤其是小胶质细胞,释放大量炎性因子与毒性物质,进一步加重组织损伤[14-15]。目前尚无一种治疗方法能够有效刺激轴突再生并修复视觉通路中的轴突连接[16]。视神经钳夹伤模型具有安全性高、损伤程度稳定可控、造模成功率高的特点[17]。本研究中采用视神经钳夹法建立视神经损伤模型,通过视神经外观、视神经及视网膜组织病理学染色证实视神经轴突崩解和丢失,视网膜组织结构紊乱;同时发现,球后注射PRP可有效修复视神经损伤模型中视神经和视网膜的组织结构,减缓组织的继发性损伤。
Caspase-3是细胞凋亡过程中重要的蛋白酶,而Bcl-2可以抑制由多种细胞毒因素所引起的细胞死亡。本研究中免疫组织化学染色结果显示,视神经损伤模型视网膜中caspase-3阳性染色强度较正常对照组明显升高,而Bcl-2阳性染色强度较正常对照组明显降低,说明视神经钳夹法造成了视神经的损伤,诱发细胞凋亡。而PRP组视网膜中caspase-3阳性染色强度较模型对照组明显降低,Bcl-2阳性染色强度较模型对照组升高,证实球后注射PRP提高了细胞Bcl-2的表达,并下调了caspase-3的产生,从而抑制了caspase-3相关的细胞凋亡,发挥其缓解组织损伤的作用。同时PRP组的视神经较模型对照组拥有较大的直径以及更为完整的组织结构,且视网膜较模型对照组拥有更多的RGCs数量以及更为完整的RNFL结构和厚度,因此认为PRP可有效减轻视神经受损后视神经和视网膜的急性水肿和继发性变性萎缩,而这一疗效可能通过其抑制细胞凋亡,减少RGCs细胞的继发性凋亡而发挥作用。
在以上诸多因素中,神经轴锁断裂所导致的内源性神经营养因子供应中断是视神经损伤以及RGCs凋亡的关键因素[13]。因此推测,可通过外源性补充神经营养因子来减缓或抑制视神经损伤后的RGCs凋亡,甚至促进已损伤的视神经修复再生,从而为治疗视神经损伤和促进视觉功能恢复提供实验依据。
BDNF广泛分布于中枢神经系统,对神经元的存活、分化、生长起重要作用[18-20],其被认为是传统神经营养因子中针对RGCs轴突受损有效的生存因子[21-22]。Gap-43是一种富集在生长锥的膜相关磷脂蛋白,具有促进轴突生长、再生及轴突导向的作用。Gap-43能够促进突触形成,抑制其坏死和回缩,促进少突胶质细胞、星形细胞的分化,从而促进轴突再生[23-24];目前其被认为是神经发育和损伤修复过程中轴突生长的标志蛋白[25]。本研究通过PCR证实球后注射PRP促进视神经和视网膜中神经生长因子BDNF和Gap-43 mRNA表达,进一步进行蛋白含量检测证实BDNF和Gap-43蛋白含量上升,说明球后注射PRP可以缓解组织损伤,还通过上调相关神经营养因子的含量而促进组织修复。此外,PRP本身还可提供血小板衍生生长因子、表皮生长因子、胰岛素样生长因子-1、血管内皮生长因子等多种生长因子,从而为视神经的修复起到积极作用[3]。
PRP的临床应用具有许多独特优势:(1)无免疫排斥反应;(2)制备简单、操作易行;(3)含有多种高浓度的生长因子;(4)对机体无不良反应[26]。因此PRP治疗视神经损伤是一个安全且有效的途径,具有良好的临床应用价值及发展前景。
本研究结果表明,PRP可有效抑制视神经损伤后RGCs的凋亡及视网膜的继发性损伤,从而减缓视神经损伤后的视网膜和视神经损伤,且随着时间延长效果更明显;同时通过上调神经生长因子的表达有效促进视神经和视网膜的修复,但是随着时间增加效果减弱。
利益冲突所有作者均声明不存在利益冲突
