溃疡性结肠炎大鼠中缝隙连接蛋白的表达及分布
2021-04-09刘卫东冯燕惠文佳王春司军强高峰
刘卫东,冯燕,惠文佳,王春,司军强,高峰
1.新疆维吾尔自治区人民医院消化科,新疆乌鲁木齐830001;
2.新疆维吾尔自治区人民医院病理科,新疆乌鲁木齐830001;
3.石河子大学医学院生理教研室,新疆石河子832000
溃疡性结肠炎(ulcerative colitis,UC)的发病与肠黏膜屏障缺陷、遗传易感性、微生物环境不平衡等多因素共同作用下的肠道免疫功能紊乱有关[1]。机械屏障、化学屏障、免疫屏障与生物屏障的相互作用构成了肠道黏膜屏障。其中机械屏障主要有缝隙连接、紧密连接和黏附连接共同参与,而缝隙连接蛋白对黏膜屏障具有调节作用[2]。缝隙连接通道的基本单位是连接蛋白(connexin,Cx),连接蛋白在不同的组织和器官中的表达具有特异性,结肠上表达的有Cx26、Cx31、Cx31.1、Cx32、Cx36、Cx40、Cx43、Cx45[3-4]。其中比较重要的缝隙连接蛋白就是Cx43,研究表明它具有肿瘤抑制的特性[5]。Cx32敲除的小鼠中,通过X射线照射发现小鼠总体肿瘤负荷明显增加,说明连接蛋白表达的缺失与肿瘤发生增加有关[6]。目前,缝隙连接蛋白在溃疡性结肠炎中的研究较少,且连接蛋白可能作为溃疡性结肠炎潜在的预测标记物和治疗靶点。因此,本研究通过分析Cx43和Cx32在UC大鼠模型中表达和分布差异,初步探讨缝隙连接蛋白在UC中的表达意义。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级雄性SD大鼠30只,6~8周龄,体质量约200 g。大鼠来源于新疆医科大学实验动物中心,随机分为DNBS(2,4-Dinitrobenzene sulfonic acid)诱导模型组15只和对照组15只。本研究中的动物实验部分通过了新疆维吾尔自治区人民医院伦理委员会审核批准(KY2018011817)。
1.1.2 主要试剂与仪器其中有二硝基苯磺酸(2,4-Dinitrobenzene sulfonic acid,DNBS)(Sigma公司);小鼠单克隆Cx32抗体(Abcam公司);兔多克隆Cx43抗体(Abcam公司);鼠抗β-actin抗体、山羊抗兔二抗、山羊抗鼠二抗(北京中杉金桥生物技术有限公司);RNeasy Mini Kit试剂盒(Qiagen公司);总蛋白提取试剂盒(Qiagen公司);CFX96TOuch荧光定量PCR检测系统(Bio-Rad公司);LSM510激光共聚焦显微镜(Carl Zeiss公司),双垂直电泳仪(北京六一生物科技有限公司)。
1.2 方法
1.2.1 DNBS诱导的UC大鼠模型及验证大鼠禁食24 h,用指尖轻轻按压动物的肛门,去除可能出现在远端结肠的粪便。模型组采用七氟烷麻醉诱导并维持,使用直径为0.1 cm、长度为10 cm的聚乙烯导管,随后使用50%乙醇溶解的DNBS灌注诱导结肠炎,注射剂量为100 mg/kg。模型期间给大鼠正常喂食并饮水使用8%的蔗糖溶液。造模4 d后,采用七氟烷麻醉,颈椎脱臼处死,迅速取出大鼠结肠组织并处理干净。截取部分大鼠结肠组织使用4%多聚甲醛的磷酸盐缓冲液进行固定,通过免疫组化验证UC大鼠模型。
1.2.2 Cx32和Cx43 mRNA在结肠组织的表达大鼠结肠组织采用RNeasyMini Kit试剂盒提取结肠组织总RNA,反转录合成cDNA。所有cDNA样品分别配置实时定量PCR反应体系置于实时定量PCR仪上进行扩增反应。Cx32、Cx43和β-actin的扩增引物见表1。本实验采用β-actin作为内参,每个样品重复测定3次,通过计算出每个样品2-△△Ct,得出Cx32、Cx43 mRNA的相对表达量。

表1 各基因引物序列
1.2.3 Cx32和Cx43在结肠组织的分布和表达处理后的大鼠结肠组织置于含4%多聚甲醛的磷酸盐缓冲液内固定48 h,冰冻切片,使用3%过氧化氢去除内源性过氧化物酶后分别加入Cx32和Cx43特异性抗体4℃过夜。次日加入FITC标记相关二抗,按照说明书进行避光操作,使用荧光显微镜进行分析蛋白的表达水平和位置分布;Western blot检测按照试剂盒操作步骤进行组织蛋白提取,用BCA法测定全蛋白浓度。SDS-PAGE电泳,23 V电转43 min,5%牛奶封闭非特异性结合位点后,弃去封闭液,分别加入Cx32和Cx43一抗,振荡孵育4℃过夜。次日取再与辣根过氧化物酶标记的相关二抗室温孵育,使用化学发光试剂盒处理、显影、定影,呈像。
1.3 统计学方法实验数据通过SPSS17.0软件进行统计分析,计量资料均符合正态分布,以均数±标准差(x-±s)表示,组间两两比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间比较采用LSD方法。以P<0.05为差异有统计学意义。
2 结果
2.1 动物模型的建立及验证UC大鼠模型组中均出现懒动、拱背、厌食、消瘦、皮毛光泽度下降、大便次数增多、部分出现黏液血便。UC造模前和3 d后比较体质量由(212.5±7.3)g下降至(202.5±10.6)g,差异无统计学意义(t=-2.41,P>0.05)。每天记录实验大鼠疾病活动指数(DAI)评分,即DAI=(体质量下降分数+大便性状分数+便血情况分数)/3。UC模型组1 d、2 d、3 d的DAI评分分别为(0.79±0.17)分、(1.29±0.27)分、(2.13±0.25)分,呈上升趋势,差异有显著统计学意义(F=25.1,P<0.01)。形态学观察结肠组织表现为黏膜充血水肿甚至糜烂。大鼠结肠组织形态的病理改变见图1。对照组大鼠结肠黏膜可见单层柱状上皮细胞排列整齐,肠腺清晰,吸收细胞与杯状细胞的形态正常,未见炎性细胞浸润。DNBS诱导的大鼠模型组结肠黏膜肌层,杯状细胞出现缺失,隐窝形态不规则,大部分可见溃疡面,隐窝脓肿形成,严重者可见中性粒细胞破坏至平滑肌层。

图1 对照组和UC模型组中结肠组织病理形态变化
2.2 UC组大鼠中Cx32和Cx43mRNA表达水平比较实时定量PCR检测Cx32和Cx43 mRNA表达的结果显示(图2):UC模型组中的Cx32和Cx43 mRNA相对表达量较对照组分别提高2.3倍和3.4倍,差异均有统计学意义(t=-5.4、12.3,P<0.05)。
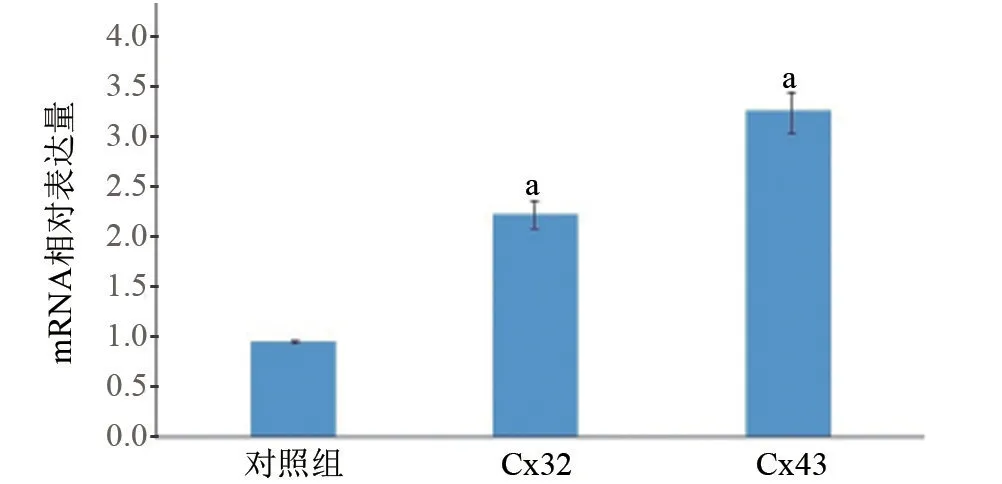
图2 UC模型组结肠组织中Cx32和Cx43 mRNA相对表达量
2.3 UC模型大鼠中Cx32和Cx43的表达和分布比较免疫定光分析Cx32和Cx43在UC模型组中的平均荧光密度分别为115.2±4.6、104.6±7.2,高于对照组的106.3±5.7、59.5±4.8,仅Cx43的表达差异有显著统计学意义(t=-17.8,P<0.01)。Cx32和Cx43的荧光在细胞质和细胞膜均有分布,UC模型组中Cx32和Cx43的定位显著向细胞核转移(图3);Western blot结果显示(图4),UC模型组中Cx32蛋白表达量较对照组升高1.2倍,但差异无统计学意义(P>0.05);Cx43蛋白相对表达量较对照组显著升高1.6倍,差异有显著统计学意义(t=-5.2,P<0.01)。
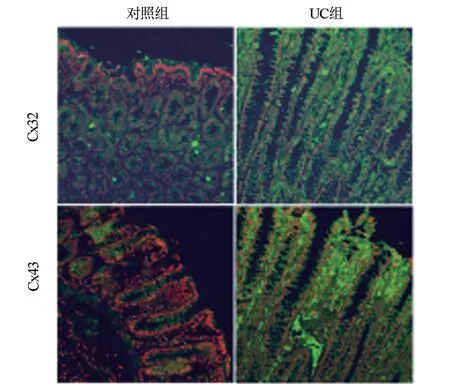
图3 UC组和对照组结肠组织中Cx32和Cx43的表达及分布(200×)

图4 结肠组织中Cx32和Cx43相对表达量
3 讨论
溃疡性结肠炎属慢性非特异性炎症性疾病,病情反复发作、迁延不愈,伴随多种肠外表现,且具有癌变的倾向,严重影响患者的生活质量[7]。目前,溃疡性结肠炎是慢性腹泻的主要病因,其发病机制可能与肠黏膜屏障缺陷、遗传易感人群在肠道持续感染以及环境改变等多因素作用下发生肠道免疫功能紊乱有关[8]。以细胞间缝隙连接为途径进行细胞间直接的信息交流与肠黏膜屏障功能的缺陷和免疫功能紊乱密切相关。免疫组化提示大量淋巴细胞浸润,杯状细胞丢失,隐窝脓肿形成。肠黏膜屏障是UC发生发展过程中的重要因素,是调控机体应激反应、生成炎症介质的重要器官。缝隙连接蛋白在多种炎症及肿瘤发展的不同阶段存在表达水平的差异,并能与体内细胞周期或肿瘤形成相关的蛋白发生相互作用,参与免疫调节[9]。
缝隙连接通道是由相邻的两个细胞通过特殊的细胞膜蛋白结构相互作用连接形成的通路,构成缝隙连接的基本单位是连接蛋白(connexin,Cx)。目前,在人类中已发现超过20种的连接蛋白,细胞膜上每6个连接蛋白亚基聚合形成一个半通道,细胞间的两个半通道形成兼容且有功能的缝隙连接通道是通过半通道亚基中的氢键相互锚定形成的[10]。缝隙连接通道可以允许相对分子质量小于1 kD的小分子物质自由通过,包括ATP、cAMP、IP3和离子。细胞之间通过缝隙连接蛋白形成一个低电阻通道进行信息、能量和物质的交换,参与细胞间物质交换的代谢偶联和电信号传递的电偶联,对细胞和组织的新陈代谢、内环境稳态、增殖和分化等生理过程具有重要的调节作用[11]。
本研究发现在溃疡性结肠炎大鼠中Cx32和Cx43蛋白和mRNA的表达增高,缝隙连接蛋白表达的增高可能参与炎症反应过程,尤其是Cx43可能具有重要的调节作用。众多结果表明,缝隙连接在结直肠肿瘤的疾病进展中具有着重要的作用。在人类的肠上皮细胞和黏膜肌层中,Cx43表达比较丰富,研究表明结直肠癌发展过程与缝隙连接蛋白的功能缺失和细胞质膜上的功能再定位有关[12-13],结肠癌样本中,Cx43的表达较对照组显著下调75%,且与组织型和肿瘤侵润型癌显著相关,其表达具有肿瘤抑制的特性[14]。此外,已有的研究也表明Cx43的表达可能是通过干预Wnt/β-catenin通路抑制结肠癌细胞的生长[15]。Wnt/β-catenin通路在肠道生理学中具有形成上皮内稳态的作用,是肠上皮干细胞识别和维持的组织者。Wnt/β-catenin通路不仅能调控胚胎发育,也对肠道自我更新具有重要的调节作用,过度活化的Wnt信号通路是UC相关结直肠癌发生发展的关键事件[16-17]。从功能上讲,Wnt激活可增加体内大鼠皮肤中伤口再上皮的速率。已有研究表明Wnt信号通路的激活可以促进TNBS处理的小鼠的黏膜修复,而Wnt激动剂处理的细胞中Cx43的核定位增加了8~10倍[13,18]。免疫荧光提示Cx32和Cx43蛋白表达量增高,并有核转移现象,UC特征在于黏膜下水平的慢性炎症和上皮屏障功能的破坏。本研究提示Wnt信号通路可能通过调节连接蛋白参与溃疡性结肠炎肠黏膜的修复,缝隙连接可以介导肠道免疫细胞与肠上皮细胞之间的异型缝隙连接通讯,通过肠道炎症细胞和上皮细胞建立细胞连接的复合体,从而可以易化肠黏膜屏障功能的缺陷[19]。缝隙连接蛋白在溃疡性结肠炎中的研究较少,而缝隙连接蛋白在UC中调节机制有待进一步研究。
综上所述,缝隙连接是细胞间重要通讯方式,且连接蛋白可能作为溃疡性结肠炎潜在的预测标记物和治疗靶点。DNBS诱导的UC大鼠模型中,Cx32和Cx43参与UC的炎症过程,尤其是Cx43在UC的疾病过程中可能具有重要的作用。
