德氏乳杆菌DMLD-H1的生物学特性研究及发酵培养基优化
2021-04-09刘冬梅余佳佳彭鑫胡金双黄燕燕
刘冬梅 余佳佳 彭鑫 胡金双 黄燕燕
(华南理工大学 食品科学与工程学院,广东 广州510640)
德氏乳杆菌(Lactobacillusdelbrueckii)是一种天然益生菌,已广泛应用于食品发酵[1]、饲料工业[2]、医药保健[3]等行业,与人们的日常生产生活息息相关。德氏乳杆菌目前分为6个亚种,分别是德氏乳杆菌德氏亚种(Lactobacillusdelbrueckiisubsp.delbrueckii)、德氏乳杆菌乳酸亚种(Lactobacillusdelbrueckiisubsp.lactis)、德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.bulgaricus)、德氏乳杆菌印度亚种(Lactobacillusdelbrueckiisubsp.indicus)、Lactobacillusdelbrueckiisubsp.sunkii和Lactobacillusdelbrueckiisubsp.jakobsenii[4- 7]。
德氏乳杆菌的来源广泛,常见于一些发酵食品中。宿利亚[8]从肉牛消化道内容物和马奶酒中分离出两株德氏乳杆菌,并研究了其抗菌作用、药敏性、耐酸耐胆盐性和肠道黏附性。肖明[9]对传统发酵乳制品中分离出的乳酸菌CH9-3进行了16S rDNA序列测定和API鉴定,确定该菌株为德氏乳杆菌保加利亚亚种。赵婧等[10]从泡菜中筛选出德氏乳杆菌H-3,发现其胞外多糖产量较高。李周勇等[11]从乳扇及其酸汤中筛选出德氏乳杆菌YNEY-36,并将其应用于酸奶发酵中。已有许多研究表明,德氏乳杆菌具有调节机体免疫应答[12]、调节肠道菌群[13]、降低胆固醇[14]等功能。德氏乳杆菌在食品工业中常常用于直投式酸奶发酵剂的研发[5]。目前,我国生产酸奶所用的直投式发酵剂多为进口发酵剂[15],因此开发具有我国自主知识产权的高活性、低成本直投式发酵剂备受国内学者关注。
本研究从内蒙古家庭自制酸奶中筛选出一株德氏乳杆菌,通过测定其生长曲线和对生长环境的适应性来对其生长特性进行研究,通过溶血性实验和急性毒理学实验对其安全性进行评估,测定了菌株的胃肠道耐受性和抑菌效果,并对其发酵培养基进行了优化,以期为该菌株的后续研究和工业开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
实验样品采自内蒙古自治区呼和浩特市家庭自制酸奶。
1.1.2 材料与试剂
大肠杆菌EscherichiacoliATCC 25922、金黄色葡萄球菌StaphylococcusaureusATCC 12589保存于华南理工大学食品科学与工程学院微生物实验室。
α-萘胺、对氨基苯甲磺酸,广州卯林试剂有限公司生产;哥伦比亚血琼脂平板、LB肉汤、细菌学蛋白胨,广东环凯微生物科技有限公司生产;琼脂、胃蛋白酶、胰蛋白酶,广州赛国生物科技有限公司生产。
MRS基础培养基组成:10.0 g/L酪蛋白酶消化物,10.0 g/L牛肉膏粉,4.0 g/L酵母膏粉,2.0 g/L柠檬酸三铵,5.0 g/L乙酸钠,0.2 g/L硫酸镁,0.05 g/L硫酸锰,2.0 g/L磷酸氢二钾,20.0 g/L葡萄糖,1.08 g/L,吐温-80。
1.2 仪器与设备
SW-CJ-1F无菌工作台,上海博讯实业有限公司医疗设备厂生产;YXQ-LS- 18SI立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂生产;LRH- 250A-Ⅱ生化培养箱,韶关市泰宏医疗器械有限公司生产;XSP- 2CA显微镜,上海光学仪器生产;2720 PCR扩增仪,上海兴曼生物科技有限公司生产。
1.3 实验方法
1.3.1 菌株分离与鉴定
利用梯度稀释平板涂布法从样品中分离出1株菌株,培养后取适当稀释的菌液进行革兰氏染色,镜检观察其形态。参照伯杰氏细菌鉴定手册[16]对菌株进行生理生化分析。
参照文献[17]的方法进行菌株的DNA提取。将纯菌落从平板上刮到已灭菌的生理盐水中,调至麦氏浊度为1.5,利用试剂盒提取菌株的DNA,然后以纯度较高的DNA为模板,进行PCR反应,扩增条件参照文献[18]的方法,将扩增得到的片段送往广州基迪奥生物科技有限公司进行DNA测序,然后将得到的序列导入BLAST中,利用MEGA 7.0软件构建系统进化树。
1.3.2 菌株的生长特性研究
将活化的菌液按3%(体积分数,下同)的比例接种于MRS培养基,于37 ℃下静置培养24 h,每2 h测定一次OD600、pH值、活菌浓度,绘制菌株的生长曲线。
为确定菌株的最适生长温度和最适生长初始pH值,将活化的菌液以3%的比例接种于MRS培养基中,分别置于不同温度(22、27、32、37、42 ℃)和不同初始pH值(2.0、2.5、3.0、4.0、5.0、6.0、7.0)下培养18 h,测定OD600。
1.3.3 溶血活性检测
将活化的菌株和金黄色葡萄球菌ATCC 12598接种于哥伦比亚血琼脂平板中,同时做空白实验,于37 ℃下培养48 h,观察菌落周围有无溶血圈出现。
1.3.4 急性毒理学实验
配制浓度为1×108CFU/mL的德氏乳杆菌DMLD-H1口服液,取经检验检疫合格的小鼠20只,体重18~22 g,雌雄各半,按照每千克体重20.0 mL的剂量空腹灌胃一次。灌胃后观察其14 d内的活动情况,以及是否染毒、是否死亡等。
1.3.5 胃肠道耐受性
参照文献[19]的方法制备模拟胃液(pH=2.5,3.0,4.0)和模拟肠液。菌株在模拟胃液中培养0、1、2、3 h后取样,分别测量其活菌浓度,同时设置空白对照,计算存活率。菌株在模拟肠液中培养0、1、2、3、4、5 h后取样,分别测量其活菌浓度。存活率计算方式如下:
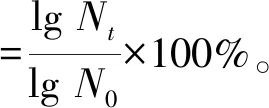
式中,N0为菌株经模拟胃肠液处理前的活菌浓度,Nt为菌株经模拟胃肠液处理后的活菌浓度。
1.3.6 抑菌实验
将活化的大肠杆菌和金黄色葡萄球菌的菌液稀释至105~106CFU/mL,涂布于平板上。待菌液晾干后,将无菌牛津杯放于平板中,分别吸取0.2 mL已活化好的德氏乳杆菌DMLD-H1的发酵液和离心后上清液放入牛津杯内。将平板放入冰箱24 h使菌液扩散,再于37 ℃下培养12 h,记录抑菌圈直径。
1.3.7 菌株的发酵培养基优化实验
通过单因素实验研究了低聚果糖(添加量为0.0、10.0、20.0、30.0、40.0、50.0 g/L)、细菌学蛋白胨(添加量为0.0、10.0、15.0、20.0、25.0、30.0 g/L)和硫酸镁(添加量为0.0、0.2、0.4、0.6、0.8、1.0 g/L)对菌体密度的影响。根据Box-Behnken响应面优化实验的原理,设计了如表1所示的三水平三因素实验。
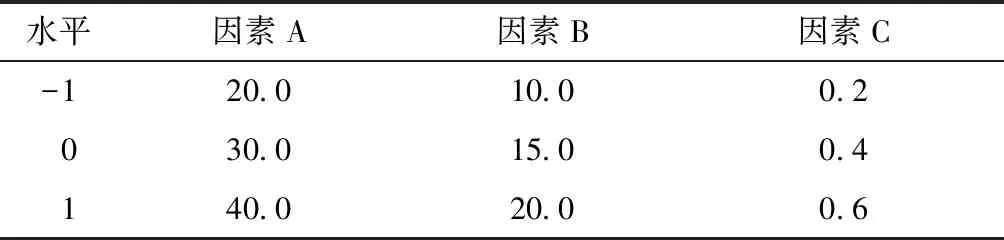
表1 发酵培养基优化实验的因素及水平1)
1.4 数据处理
利用SPSS 24.0、Excel 365、Origin 8和Design expert 10软件进行数据分析以及绘图,所有实验均进行3次平行实验。
2 结果与讨论
2.1 菌株的鉴定
菌株经革兰氏染色后在电子显微镜下进行观察,结果如图1所示。菌体呈长杆状,无鞭毛和芽孢,革兰氏染色显蓝紫色,是革兰氏阳性菌(以大肠杆菌ATCC 25922为对照),菌株的接触酶实验、氧化酶实验、靛基质实验、亚硝酸盐还原实验结果均为阴性。
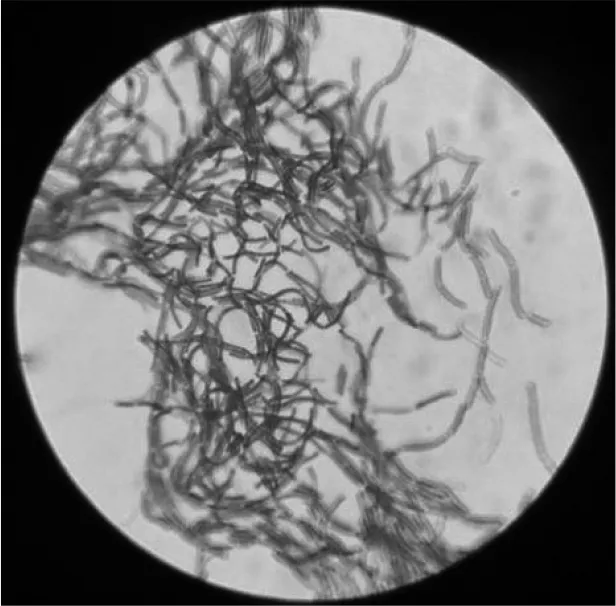
图1 菌株的革兰氏染色镜检图
运用16S rDNA序列构建菌株的系统进化树,如图2所示。结果表明,该菌株与德氏乳杆菌保加利亚亚种Lactobacillusdelbrueckiisubsp.bulgaricusMG5226有99%的同源性,结合镜检图、生理生化实验可知筛选所得菌株为德氏乳杆菌保加利亚亚种。将该菌株命名为LactobacillusdelbrueckiiDMLD-H1,保藏于广东省微生物菌种保藏中心,保藏编号为CGMCC NO.60645。

图2 菌株的系统进化树
2.2 德氏乳杆菌DMLD-H1的生长特性
根据德氏乳杆菌DMLD-H1静置培养过程中OD600、活菌浓度N以及pH值的变化绘制了生长曲线和产酸曲线,结果如图3所示。菌体培养2 h后进入对数增长期,12 h后进入稳定期,培养至18 h 时活菌浓度达到最大值4.18×108CFU/mL,表明18 h为德氏乳杆菌DMLD-H1的最佳收获期。18 h 后体系的pH值小于4.0,表明德氏乳杆菌DMLD-H1产酸能力强,具有作为发酵剂的潜力。

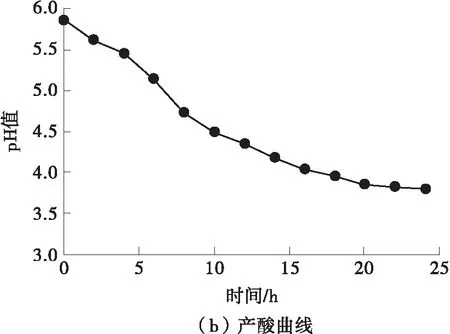
图3 德氏乳杆菌DMLD-H1的生长曲线和产酸曲线
在不同的温度和初始pH值下探讨德氏乳杆菌DMLD-H1的生长情况,结果如图4所示。菌株的最适生长温度为37 ℃,最适生长初始pH值为6.0,并且在pH 3.0~7.0的条件下OD600均大于0.7,说明菌株能够耐受的pH值范围为3.0~7.0,该结果表明德氏乳杆菌DMLD-H1对pH值的适应范围较广且具有耐酸性。实验结果与相关研究结果一致,德氏乳杆菌具有很强的耐酸性,即使在3.0~4.5的低pH值范围内也可以很好地生长[20- 21]。
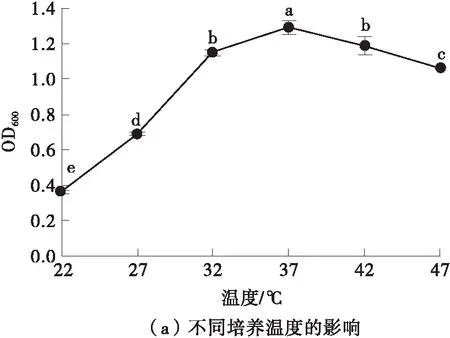
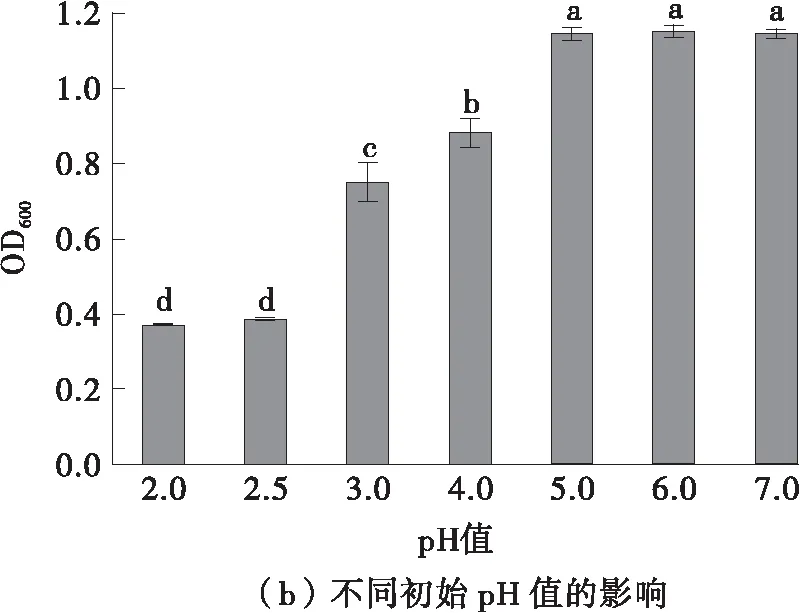
图中不同字母表示各组存在显著差异(P<0.05),下同
2.3 德氏乳杆菌DMLD-H1的安全性
乳酸菌的溶血活性测定通常采用血平板培养的方法,若菌落周围出现边界分明且透明的溶血圈,则为β-溶血,若没有出现溶血圈,则为γ-溶血[22]。溶血实验结果如图5所示,金黄色葡萄球菌菌落周围出现明显的透明溶血圈(见图5(c)),而穿刺(见图5(a))和划线(见图5(b))接种德氏乳杆菌DMLD-H1的血平板结果与空白组(见图5(d))相同,没有出现溶血圈,表明德氏乳杆菌DMLD-H1的溶血活性检测结果为γ-溶血。
经一定剂量的菌液灌胃后记录小鼠的体重增长以及死亡情况,结果如表2所示。各组小鼠的体重显著增长(P<0.05),生长状况良好,眼睛和皮肤无异常变化,活动情况和精神状态正常,没有明显的中毒症状,也没有小鼠死亡,观察期结束后对小鼠进行处死解剖,肉眼观察无异常,说明德氏乳杆菌DMLD-H1对小鼠无急性毒性。

图5 溶血实验的血平板培养图
2.4 德氏乳杆菌DMLD-H1的益生特性
将德氏乳杆菌DMLD-H1在不同pH值下培养3 h,记录其存活率变化情况,结果如图6所示。经过3 h的孵育后,菌株在pH 3.0和4.0条件下的存活率仍大于85%,且显著高于pH 2.5时的存活率。已知人体胃环境pH值约为3.0[23],该结果表明德氏乳杆菌DMLD-H1有良好的胃液耐受性。李洋等[24]从酸乳中筛选出的7株德氏乳杆菌保加利亚亚种,在pH 3.0的人工模拟胃液中存活率均高达85.28%,文中实验结果与该文献结果一致。
将德氏乳杆菌DMLD-H1在模拟肠液中培养5 h,记录其活菌浓度变化情况,结果如表3所示。菌株经模拟肠液处理5 h后,活菌浓度与空白组相比无显著差异(P>0.05),这表明德氏乳杆菌DMLD-H1对模拟肠液有良好的耐受性。乳酸菌要

表2 德氏乳杆菌DMLD-H1的急性毒理实验结果1)
1)表中不同字母表示各组存在显著差异(P<0.05),下同。
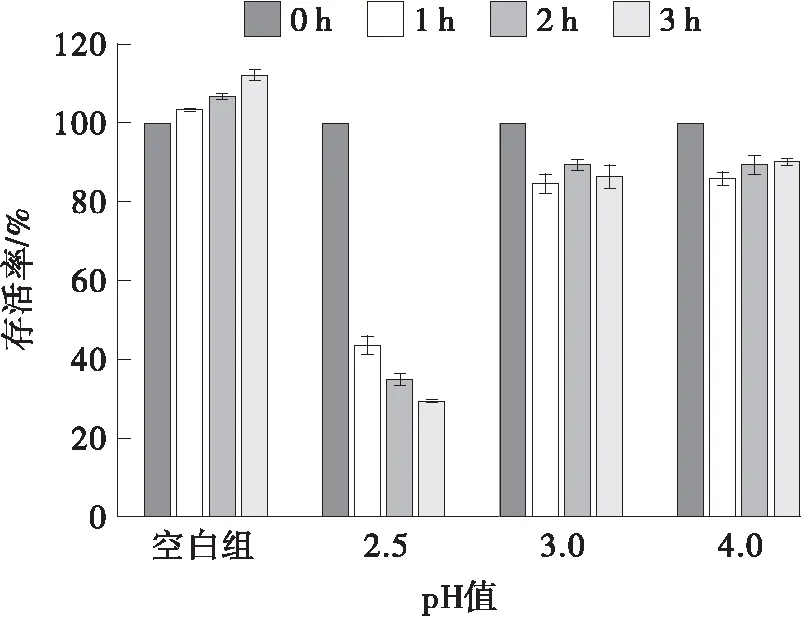
图6 德氏乳杆菌DMLD-H1在不同pH值下的存活率
对宿主发挥有益功效,必须克服胃肠道中的不良环境[23],胃肠液耐受性实验结果表明德氏乳杆菌DMLD-H1具有潜在的益生特性。
乳酸菌黏附机体肠道后,可以通过分泌有机酸、细菌素和胞外多糖等抗菌物质来抑制有害微生物的生长繁殖[25]。德氏乳杆菌DMLD-H1对致病菌的抑制作用见表4。可以看出,菌株的发酵液和上清液对大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 12589均有抑制作用,其中发酵液对大肠杆菌的抑制效果最强,抑菌圈直径大于19 mm。

表3 德氏乳杆菌DMLD-H1在模拟肠液中的活菌浓度变化

表4 德氏乳杆菌DMLD-H1对致病菌的抑制作用
2.5 德氏乳杆菌DMLD-H1发酵培养基的优化
发酵培养基中的碳源、氮源、无机盐添加量对菌体的生长繁殖有着显著影响[26],由图7可知,最佳的碳源添加量为低聚果糖30.0 g/L,最佳的氮源添加量为细菌学蛋白胨15.0 g/L,最佳的无机盐添加量为硫酸镁0.4 g/L。在单因素实验结果的基础上,以低聚果糖添加量(A)、细菌学蛋白胨添加量(B)、硫酸镁添加量(C)为自变量,德氏乳杆菌DMLD-H1的活菌浓度为响应值,进行了优化实验,具体的实验设计及结果见表5。
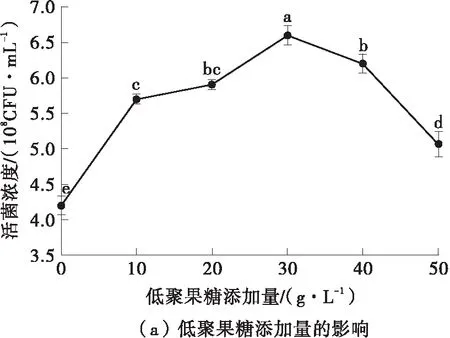
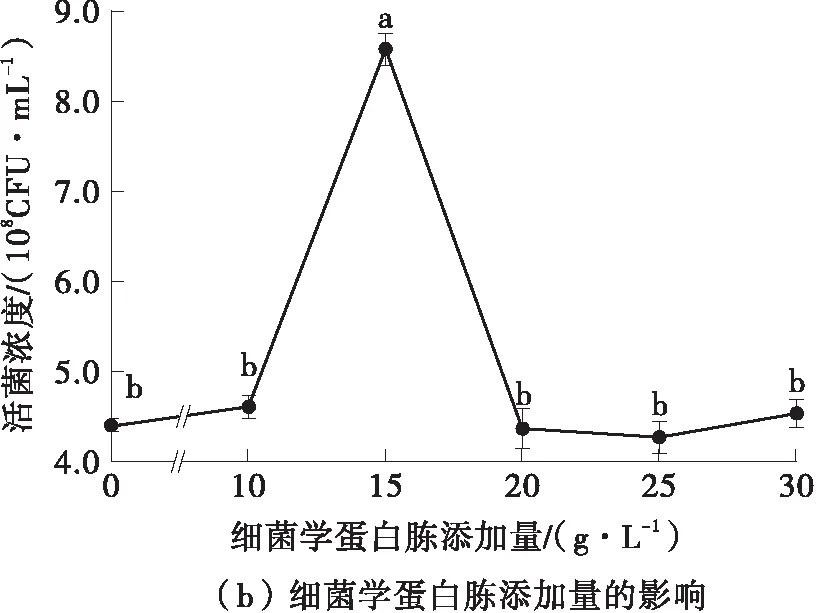
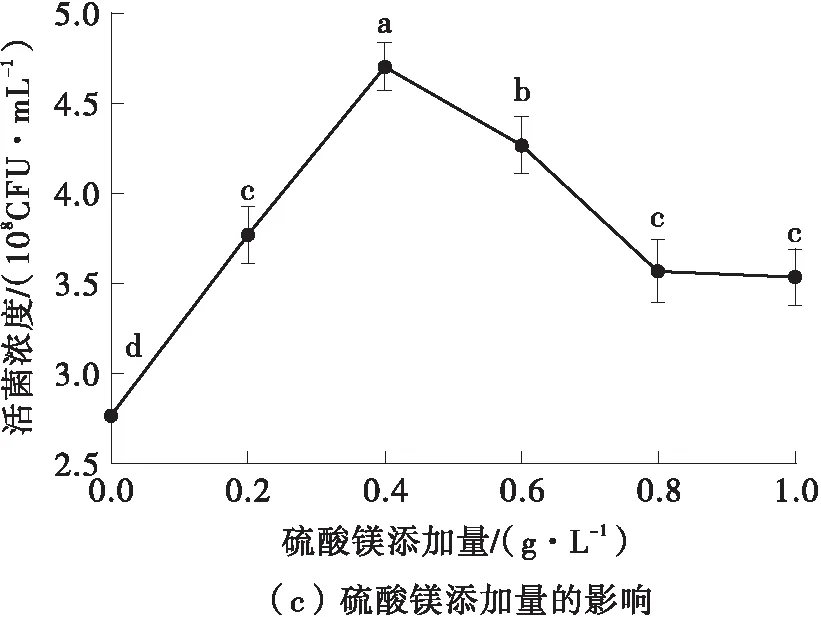
图7 碳源、氮源、无机盐添加量对活菌浓度的影响
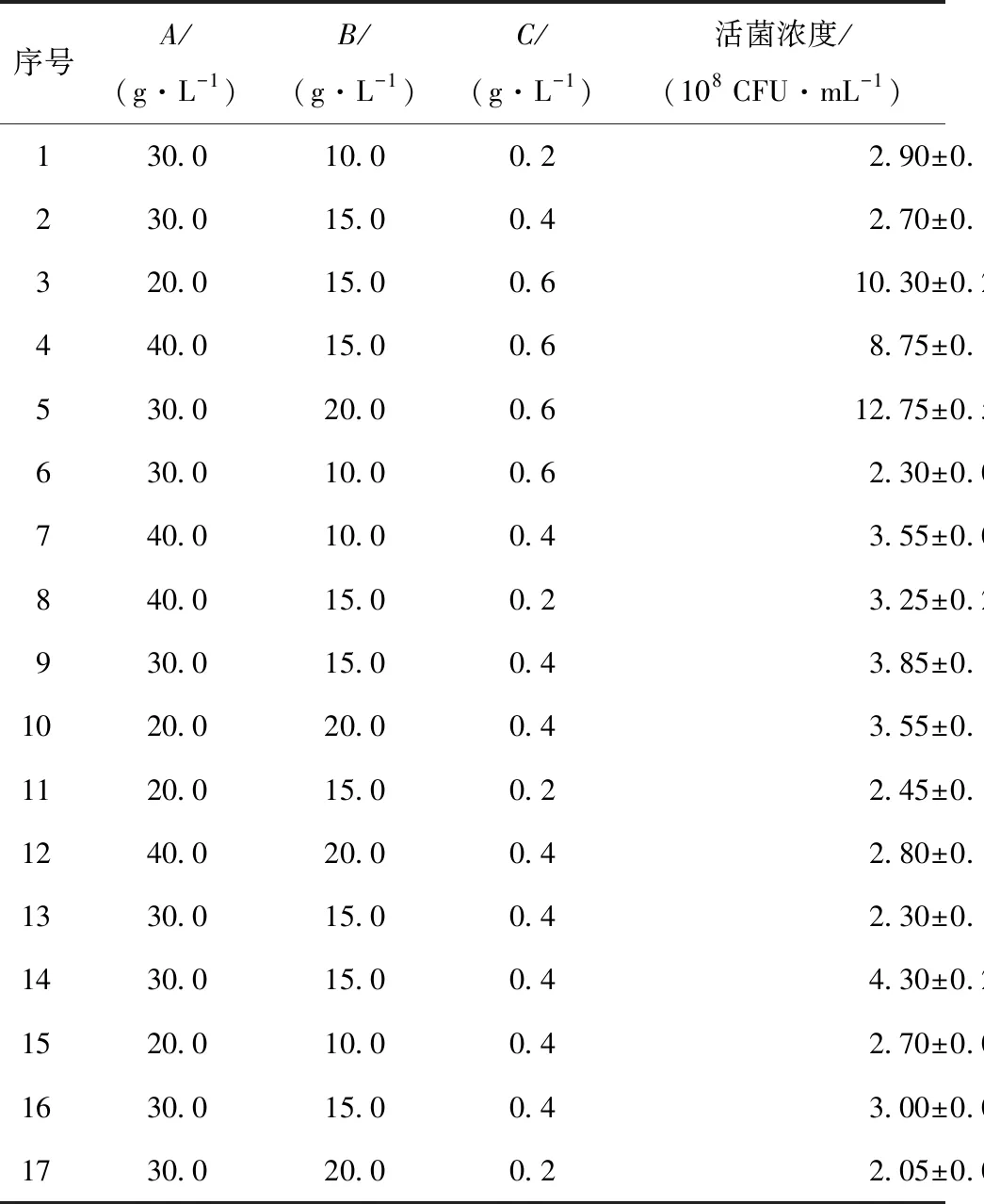
表5 Box-Behnken优化实验设计及结果
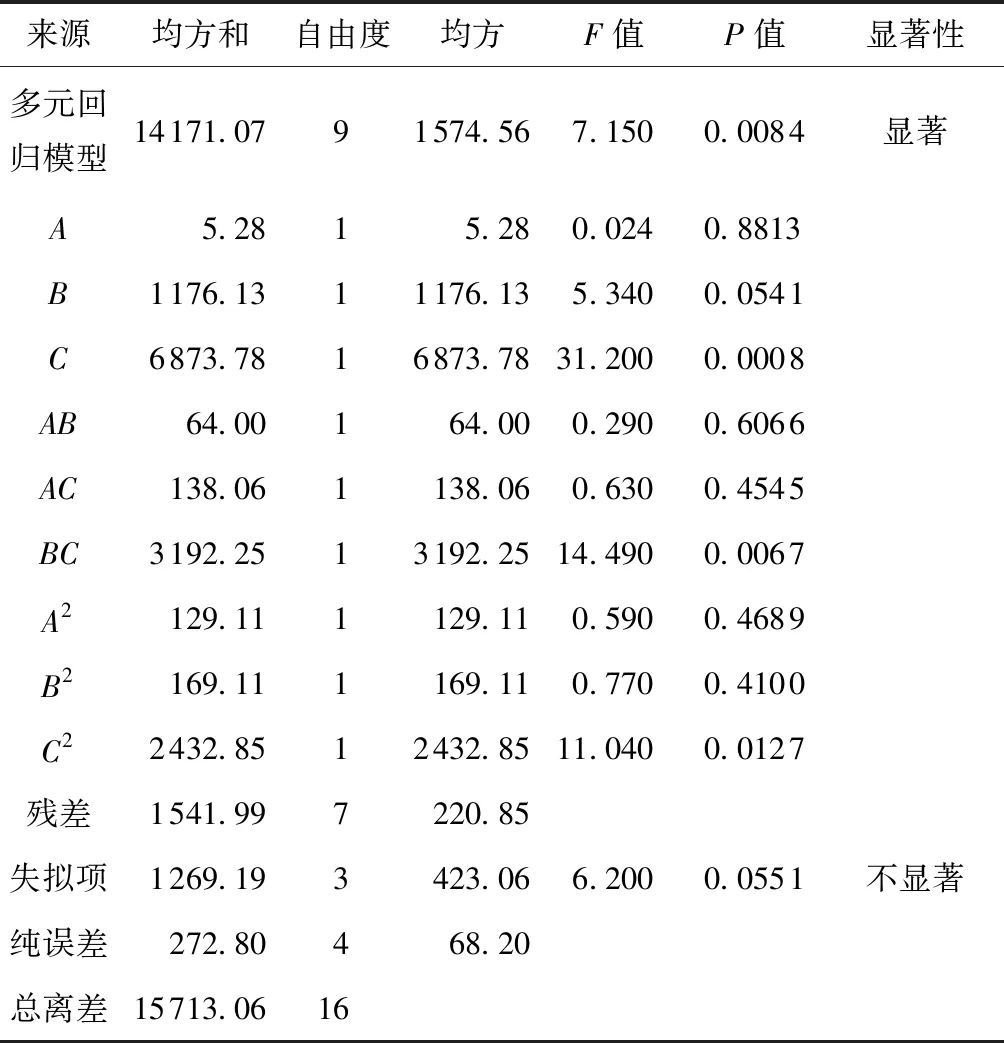
表6 多元回归模型的方差分析
由软件分析结果可以得到德氏乳杆菌DMLD-H1的发酵培养基最佳优化结果:低聚果糖添加量为20.2 g/L、细菌学蛋白胨添加量为19.7 g/L、硫酸镁添加量为0.596 g/L。在最优条件下得到德氏乳杆菌DMLD-H1活菌浓度的预测值为1.32×109CFU/mL。利用优化后的培养基进行3次平行实验验证预测值,得德氏乳杆菌DMLD-H1活菌浓度的平均值为1.30×109CFU/mL,与预测值拟合率高达98.48%,表明该模型可信度较高。
3 结论
文中从内蒙古家庭自制酸奶中筛选出1株乳杆菌,经鉴定知该菌株为德氏乳杆菌(LactobacillusdelbrueckiiDMLD-H1)。菌株的生长特性研究结果表明,德氏乳杆菌DMLD-H1的最适生长温度为37 ℃,能够耐受的pH值范围为3.0~7.0。血平板培养结果表明菌株不具有溶血活性,急性毒理学实验验证菌株对小鼠经口无毒。菌株对人工胃肠液有良好的耐受性,且菌发酵产物对大肠杆菌和金黄色葡萄球菌均有抑制作用。响应面实验确定菌株的最适发酵培养基为:20.2 g/L低聚果糖、19.7 g/L细菌学蛋白胨、0.596 g/L硫酸镁,培养基优化后活菌浓度可达1.30×109CFU/mL。文中研究结果为德氏乳杆菌DMLD-H1在食品工业中的开发和应用奠定了基础。
