干热胁迫下紫花苜蓿Rubisco羧化酶和活化酶活性变化及其基因表达的研究
2021-04-08何承刚毕玉芬
许 超, 何承刚, 牟 兰, 毕玉芬*, 姜 华*
(1. 云南农业大学动物科学技术学院, 云南 昆明 650201; 2. 昆明市农业广播电视学校, 云南 昆明 650032)
随着全球气候进一步变暖[1],高温和干旱严重影响着植物的光合作用,而且这两种非生物胁迫通常同时发生,对植物的影响比单因素胁迫更大,尤其是在半干旱或干旱地区[2]。植物的光合作用和生长通常受到二氧化碳固定酶—核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)活性的限制[3-4],Rubisco活化酶(Rubisco activase,RCA)则是调节Rubisco活性的关键酶,通过改善RCA酶的活性可提高Rubisco的性能,是显著提高植物产量的一条可行途径[5-7]。Ristic等[8]的研究表明内源RCA在植物生产水平中发挥重要作用。Rubisco羧化和氧化的过程是RCA酶固有的滞后性引起的,在早期的研究中发现RCA(激活因子)通过与Rubisco大亚基(rbcL) 结合而发挥功能[9]。王保明等[10]从油茶(Camelliaoleifera)叶片中成功克隆了CorbcL基因,并证明其转录表达与油茶油产量及种子产量之间具有一定的相关性。Laura等研究发现来自类球红细菌(Rhodobactersphaeroides)中的RCA活化酶RsRca能显著提升RsRubisco的活性,并使烟草的光合效率和生长提升2倍[4],因此,Rubisco被作为增强光合作用和提高生产力的首要研究目标。
尽管人们对各种植物在干旱和高温胁迫下的影响进行了广泛的研究,如干热条件对地中海葡萄(Vitisvinifera)[11]、小扁豆(Lensculinaris)[12]、小麦(Triticumaestivum)[13]的生理响应,但在干热胁迫下对紫花苜蓿(Medicagosativa)的研究主要集中在叶片气孔大小、生理特性、光合特性和引种[14-17]等方面。另外,有学者研究了紫花苜蓿的耐盐基因[18-19]、抗逆基因[20],但关于干热胁迫下紫花苜蓿Rubisco大亚基rbcL和RCA的基因rca结构和功能的研究在国内外鲜有报道。因此,本研究以云南野生紫花苜蓿和‘阿尔冈金’紫花苜蓿为试验材料,研究在干热胁迫条件下光合关键酶Rubisco羧化酶及RCA活性变化及其基因表达情况,以期为深入探讨紫花苜蓿该基因的结构与功能、进一步利用野生紫花苜蓿种质资源提供一定的理论依据。
1 材料和方法
1.1 试验材料
选用野生紫花苜蓿和‘阿尔冈金’紫花苜蓿作为试验材料,其中野生紫花苜蓿采自云南省迪庆州德钦县奔子栏乡的干热河谷地区,‘阿尔冈金’紫花苜蓿引自加拿大,有较强的抗逆性,种子由云南农业大学草学实验室提供。
1.2 试验设计
本试验在云南农业大学草学试验基地温室及实验室进行。选取饱满均匀的紫花苜蓿种子,每盆播种20~30粒,当植株长出3~4片真叶时,取叶片保存在-80℃条件下,用于目的基因序列扩增。待植株生长至150 d时,随机选取长势一致的每种材料各3盆,每盆10 株,置于人工气候箱进行干热胁迫处理,设定空气湿度为30%,白天(14 h)温度为32℃,夜间(10 h)温度为28℃。于干热处理前(对照)及干热胁迫处理后第4 d,8 d,12 d和复水(恢复为处理前的温度和湿度,且少量多次浇水至盆底溢水为止)后4 d,分别选取相同叶位的成熟叶片,经液氮处理后在-80℃条件下保存,用于测定干热胁迫下紫花苜蓿的Rubisco的活性及相关基因的表达。
1.3 测定指标及方法
1.3.1Rubisco活性 酶液提取和活性测定方法参照Tsuyoshi等[21]。(1)粗酶液制备:称取新鲜叶片0.25 g,加液氮研磨,加入4 mL遇冷的提取液(50 mmol·L-1Tris-HCl,pH 7.8,0.01% (v/v) Triton X-100,1 mmol·L-1EDTA,10 mmol·L-1DTT,10 mmol·L-1MgCl2),冰浴研磨至匀浆,4℃离心(×15 000 g)15 min,取上清液备用。(2)Rubisco活性测定[22]:反应体系:5 mmol·L-1NADH 0.1 mL,50 mmol·L-1ATP 0.1 mL,0.2 mol·L-1NaHCO30.1 mL,0.7 mL反应介质[100 mmol·L-1Tris-HCl,内含12 mmol·L-1MgCl2和0.4 mmol·L-1EDTA·Na2(pH7.8)],160 U·mL-1肌酸磷酸激酶0.05 mL,160 U·mL-1甘油酸磷酸肌酶0.05 mL,160 U·mL-1甘油醛磷酸脱氢酶0.05 mL,蒸馏水0.15 mL。反应体系摇匀,倒入比色杯内,加入紫花苜蓿RuBPCase 0.1 mL,马上计时,每隔30 s测一次吸光度,测3 min。以每分钟内OD340 nm吸光度下降的绝对值计算酶活力。(3)酶活性计算:RuBPCase酶活力=(△A × V)/(2×d×6.22×△t×V酶),△A为反应 3 min内 340 nm处吸光度变化的绝对值,V为反应体系总体积,d (cm)为比色光程,6.22为每微摩尔NADH在340 nm处的吸光度,2表示每固定1 mol CO2有2 mol NADH被氧化,△t为测定时间,V酶为酶液体积,活性单位表示为mmol·mg-1·min-1。
1.3.2RCA活性 称取鲜叶200 mg加液氮研磨,倒入2 mL预冷的离心管,加入预冷的GENMED裂解液500 μL,涡旋震荡5 s使其充分混匀,4℃离心5 min,转速为300 g,取上清液500 μL至1.5 mL离心管,4℃离心10 min,转速为1 000 g。弃上清液,加入200 μL GENMED裂解液,混匀待测。移取10 μL混匀液进行蛋白定量检测,具体步骤及计算方法参见GENMED bradford蛋白质浓度定量试剂盒GMS30030.1说明书。
1.3.3紫花苜蓿的rbcL和rca基因的序列扩增 取紫花苜蓿叶片,采用改良CTAB法[23]提取DNA,对2种紫花苜蓿的rbcL和rca基因进行PCR扩增,rbcL基因扩增的引物[24]为:上游引物5′-ATGTCACCACAAACAGAGACTAAAGC-3′,下游引物5′- GAAACGGTCTCTCCAACGCAT-3′;rca基因扩增的引物[25]为:上游引物5′-GTGTGGCCTCCTATTGGCA-3′,下游引物5′-CTCGGTCTCAAATTCCAG-3′。测序后经NCBI内进行Blast比对,确定基因的同源性,再用DNAMAN 8.0软件进行序列比较,明确该基因的序列特征。引物的合成与测序由上海生工生物工程有限公司完成。
1.3.4实时荧光定量PCR(RT-qPCR)测定rbcL和rca基因的相对表达量 以18S为内参基因,取紫花苜蓿叶片,使用RNA提取试剂盒(华越洋公司)提取总RNA,采用RS232C BioPhotometer核酸蛋白测定仪测定OD260/280检测其纯度,利用试剂盒(AMV First Strand cDNA Synthesis Kit)反转录第一条cDNA链。实时荧光定量PCR反应体系为20 μL体系:SYBR Green qPCR Master Mix (2X) 10 μL,上下游引物(10umol·L-1)各1 μL,cDNA 2 μL,ddH2O 6 μL,在北京罗氏PCR仪(LightCycler 480)中进行反应,反应程序为:95℃预变性3 min,95℃ 15 s,60℃ 40 s,40 个循环。每个处理为3个生物学重复,每个样品3次技术重复,基因相对表达量采用2-△△CT方法计算[26]。以18S基因作为内参基因,上游引物 5′-TTCTTAGTTGGTGGAGCG-ATTT-3′,下游引物5′-CCTGTTATTGCCTCAAACTTCC-3′,目的基因引物同1.3.3。
1.4 数据处理
同一供试材料、不同处理各项指标之间的差异显著(P<0.05)采用单因素方差分析(one-way ANOVA),相同处理条件下不同供试材料之间显著性差异(P<0.05和P<0.01)采用Tukey检验,差异性分析和相关性分析均利用SPSS 20.0 统计分析软件(IBM,NY,USA)完成。作图采用Sigma Plot 10.0 软件(Systat Software,Inc.,Richmond,CA,USA)。
2 结果与分析
2.1 干热胁迫对紫花苜蓿的Rubisco羧化酶和RCA酶活性的影响
如图1所示,随干热胁迫时间的延长,2种紫花苜蓿叶片Rubisco活性呈现先显著下降后显著上升趋势,且在干热胁迫的第8 d达到最低值,此时野生紫花苜蓿的Rubisco活性较胁迫前显著降低了47.49%(P<0.05),‘阿尔冈金’则较胁迫前显著降低了50.00%(P<0.05);2种紫花苜蓿叶片Rubisco活性在复水4 d后比胁迫结束时显著升高,但仍显著低于干热胁迫前;各处理中野生紫花苜蓿的Rubisco活性都极显著高于相应的‘阿尔冈金’(P<0.01)。同时,野生紫花苜蓿叶片RCA活性呈先下降后升高的趋势,最大值出现在第12 d,较胁迫前显著上升了227%(P<0.05),且此时极显著高于相应的‘阿尔冈金’(P<0.01);‘阿尔冈金’叶片的RCA活性则呈先上升后大幅下降的趋势,峰值出现在胁迫后第4 d,较胁迫前显著上升了155%(P<0.05),且此时极显著高于野生紫花苜蓿。在复水4 d后,野生紫花苜蓿叶片RCA活性比胁迫12 d大幅度显著下降,‘阿尔冈金’叶片则显著升高,但2种材料均显著低于胁迫前。

图1 干热胁迫下紫花苜蓿Rubisco和RCA活性的变化
2.2 rbcL和rca基因序列扩增结果
目的基因rbcL和rca的DNA片段电泳检测结果(图2)显示,野生紫花苜蓿的2个基因扩增序列总长分别为633 bp和108 bp,与Genbank中紫花苜蓿Rubisco大亚基rbcL基因序列(MN601455.1)同源性为98%,与蒺藜苜蓿核酮糖二磷酸羧化酶小链3A(Ribulose bisphosphate carboxylase small chain 3A)的预测序列(XM_013592001.2)同源性为94 %;‘阿尔冈金’紫花苜蓿的2个基因扩增序列总长分别为632 bp和108 bp,与紫花苜蓿的rbcL基因序列(MN601455.1)同源性为98%,与蒺藜苜蓿预测序列(XM_013592001.2)的同源性为93%。结果表明2份紫花苜蓿材料的扩增序列可确定为Rubisco大亚基rbcL基因和Rubisco活化酶的rca基因序列。
2.3 干热胁迫下紫花苜蓿Rubisco的rbcL 和 rca 基因的表达水平
如图3所示,野生紫花苜蓿材料的rbcL基因表达量在胁迫前、胁迫初期(4 d)及复水4 d后均显著高于‘阿尔冈金’;同时,野生材料的rca基因表达量在胁迫第4 d和第8 d时也极显著高于同期‘阿尔冈金’(P<0.01)。2个供试材料的rbcL和rca基因相对表达量受干热胁迫的影响均先急剧升高,并均在胁迫的第4 d达到峰值,而后均呈快速下降趋势。结果表明2种紫花苜蓿材料rbcL和rca基因表达量随干热胁迫时间的延长而降低,且野生材料的基因表达水平总体高于‘阿尔冈金’。

图2 rbcL和rca基因PCR扩增电泳图

图3 干热胁迫下紫花苜蓿Rubisco rbcL和rca基因相对表达量
2.4 干热胁迫下紫花苜蓿Rubisco羧化酶及RCA酶活性与基因表达的关系
通过相关性分析(表1)发现,2份紫花苜蓿材料的Rubisco羧化酶、RCA酶活性与相应的rbcL,rca基因表达量之间的相关性均不显著,但rbcL与rca基因相对表达量之间均呈极显著正相关,野生紫花苜蓿和‘阿尔冈金’紫花苜蓿中二者的相关系数分别为0.939(P=0.009)和0.973(P=0.003)。
3 讨论
非生物胁迫可导致植物的Rubisco酶活性降低[27],本研究中出现Rubisco酶活性先下降后升高的现象,可能是Rubisco酶对胁迫条件逐渐适应的表现[28]。虽然2种供试材料的Rubisco酶活性变化趋势相同,但野生紫花苜蓿的Rubisco酶活性总体高于‘阿尔冈金’紫花苜蓿,这可能是由于野生紫花苜蓿长期生长在干热河谷地区[29],能较好的适应干热气候。野生紫花苜蓿在干热条件下虽表现出较高的Rubisco羧化酶活性,但其与光合性能的关系是否存在特殊的耐干热性仍需进行系统地分析。
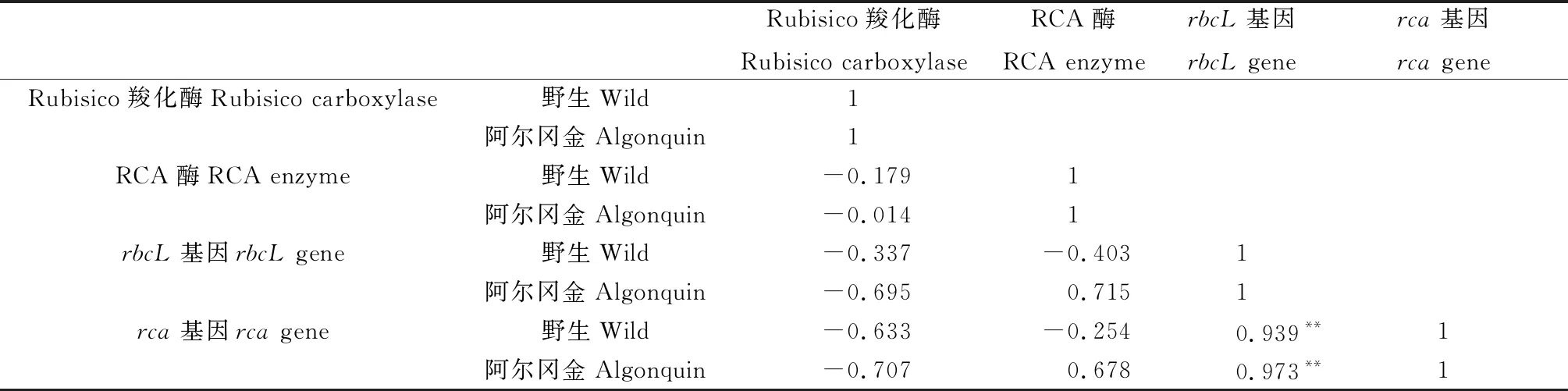
表1 紫花苜蓿Rubisco羧化酶及RCA酶活性与基因表达的相关性分析
‘阿尔冈金’紫花苜蓿的RCA酶活性在干热胁迫第4 d时即达到峰值,但Rubisco酶活性此时仍在下降,可能是受高温影响,Rubisco酶的失活速率超过了RCA促进活化的能力[6],也可以解释为RCA酶的过表达导致Rubisco的含量下降[30-31],或与RCA和Rubisco空间构象的变化、分子伴侣等因素有关[32-33]。野生紫花苜蓿的RCA酶活性在干热胁迫第12 d时达到峰值,虽与Rubisco酶活性变化趋势一致,但野生紫花苜蓿中该酶活性对干热胁迫的响应时间较‘阿尔冈金’晚,推测是由于野生紫花苜蓿中的RCA酶能及时调节Rubisco活性,对干热的环境条件有较好的适应性。
Rubisco大亚基A型与多活性酶全酶复合物的Rubisco活化活性有关[34],本研究中干热胁迫条件下紫花苜蓿的Rubisco羧化酶和RCA酶活性及其基因表达之间没有显著相关性,2种酶的体外活性与基因表达不协调,可能是由于基因转录和蛋白质翻译之间存在滞后性[35],受转录和翻译后修饰的影响,mRNA与蛋白量的变化不一定呈线性的关系[36]。本研究中2个供试紫花苜蓿材料的rbcL和rca基因表达量均随干热胁迫时间的延长而逐渐下调,一方面可能是由于受高温胁迫的影响,(新蛋白合成迅速从Rubisco大亚基的主要表达转变为主要的热休克蛋白[37]),或是因为该基因的分子伴侣[38]蛋白受到胁迫表现为rbcL基因表达量下调;另一方面,有研究表明RCA在抑制茉莉酸(JA)诱导的叶片衰老中发挥了重要作用[39],本研究中对紫花苜蓿叶片相关指标的测定历时半月之久,因此基因表达的下调有可能是由于叶片逐渐衰老引起的。有研究表明AVP1/RCA的协同过量表达可以显著提高拟南芥(Arabidopsisthaliana)在干旱和高温条件下的耐受性[40]。rbcL和rca基因之间呈极显著正相关,推测紫花苜蓿中的这2个基因之间可能存在协同表达,但对于基因的协同表达是否提高了干热胁迫下紫花苜蓿的耐受性,亟需进一步研究。
4 结论
干热胁迫显著影响了2个供试紫花苜蓿Rubisco羧化酶和RCA酶的活性及其相关基因表达,但2种酶活性均与其基因表达之间无显著相关关系,而rbcL与rac基因表达量之间显著正相关。
