用碱从低品位氧化锌矿石中浸出锌
2021-04-08熊顺龙吴兴敏
袁 杰,熊顺龙,吴兴敏,庞 林
(六盘水师范学院,贵州 六盘水 553004)

试验研究了用氢氧化钠浸出低品位氧化锌矿石的反应机制和反应过程热力学,分析多种含锌物相在不同pH条件下的离子分散度,并进行了综合试验验证,以期为低品位氧化锌矿石碱浸处理提供参考信息。
1 试验部分
1.1 试验原料
试验用低品位氧化锌矿石取自云南某冶炼厂,元素分析结果见表1,物相分析结果见表2。矿石经破碎、粉磨后过100目筛,并在真空烘箱中于105 ℃下烘干,备用。
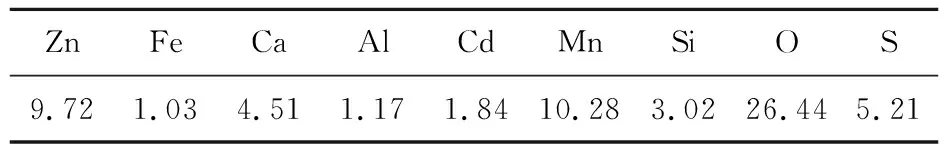
表1 氧化锌矿石的元素分析结果 %
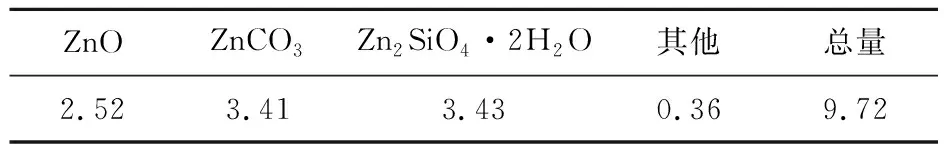
表2 原料中锌物相分析结果 %
氢氧化钠,分析纯,国药集团化学试剂有限公司;水,自制去离子水。
1.2 试验方法
用氢氧化钠加去离子水配制成一定浓度碱液,碱液与氧化锌矿石粉料按恒定液固体积质量比10/1置于塑料烧杯中搅拌混合;反应过程中烧杯放在电磁搅拌恒温水浴锅(DF-101Z/D型,力辰科技)中加热。反应后过滤,滤液中锌离子质量浓度用火焰原子吸收法测定。锌浸出率计算公式为
(1)
式中:η—锌浸出率,%;ρ—浸出液中锌离子质量浓度,g/L;V—浸出液体积,L;m—矿石质量,g;w—矿石中锌质量分数,%。
2 试验结果与讨论
2.1 碱浸反应热力学
氧化锌矿石中的主要含锌物相有ZnO、ZnCO3、 Zn2SiO4·2H2O。为了明确锌化合物在NaOH溶液中可能发生的化学反应,以及反应产生的不同物种在溶液中的分布规律,选择lgα-pH进行表征,α为离子分布率。
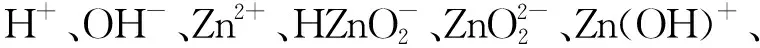
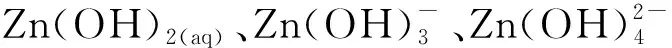

(2)
(3)
(4)

(5)

(6)
(7)
(8)
根据电算-指数方程法,离子浓度表达通式为
[R] =exp(A+B·pH)。
(9)
式中:R—离子或物种;A—常数,由反应式平衡常数求得;B—配合物得失质子数与ln10的乘积。反应式(2)~(8)中各离子或物种的电算指数常数见表3。
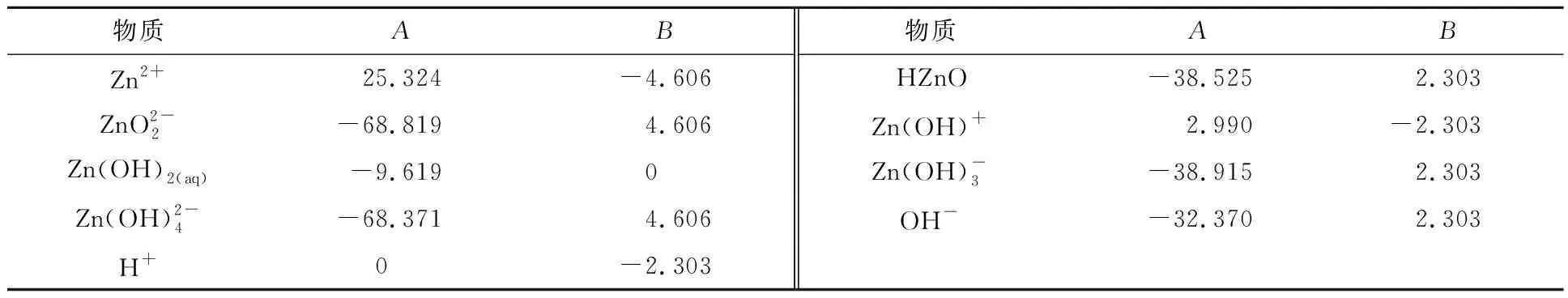
表3 各离子或物种的电算指数常数
对于Zn(Ⅱ)-H2O体系,反应式(2)~(8)中锌物相浓度表达式为:
[Zn2+]=exp(25.324-4.606pH);
(10)
(11)
(12)
[Zn(OH)+]=exp(2.990-2.303pH);
(13)
[Zn(OH)2(aq)]=exp(-9.619);
(14)
(15)
(16)
根据质量守恒定律,溶液中的锌浓度计算公式为
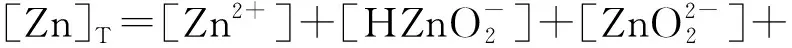
(17)
根据式(10)~(17),绘制Zn(Ⅱ)-H2O体系离子浓度的分布曲线,如图1所示。
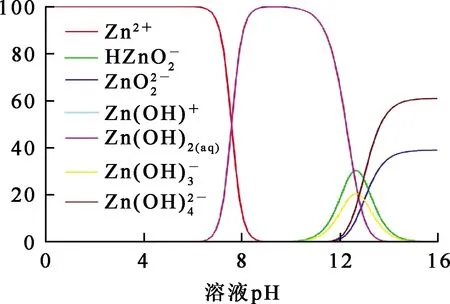
图1 Zn(Ⅱ)-H2O体系离子浓度的分布曲线
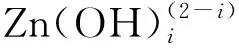
(18)
(19)
同理,可得出ZnCO3、Zn2SiO4·2H2O在NaOH溶液中发生的化学反应为:
(20)
(21)
(22)
(23)
2.2 从低品位矿石中碱浸锌
2.2.1 反应温度对锌浸出的影响
浸出氧化锌矿石粉质量10 g,氢氧化钠溶液100 mL,恒温水浴锅加热,初始碱浓度3 mol/L,电磁搅拌速度400 r/min,反应时间180 min,温度对锌浸出率的影响试验结果如图2所示。
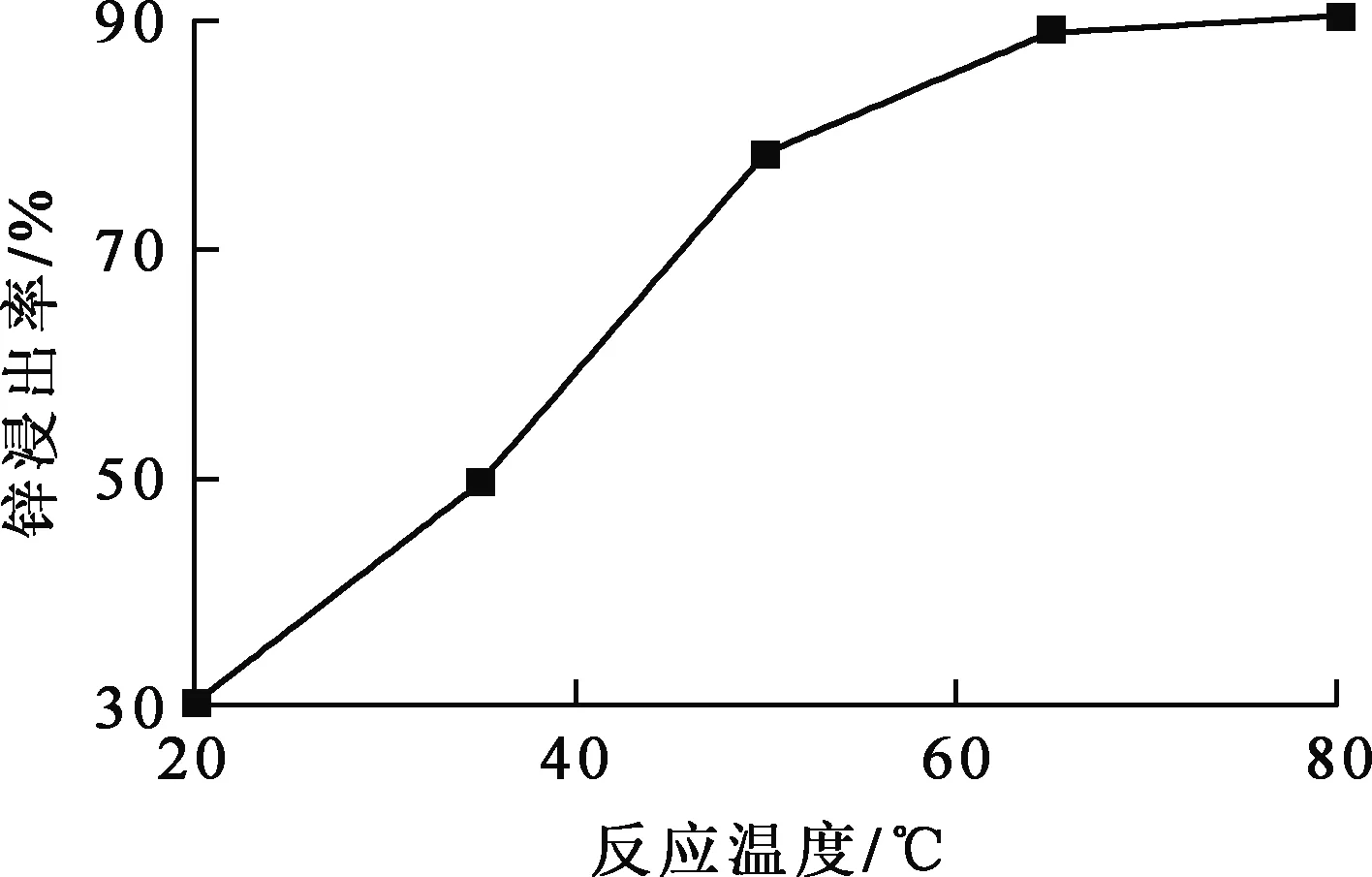
图2 反应温度对锌浸出率的影响
由图2看出,随反应温度升高,锌浸出率提高。温度升高,体系黏度降低,溶液中粒子活性增大,布朗运动增强,粒子扩散速度增大,有利于锌化合物在氢氧化钠溶液中的溶解;温度升高,会有效改善反应体系的动力学条件,反应物接触概率增大,有效加快反应速度,从而实现矿料中锌的溶解浸出。利用软件HSC Chemistry对反应式(18)~(23)的lgK-T进行计算,可以得出:随温度升高,反应平衡常数均呈增大趋势,说明温度对6个反应均具有促进作用;软件热力学计算结果与试验结果相吻合。综合考虑,确定65 ℃为锌浸出反应适宜温度。
2.2.2 反应时间对锌浸出的影响
氧化锌矿石粉质量10 g,氢氧化钠溶液100 mL, 恒温水浴锅加热,反应温度65 ℃,初始碱浓度3 mol/L,电磁搅拌速度400 r/min,反应时间对锌浸出率的影响试验结果如图3所示。
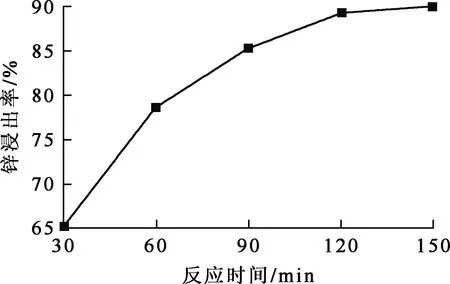
图3 反应时间对锌浸出率的影响
由图3看出,锌浸出率随反应时间延长而提高,从30 min时的65.33%缓慢提高到120 min时的89.32%,而后趋于稳定。适当延长反应时间,有利于反应正向进行得更彻底,综合考虑,确定适宜反应时间为120 min。
2.2.3 初始碱浓度对锌浸出的影响
氧化锌矿石粉质量10 g,氢氧化钠溶液100 mL, 恒温水浴锅加热,反应温度65 ℃,反应时间120 min,电磁搅拌速度400 r/min,初始碱浓度对锌浸出率的影响试验结果如图4所示。
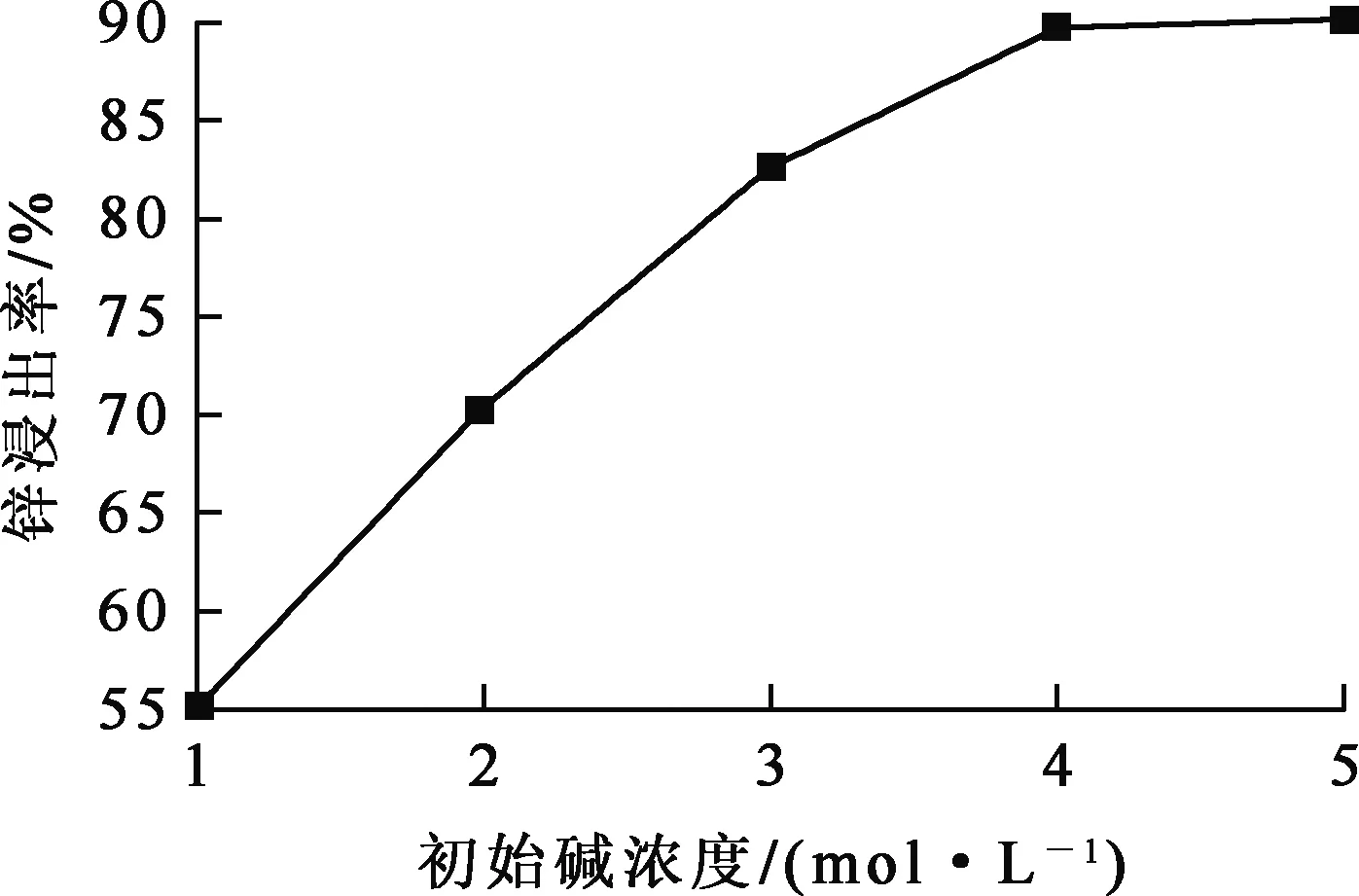
图4 初始碱浓度对锌浸出率的影响
由图4看出:随初始碱浓度增大,锌浸出率提高,初始碱浓度为4 mol/L后趋于稳定;继续增大初始碱浓度,锌浸出率变化不大。综合考虑,确定初始碱浓度以4 mol/L为宜。
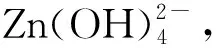
2.2.4 搅拌速度对锌浸出的影响
氧化锌矿石粉质量10 g,氢氧化钠溶液100 mL, 恒温水浴锅加热,反应温度65 ℃,反应时间120 min,初始碱浓度4 mol/L,搅拌速度对锌浸出率的影响试验结果如图5所示。
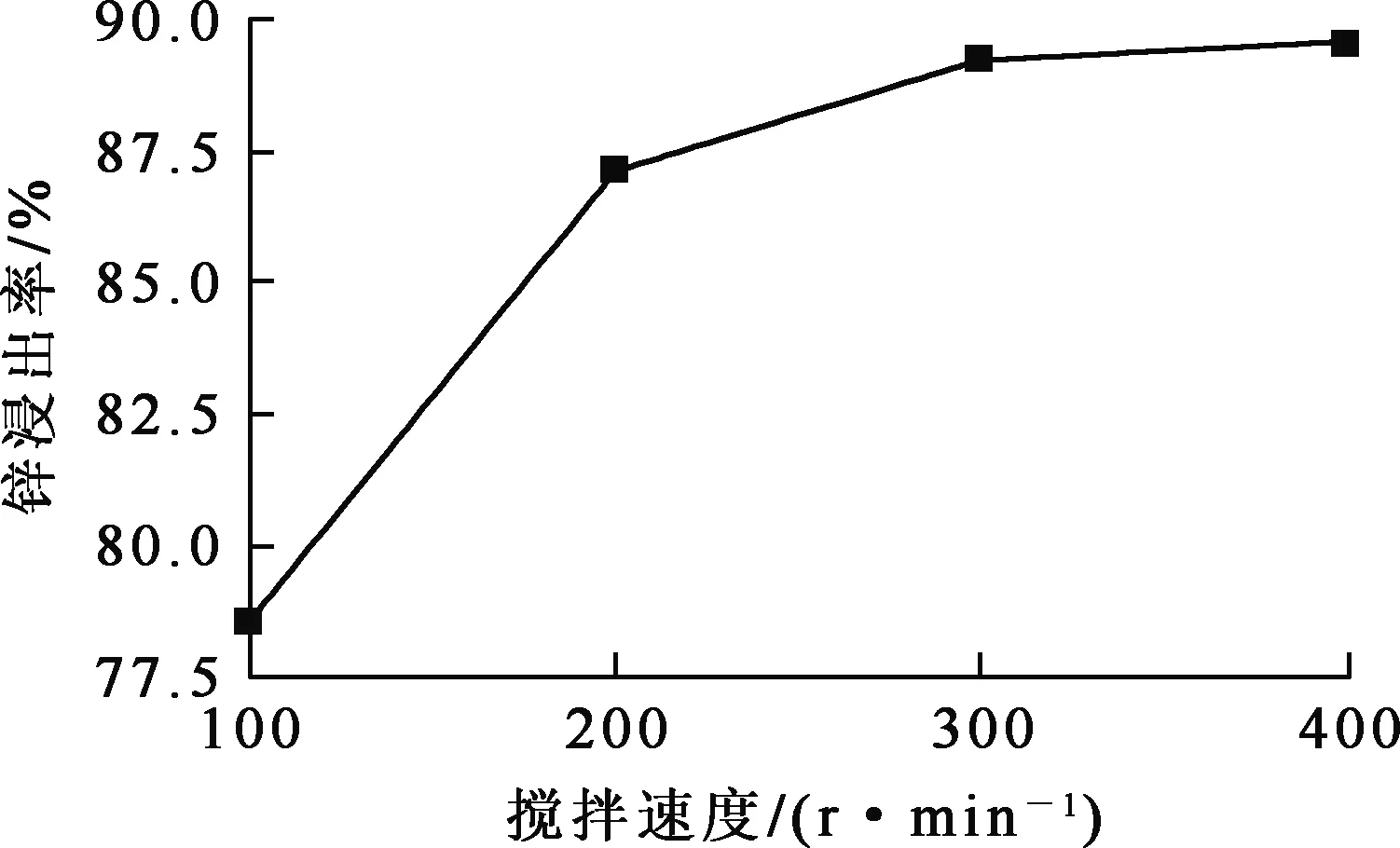
图5 搅拌速度对锌浸出率的影响
由图5看出,随搅拌速度增大,锌浸出率提高。搅拌速度较低时,溶液搅动幅度较小,体系中的固体粉料不能合理分散于溶液中,使得体系上下层物料与碱的相对含量不同,影响反应进行;随搅拌速度增大,矿石颗粒可以被完全搅动并分散在整个体系中,同时固体颗粒表层的扩散层也因此变薄从而有利于碱的扩散进入,反应物接触概率和接触效果均随搅拌速度增大而得到改善;相同时间内,锌化合物与碱的反应增强,锌浸出率增大;搅拌速度增至300 r/min以上时,矿石粉料分散均匀,颗粒表面扩散层厚度不能进一步降低,体系动力学条件不能进一步改善,浸出反应趋于平衡。根据溶液体系中搅拌雷诺数的变化,搅拌速度增大使得溶液逐渐由低搅拌速度时的层流经由过渡流转变为紊流,而紊流状态并不利于反应进行,因此,搅拌速度以不高于300 r/min为宜。
2.3 综合试验
在上述单因素试验所得适宜条件(搅拌速度300 r/ min,反应温度65 ℃,反应时间120 min,初始碱浓度4 mol/L,液固体积质量比10/1)下进行综合试验,重复进行3次,试验结果如图6所示。可以看出:3次试验的锌浸出率相差较小,平均为90.08%,浸出效果较好。
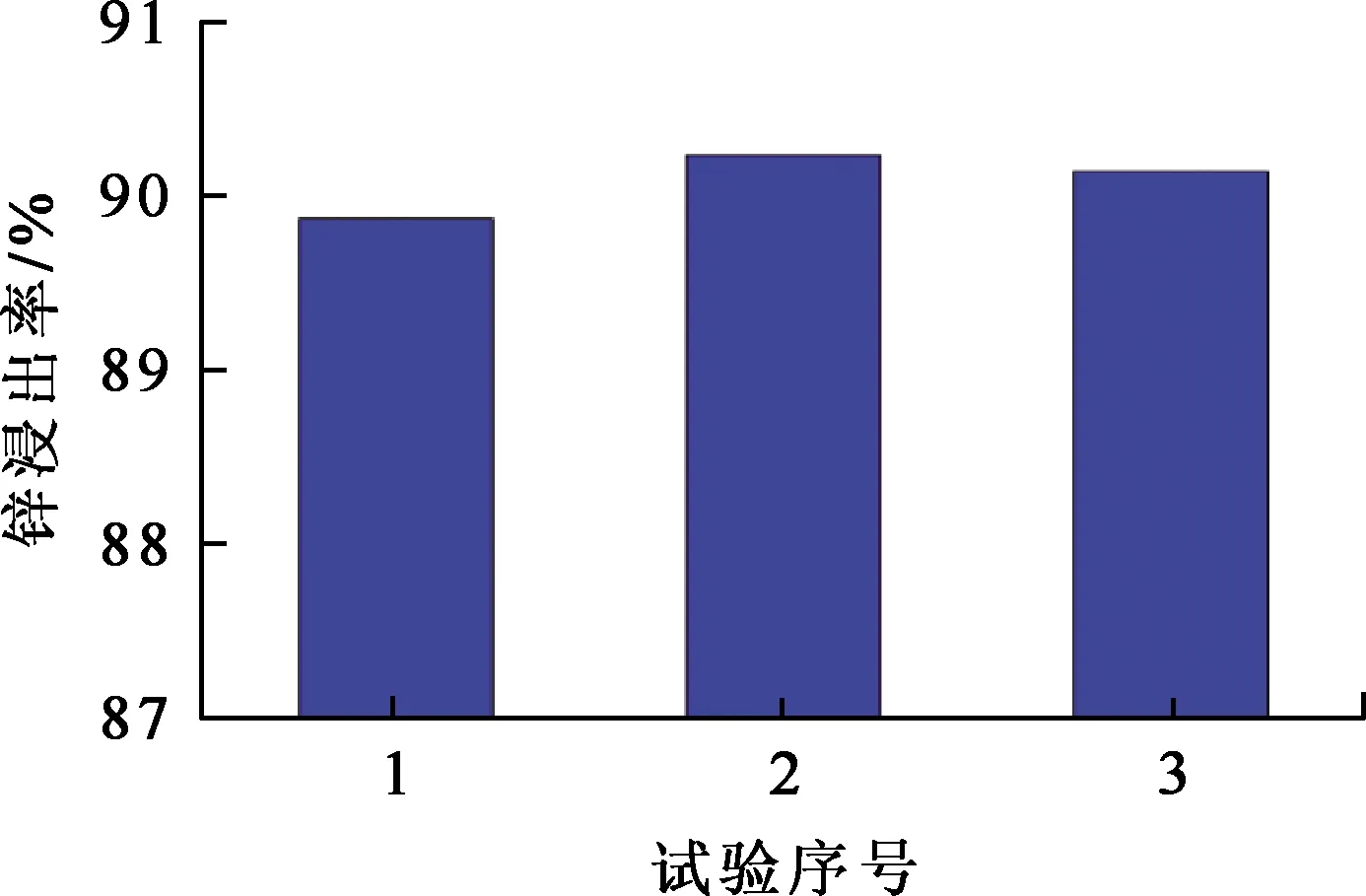
图6 综合试验结果
3 结论
用氢氧化钠溶液从低品位氧化锌矿石中浸出锌,效果较好,适宜条件下,3次试验得到锌浸出率为90.08%。此方法工艺简单,操作简便,生产环境较好,矿石中的锌可得到有效回收,对于从低品位氧化锌矿石中回收锌有一定参考价值。
