富马酸替诺福韦二吡呋酯治疗乙型肝炎肝硬化临床评价*
2021-04-08肖婷婷
孙 宏,刘 冰,肖婷婷
(四川绵阳四2四医院,四川 绵阳 621000)
我国为乙型肝炎(简称乙肝)高发区,乙肝可发展为肝硬化、肝功能衰竭甚至肝细胞癌,肝硬化人数随着乙肝人数的增加而增长[1]。乙肝肝硬化患者肝功能受损、肝细胞损害甚至细胞坏死,会出现肝病面容、黄疸、肢体水肿、胸腹腔积液、恶心呕吐等表现,部分患者有贫血及出血症状,严重危害身心健康[2]。肝硬化代偿期5 年生存率为86%,进展至失代偿期则降为14%[3]。治疗乙肝的抗病毒药物主要为干扰素及核苷酸类似物,核苷酸类似物优点有抑制病毒能力强、使用方便、不良反应较少等[4],如富马酸替诺福韦二吡呋酯(TDF)的主要优点有零耐药率、母婴阻断安全性好[5]。本研究中探讨了TDF治疗乙肝肝硬化的临床疗效及对患者乙型肝炎病毒脱氧核糖核酸(HBV-DNA)水平、乙型肝炎病毒标志物(HBV-M)、淋巴细胞水平的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《慢性乙型肝炎防治指南(2015 更新版)》[6]诊断标准,并经B 超等影像学检查确诊;年龄20 ~75 岁。本研究经医院医学伦理委员会批准,患者签署知情同意书。
排除标准:非乙肝肝硬化、乙肝;酒精性或自身免疫性肝病,或进展为肝癌;严重脏器功能障碍;精神异常;妊娠期或哺乳期。
病例选择与分组:选取医院2017 年2 月至2018 年4 月收治的乙肝肝硬化患者84 例,采用随机数字表法分为研究组和对照组,各42 例。两组患者一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表 1。
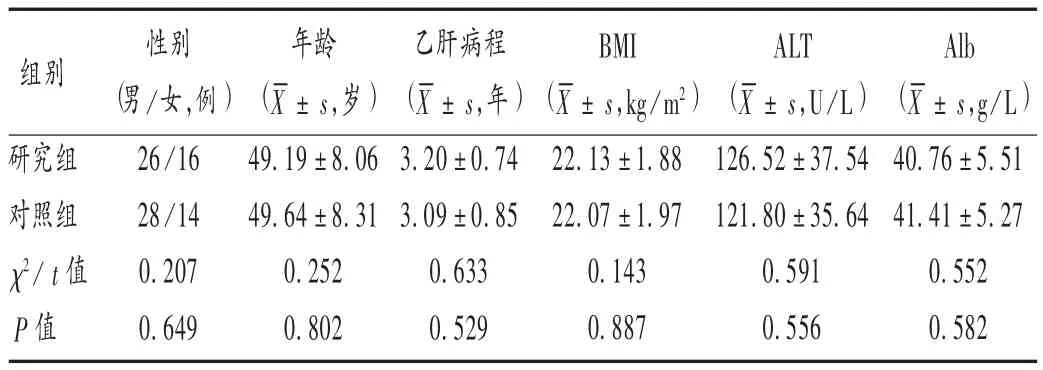
表1 两组患者一般资料比较(n =42)Tab.1 Comparison of the patients′ general data between the two groups(n = 42)
1.2 方法
两组患者均予常规护肝措施及支持治疗。对照组患者给予拉米夫定片(吉斯凯<苏州>制药有限公司,国药准字 H20030581,规格为每片 0.1 g)口服,每次 1 片,每日1 次,饭前或饭后服用。研究组患者给予富马酸替诺福韦二吡呋酯片(葛兰素史克制药<天津>有限公司,国药准字 H20153090,规格为每片 0.3 g)口服,每次1 片,每日1 次。两组均持续治疗48 周。
1.3 观察指标
采用酶联免疫吸附(ELISA)法测定HBV-M,包括乙型肝炎病毒e 抗原(HBeAg)及乙型肝炎病毒e 抗体(HBeAb),并分别计算转阴率及转阳率。采用罗氏LightCy-cler480 荧光定量聚合酶链反应(PCR)仪检测HBV-DNA 表达水平;采用EPICS XL 型流式细胞分析仪(美国 Beckman Coulter 公司)及 SYSTEM Ⅱ软件检测 CD4+,CD8+水平,并计算 CD4+/ CD8+;采用放射免疫法检测透明质酸(HA)、层粘连蛋白(LN)、Ⅳ型胶原(CⅣ)等肝纤维化指标水平;采用ELISA 法检测超敏C 反应蛋白(hs-CRP)、白细胞介素 6(IL-6)、白细胞介素9(IL-9)水平;采用流式细胞分析仪检测辅助性T 细胞9(Th9)水平。记录患者用药期间不良反应发生情况。
1.4 统计学处理
采用SPSS 19.0 统计学软件分析。计数资料以率(% )表示,行 χ2检验;计量资料以表示,行 t 检验。P < 0.05 为差异有统计学意义。
2 结果
结果见表2 至表5。两组患者药物耐受性均良好,血肌酐、乳酸脱氢酶、肌酸激酶均无明显升高,且无明显肌痛、骨痛等症状,有3 例出现血磷轻度下降,予以对症治疗后症状消失。
3 讨论
乙肝肝硬化治疗重点为慢性乙肝抗病毒及抗肝纤维化治疗。研究发现,核苷类药物治疗乙肝效果较好[7]。其进入机体后转化为磷酸核苷类似物,抑制乙肝病毒聚合酶逆转录酶的活性,从而抵抗乙肝病毒[8]。替诺福韦通过肠道吸收进入细胞,在磷酸激酶作用下转化为活性二磷酸,与5′-三磷酸脱氧腺苷酸竞争性结合HBVDNA 逆转录酶,从而影响 HBV-DNA 正常合成;且TDF 抑制乙肝病毒复制的效率更高,能使HBeAg 阳性或阴性患者迅速获得病毒学应答[9]。本研究结果显示,研究组患者HBV-M 及HBV-DNA 水平均明显优于对照组。
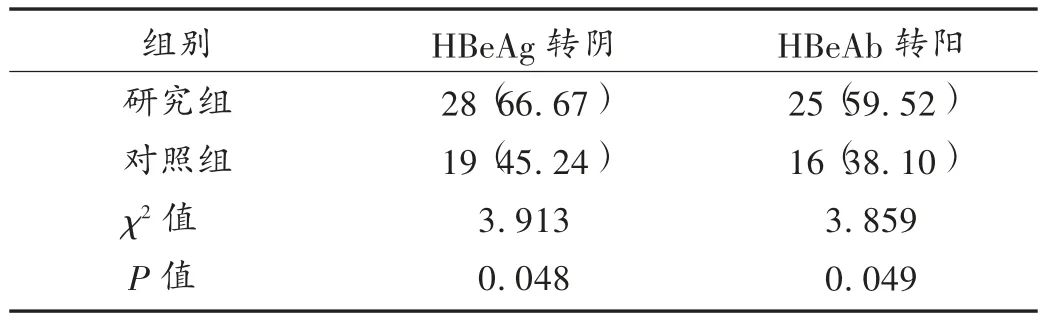
表 2 两组患者 HBV-M 比较[例(%),n =42]Tab.2 Comparison of HBV-M between the two groups[case(%),n = 42]
表3 两组患者淋巴细胞及HBV-DNA 水平比较(,n = 42)Tab.3 Comparison of lymphocytes and HBV-DNA levels between the two groups(,n = 42)
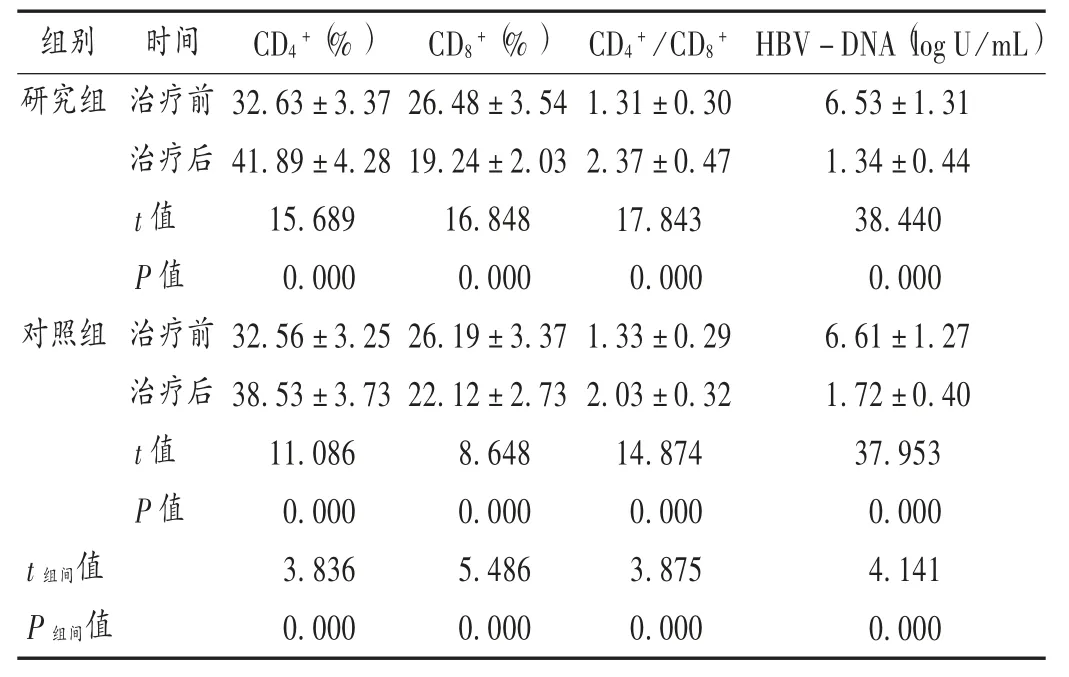
表3 两组患者淋巴细胞及HBV-DNA 水平比较(,n = 42)Tab.3 Comparison of lymphocytes and HBV-DNA levels between the two groups(,n = 42)
组别 时间CD4+(% )CD8+(% )CD4+ /CD8+HBV-DNA(log U /mL研究组对照组治疗前治疗后t 值P 值治疗前治疗后t 值P 值t 组间值P 组间值32.63 ± 3.37 41.89 ±4.28 15.689 0.000 32.56 ±3.25 38.53 ± 3.73 11.086 0.000 3.836 0.000 26.48 ± 3.54 19.24 ±2.03 16.848 0.000 26.19 ±3.37 22.12 ± 2.73 8.648 0.000 5.486 0.000 1.31 ± 0.30 2.37 ± 0.47 17.843 0.000 1.33 ± 0.29 2.03 ± 0.32 14.874 0.000 3.875 0.000 6.53 ± 1.31 1.34 ± 0.44 38.440 0.000 6.61 ± 1.27 1.72 ± 0.40 37.953 0.000 4.141 0.000)
表4 两组患者肝纤维化指标水平比较(,μg /L,n =42)Tab.4 Comparison of liver fibrosis indicators between the two groups(,μg /L,n = 42)
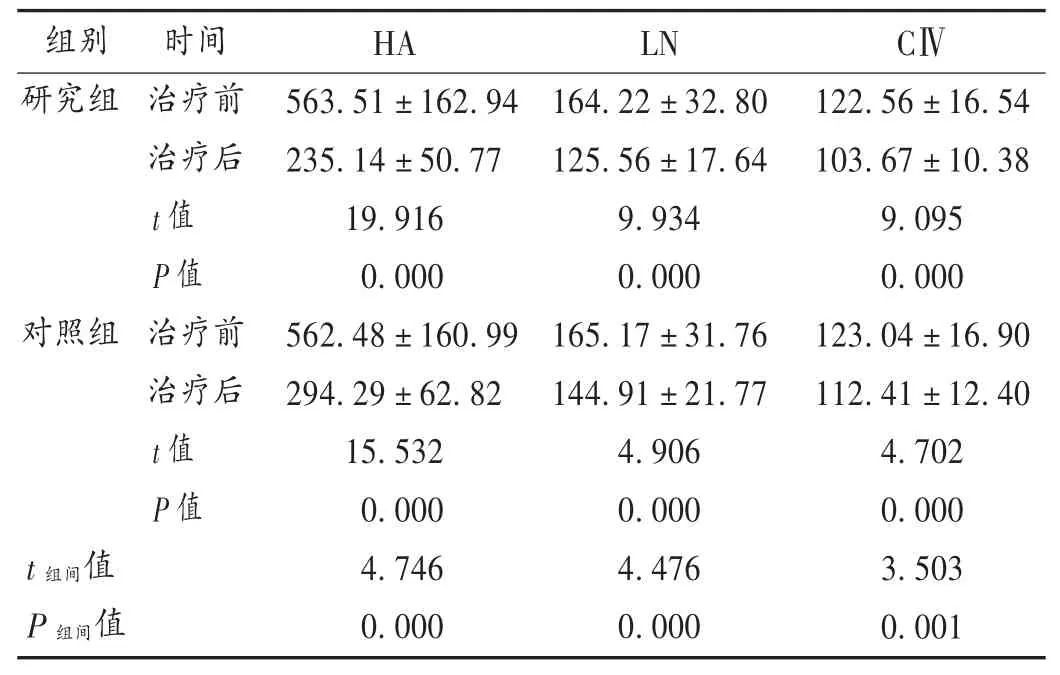
表4 两组患者肝纤维化指标水平比较(,μg /L,n =42)Tab.4 Comparison of liver fibrosis indicators between the two groups(,μg /L,n = 42)
组别 时间HA LN CⅣ研究组 治疗前治疗后t 值P 值对照组 治疗前治疗后t 值P 值t 组间值P 组间值563.51 ± 162.94 235.14 ± 50.77 19.916 0.000 562.48 ± 160.99 294.29 ± 62.82 15.532 0.000 4.746 0.000 164.22 ± 32.80 125.56 ± 17.64 9.934 0.000 165.17 ± 31.76 144.91 ± 21.77 4.906 0.000 4.476 0.000 122.56 ± 16.54 103.67 ± 10.38 9.095 0.000 123.04 ± 16.90 112.41 ± 12.40 4.702 0.000 3.503 0.001
表5 两组患者疾病相关因子水平比较(,n = 42)Tab.5 Comparison of disease-related factors levels between the two groups(,n = 42)
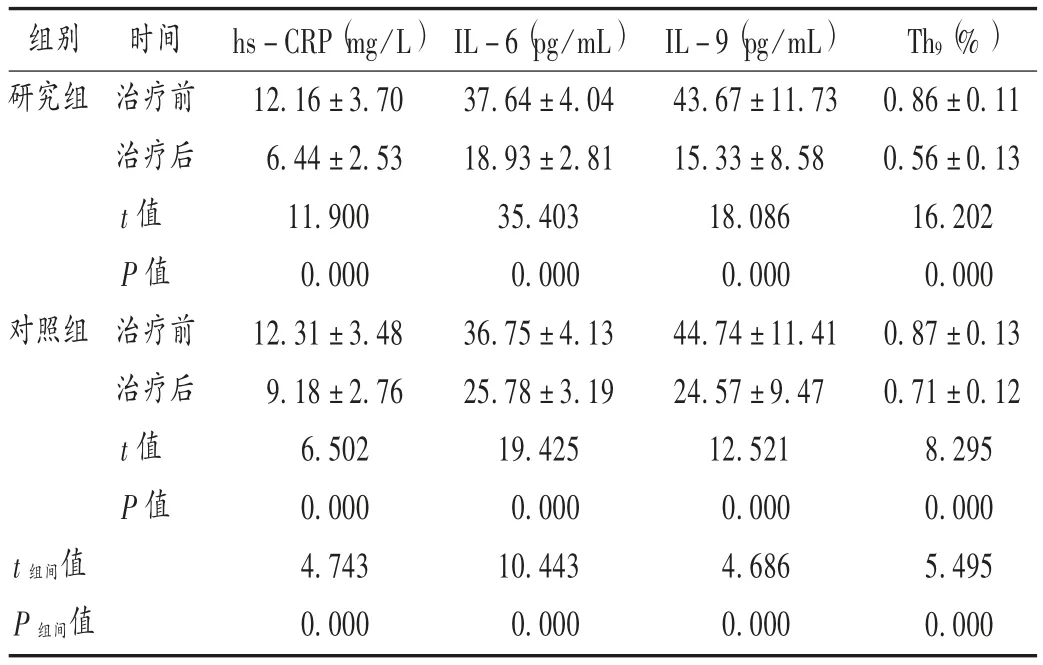
表5 两组患者疾病相关因子水平比较(,n = 42)Tab.5 Comparison of disease-related factors levels between the two groups(,n = 42)
组别研究组对照组时间治疗前治疗后t 值P 值治疗前治疗后t 值P 值t 组间值P 组间值hs-CRP(mg/L)12.16 ±3.70 6.44 ±2.53 11.900 0.000 12.31 ±3.48 9.18 ±2.76 6.502 0.000 4.743 0.000 IL-6(pg/mL)37.64 ±4.04 18.93 ±2.81 35.403 0.000 36.75 ±4.13 25.78 ±3.19 19.425 0.000 10.443 0.000 IL-9(pg/mL)43.67 ±11.73 15.33 ±8.58 18.086 0.000 44.74 ±11.41 24.57 ±9.47 12.521 0.000 4.686 0.000 Th9(% )0.86 ±0.11 0.56 ±0.13 16.202 0.000 0.87 ±0.13 0.71 ±0.12 8.295 0.000 5.495 0.000
机体清除乙肝病毒时,T 淋巴细胞亚群起到了重要作用,其中CD4+T 淋巴细胞能识别主要组织相容性复合物(MHC)Ⅱ类分子提供的外源性抗原肽,活化后分化成Th 细胞;CD8+T 淋巴细胞能识别MHCⅠ类分子提供的外源性抗原肽,活化后分化成细胞毒性T 淋巴(CTL)细胞[10]。当机体感染乙肝病毒后,病毒在机体复制产生病毒蛋白,细胞内MHCⅠ类分子与之结合成为复合物,此复合物能被T 淋巴细胞特异性抗原识别,激活CD8+T 淋巴细胞,进而对肝细胞产生损害。CD4+T 淋巴细胞能介导B 淋巴细胞的激活过程,促进B 淋巴细胞产生,以清除乙肝病毒。研究组患者治疗后的淋巴细胞亚群水平改善程度较对照组大,提示TDF 能有效改善乙肝肝硬化患者机体的免疫功能。
肝硬化的主要发病机制是进行性纤维化,而抑制肝纤维化是改善肝脏代谢及预后的关键[11]。本研究结果显示,研究组治疗后肝纤维化指标水平均明显低于对照组,提示TDF 改善乙肝肝硬化患者的肝纤维化程度效果良好,有助于延缓肝硬化进展。乙肝病毒侵袭机体时会导致机体产生大量炎性因子及代谢物,激活机体免疫应答反应,使其在清除乙肝病毒时引起肝脏损伤[12]。因此在感染乙肝病毒引起慢性肝炎的过程中,hs-CRP,IL-6,IL-9 等细胞因子均会参与。Th9细胞通过分泌IL-9 并与相应受体结合发挥多种作用。IL-9 为双向多效性细胞因子,Th9通过IL-9 参与多种疾病的病理生理过程。使用抗IL-9 抗体中和IL-9 能调节IL-17 水平,Th17分泌的IL-23 可抑制IL-9 的产生。本研究结果显示,治疗后两组患者 hs-CRP,IL-6,IL-9,Th9水平均较治疗前明显下降,且研究组明显低于对照组,提示TDF 有减轻炎性反应的作用。TDF 主要经过肾小球过滤及肾小管主动转运系统排泄,长期服用易发生肾功能不全及低磷酸盐血症,本研究中患者均有良好的耐受性,仅有3 例患者血磷轻度下降,经补磷治疗后纠正,提示应用TDF 对血磷影响较轻微,但需进一步随访。
综上所述,TDF 能有效改善乙肝肝硬化患者HBV-M 和HBV-DNA 及淋巴细胞水平,降低肝纤维化程度及机体炎性水平。
