绞股蓝中1个新的葫芦烷型皂苷类化合物
2021-04-07娄云云黄亚萍殷志琦
娄云云,牟 龙,黄亚萍,张 健,殷志琦,潘 珂
•化学成分 •
绞股蓝中1个新的葫芦烷型皂苷类化合物
娄云云1, 2,牟 龙2,黄亚萍2,张 健3,殷志琦2,潘 珂1*
1. 中国药科大学中药学院 天然药物化学系,江苏 南京 211198 2. 中国药科大学中药学院 中药制药系&天然药物活性组分与药效国家重点实验室,江苏 南京 210009 3. 江苏省中医药研究院转化医学实验室,江苏 南京 210028
对绞股蓝的总皂苷提取物进行化学成分研究。综合应用多种色谱技术进行分离纯化,通过各种现代谱学技术对化合物进行结构鉴定。从绞股蓝的总皂苷提取物中分离得到2个葫芦烷型三萜皂苷类化合物,分别鉴定为葫芦素L-2--{[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基-(1→3)]-β--吡喃葡萄糖基}-25--β--吡喃木糖苷(1)、葫芦素L-2--[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基-(1→3)]-β--吡喃葡萄糖苷(2)。化合物1为1个新化合物,命名为绞股蓝葫芦皂苷A。
绞股蓝;绞股蓝属;葫芦烷型;三萜皂苷;绞股蓝葫芦皂苷A;葫芦素L-2--[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基-(1→3)]-β--吡喃葡萄糖苷
绞股蓝(Thunb.) Makino,别名五爪龙、七叶参、公罗锅底,葫芦科(Cucurbitaceae)绞股蓝属Bl.草本植物,生于海拔300~3200 m的灌丛、路旁草丛、山谷密林和山坡疏林中。主要分布于我国陕西南部和长江以南各省,以及韩国、日本、马来西亚等地[1-2]。绞股蓝作为药食两用植物,有着“南方人参”的美誉,不仅具有清热解毒、止咳祛痰的功效[1],还具有治疗高脂血症、病毒性肝炎、慢性胃肠炎等功效[2],而且在东南亚国家长期以来被广泛用作蔬菜、凉茶和膳食补充剂[3]。化学成分研究表明,绞股蓝中含有皂苷、黄酮、甾体、多糖、氨基酸等多种化学成分[4-6]。其中绞股蓝皂苷被认为是绞股蓝的主要生物活性成分,目前已报道200余个绞股蓝皂苷,其中8个皂苷为人参皂苷,其结构类型均为达玛烷型四环三萜皂苷[5]。周文超等[7]首次从绞股蓝种子中分离纯化并鉴定得到葫芦烷型皂苷单体化合物,丰富了绞股蓝皂苷的结构类型。现代药理学研究表明,绞股蓝皂苷具有调血脂、保肝、抗肿瘤、改善认知功能障碍、抗炎等广泛药理活性[3-4,8-11],显示出良好的应用前景。本研究旨在深入挖掘绞股蓝总皂苷提取物中的活性成分,从中分离纯化获得2个葫芦烷型三萜皂苷,分别鉴定为葫芦素L-2--{[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基- (1→3)]-β--吡喃葡萄糖基}-25--β--吡喃木糖苷(cucurbitacin L-2--{[a--rhamnopyranosyl-(1→2)][a--arabinopyranosyl-(1→3)]-β--glucopyranosyl}- 25--β--xylopyranoside,1)、葫芦素L-2--[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基- (1→3)]-β--吡喃葡萄糖苷(cucurbitacin L-2--[a--rhamnopyranosyl-(1→2)][a--arabinopyranosyl- (1→3)]-β--glucopyranoside,2)。其中化合物1为新化合物,命名为绞股蓝葫芦皂苷A,化合物2为前人报道的从绞股蓝种子中分离得到的葫芦烷型皂苷。
1 仪器与材料
岛津UV-2550型紫外可见分光光度计(日本岛津公司);鲁道夫Autopol IV旋光仪(美国鲁道夫公司);布鲁克Tensor 27型红外光谱仪(德国布鲁克公司);布鲁克Avance-300及Avance-500型核磁共振波谱仪;安捷伦Q-TOF-6520型质谱仪(美国安捷伦公司);安捷伦1260 Infinity 高效液相色谱仪;LabAlliance半制备液相色谱仪(美国SSI/LabAlliance 公司),半制备柱为COSMOSIL 5C18-AR-II(日本COSMOSIL公司);100~200目和200~300目硅胶(青岛海洋化工厂);ODS RP-18硅胶和硅胶60 F254薄层色谱板(德国Merck公司);ODS填料(日本YMC公司);MCI填料(日本三菱化学公司);甲醇、乙腈(色谱级,上海星可高纯溶剂有限公司),实验用水(杭州娃哈哈集团有限公司),-半胱氨酸甲酯盐酸盐(九鼎化学上海科技有限公司),邻甲苯异硫氰酸酯(上海安耐吉化学有限公司),-葡萄糖、-阿拉伯糖、-鼠李糖、-木糖(德国Merck公司),其他化学试剂均为分析纯。
湖南产地绞股蓝总皂苷提取物(批号T20170203)由湖南华宝通制药有限公司提供,为绞股蓝地上部分(带果实)总皂苷提取物,原植物由中国药科大学中药学院秦民坚教授鉴定为绞股蓝(Thunb.) Makino,植物标本(20161108)保存于中国药科大学中药制药系。
2 提取与分离
取湖南产地绞股蓝总皂苷提取物70.0 g,每次使用10倍量的甲醇超声提取20 min,提取5次,合并提取液,滤过,浓缩,干燥,最终得到2个部位(纯甲醇不溶部位Fr. 1和纯甲醇可溶部位Fr. 2)。Fr.2(50.5 g)经10%减活硅胶(取1000 g硅胶加入100 mL水,于摇床上混匀24 h)柱色谱,以三氯甲烷-甲醇-水(100∶0∶0→0∶100∶0)梯度洗脱,得到5个流分(Fr. 2a~2e)。Fr. 2e(10.5 g)采用10倍量的甲醇超声提取20 min,提取5次,合并提取液,滤过,浓缩,干燥,得到2个流分(纯甲醇不溶组份Fr. 2e1和纯甲醇可溶组份Fr. 2e2)。Fr.2e2进一步通过MCI柱色谱分离,以甲醇-水(5∶95→100∶0)梯度洗脱,得到8个流分(Fr. 2e2a~2e2h),随后Fr. 2e2c经ODS反相柱色谱,甲醇-水(5∶95→100∶0)梯度洗脱得到5个流分(Fr. 2e2c1~2e2c5)。Fr. 2e2c4再经过半制备液相分离纯化,乙腈-水(21∶79)等度洗脱,得到化合物1(R=42 min,65 mg)和2(R=53 min,30 mg)。
3 酸水解和液相分析
称取化合物1(3.0 mg),加入2 mol/L HCl(2.0 mL)、密封,于90 ℃反应3 h。反应液冷却后,将反应混合物用水稀释至5 mL,用醋酸乙酯(5 mL×3)萃取,然后将水层浓缩得到单糖部分,与标准糖(-葡萄糖、-阿拉伯糖、-木糖和-鼠李糖)进行薄层比较,Rf值相同。接下来,将水解得到的单糖部分和标准糖分别溶于含有-半胱氨酸甲酯盐酸盐(2 mg)的吡啶(1 mL)中,并在60 ℃下加热反应1 h。接着,加入邻甲苯异硫氰酸酯(2 mg),并将溶液在60 ℃下继续保持1 h。对反应混合物进行HPLC分析 [Agilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-水(25∶75),体积流量1.0 mL/min,检测波长为250 nm,柱温为35 ℃,进样量为10 μL]。通过比较标准糖衍生物和样品单糖衍生物的保留时间(R),确定化合物中单糖的绝对构型(-葡萄糖11.59 min,-阿拉伯糖13.37 min,-木糖13.74 min,-鼠李糖20.93 min)。
4 结构鉴定
化合物1:白色无定型粉末,易溶于甲醇、吡啶等有机溶剂。[α]20 D–53.0°(0.1, MeOH)。在紫外灯254 nm下有暗斑,香草醛-浓硫酸反应显棕黄色,Liebermann-Burchard和Molish反应均呈阳性,酸水解及衍生化HPLC检出-葡萄糖、-鼠李糖、-阿拉伯糖和-木糖。HR-TOF-MS显示准分子离子峰: 1 106.537 0 [M+NH4]+(计算值1 106.537 8),提示该化合物分子式为C52H80O24,相对分子质量为1088,不饱和度为13。UV光谱显示其在254.5 nm处有最大吸收;IR光谱显示该化合物含有羟基吸收峰(3398 cm−1)以及C-H键(2976,2932 cm−1)、C=O键(1691 cm−1)、C=C键(1646 cm–1)的伸缩振动吸收峰。
1H-NMR谱中显示该化合物含有2个烯氢信号6.40 (1H, d,= 2.5 Hz), 5.64 (1H, brs),1个连氧次甲基氢信号4.90 (1H, overlapped),8个甲基单峰氢信号1.63, 1.57, 1.43, 1.40, 1.40, 1.38, 1.21, 1.01。13C-NMR谱显示该化合物有52个碳信号,其中216.1, 214.2, 196.9为3个羰基碳信号,147.0, 137.4, 121.3, 121.3为2对烯碳信号,27.8, 27.7, 27.6, 25.8, 21.1, 20.8, 20.5, 18.8为8个甲基碳信号。以上特征信号提示化合物1的苷元结构为葫芦烷型三萜[12-13]。此外,1H-NMR谱中显示5.59 (1H, d,= 7.5 Hz), 4.95 (1H, d,= 7.5 Hz), 4.89 (1H, d,= 7.5 Hz) 的糖端基氢信号,偶合常数提示苷键为β或α-型,且13C-NMR谱也显示了相应的端基碳信号105.8、99.8、98.5以及糖环上其他碳信号。而6.22 (1H, brs) 的糖端基氢信号、甲基双峰氢信号1.77 (3H, d,= 6.5 Hz),结合其糖端基碳信号103.2和甲基碳信号19.2,进一步证实了α--鼠李糖基的存在。结合上述信息,并与本实验分离得到的化合物2以及文献报道的碳氢数据对照,进一步证实了化合物1中β--葡萄糖基、α--阿拉伯糖基、α--鼠李糖基和β--木糖基的存在,并且苷元2位的糖链与文献中报道一致[7]。
通过HSQC将化合物1的碳氢相关信号进行归属,再结合1H-1H COSY、TOCSY、HMBC谱(图1)数据确定其平面结构。利用TOCSY谱并分别从4个糖端基氢出发,得到4个糖基的自旋偶合体系和碳氢信号归属。糖的连接位置和顺序进一步通过HMBC谱加以确定,H5.59(H-1′)与C147.0(C-2)相关,证实葡萄糖基Glc′连接在苷元的C-2位,H6.22 (H-1′′) 与C78.4 (C-2′) 相关,H4.95 (H-1′′′)与C88.3 (C-3′) 相关,说明化合物1的C-2位糖链为Rha′′-(1→2)-Ara′′′-(1→3)-Glc′;H4.89 (H-1′′′′) 与C77.1 (C-25) 的相关信号证实木糖基Xyl′′′′连接在苷元的C-25位。化合物的相对构型通过NOESY谱(图2)确定。H4.90 (H-16) 与H1.21 (H-18)有相关信号,说明H-16为β构型;H1.63 (H-21)、H1.57 (H-30) 与H3.00 (H-17) 均有相关信号,结合已报道葫芦烷型相关衍生物关于C-20位构型的确定及相关NOESY信号分析[13-14],进一步证实C-20的构型为。

图1 化合物1的关键1H-1H COSY (━) 和HMBC (H→C) 相关
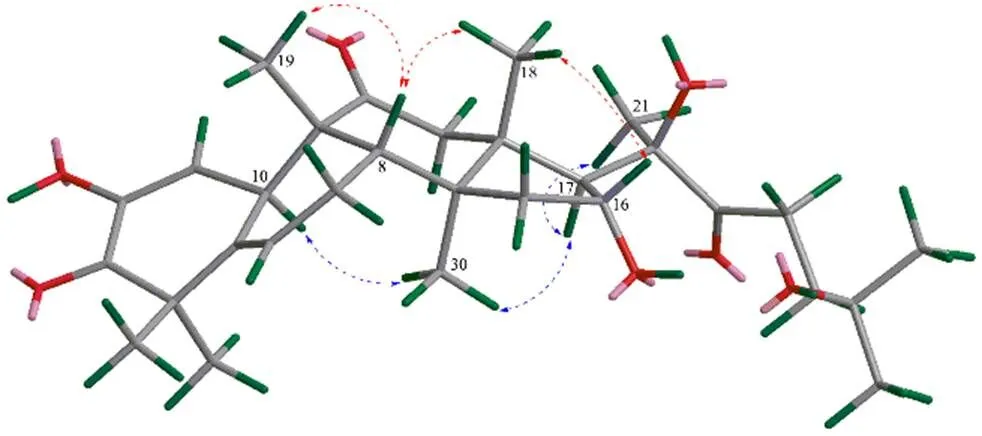
图2 化合物1苷元部分的关键NOESY相关
综合上述信息,确定化合物1的结构为葫芦素L-2--{[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基-(1→3)]-β--吡喃葡萄糖基}-25--β--吡喃木糖苷,为1个新化合物,命名为绞股蓝葫芦皂苷A。结构见图3,NMR数据见表1。
化合物2:白色无定形粉末,易溶于甲醇、吡啶等有机溶剂;在紫外灯254 nm下有暗斑;香草醛-浓硫酸反应显棕黄色;ESI-MS: 955 [M-H]−。1H-NMR (500 MHz, C5D5N): 6.41 (1H, d,= 2.5 Hz, H-1), 6.21 (1H, brs, H-1′′), 5.66 (1H, brs, H-6), 5.58 (1H, d,= 7.5 Hz, H-1'), 4.95 (1H, d,= 8.0 Hz, H-1'''), 2.99 (1H, d,= 7.0 Hz, H-17), 1.64 (3H, s, H-21), 1.54 (3H, s, H-30), 1.42 (3H, s, H-29), 1.41 (3H, s, H-28), 1.39 (3H, s, H-27), 1.39 (3H, s, H-26), 1.21 (3H, s, H-18), 1.02 (3H, s, H-19);13C-NMR (125 MHz, C5D5N): 121.4 (C-1), 147.0 (C-2), 196.9 (C-3), 50.1 (C-4), 137.4 (C-5), 121.3 (C-6), 24.3 (C-7), 42.2 (C-8), 49.6 (C-9), 36.0 (C-10), 214.2 (C-11), 50.1 (C-12), 51.3 (C-13), 49.1 (C-14), 46.9 (C-15), 70.7 (C-16), 59.4 (C-17), 20.7 (C-18), 20.5 (C-19), 80.5 (C-20), 25.9 (C-21), 216.5 (C-22), 33.2 (C-23), 38.9 (C-24), 69.5 (C-25), 30.2 (C-26), 30.5 (C-27), 21.1 (C-28), 27.7 (C-29), 18.7 (C-30);C2-Glc′: 98.5 (C-1′), 78.6 (C-2′), 88.3 (C-3′), 69.0 (C-4′), 78.4 (C-5′), 62.0 (C-6′);Rha′′: 103.2 (C-1′′), 72.8 (C-2′′), 73.2 (C-3′′), 74.6 (C-4′′), 70.4 (C-5′′), 19.2 (C-6′′);Ara′′′: 105.8 (C-1′′′), 75.0 (C-2′′′), 78.7 (C-3′′′), 71.0 (C-4′′′), 67.6 (C-5′′′)。以上数据与文献报道基本一致[7],故鉴定化合物2为葫芦素L-2--[a--吡喃鼠李糖基-(1→2)][a--吡喃阿拉伯糖基-(1→3)]-β--吡喃葡萄糖苷。
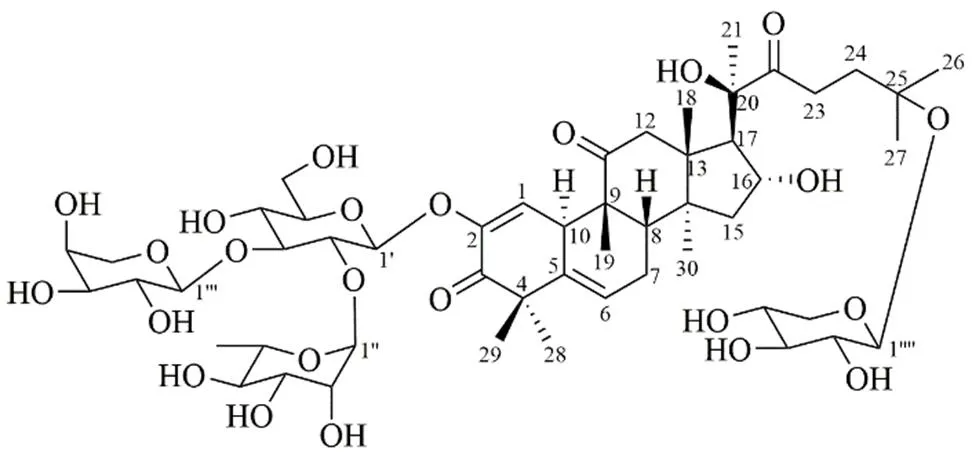
图3 化合物1的结构

表1 化合物1的1H-和13C-NMR数据(500/125 MHz,C5D5N)
a)重叠信号
a)overlapped
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1986: 269-270.
[2] 国家中医药管理局《中华本草》编委会. 中华本草 5 [M]. 上海: 上海科学技术出版社, 1998: 532-538.
[3] Wang J, Zhao M, Cheng X,. Dammarane-type saponins fromprevent hypoxia-induced neural injury through activation of ERK, Akt, and CREB pathways [J]., 2020, 68(1): 193-205.
[4] 范冬冬, 匡艳辉, 向世勰, 等. 绞股蓝化学成分及其药理活性研究进展 [J]. 中国药学杂志, 2017, 52(5): 342-352.
[5] 沈子琳, 王振波, 侯会芳, 等. 绞股蓝的化学成分和药理作用及应用研究新进展 [J]. 人参研究, 2020, 32(5): 59-64.
[6] 伍国怡. 药用植物绞股蓝的研究进展 [J]. 中国民族民间医药, 2016, 25(12): 60-63.
[7] 周文超. 绞股蓝种子中新皂苷的提取及其消炎活性研究 [J]. 云南化工, 2018, 45(8): 34-37.
[8] 张瑶丹, 姜新宇, 操兰洁, 等. 绞股蓝总苷颗粒改善高脂血症C57BL/6J小鼠脂代谢的研究 [J]. 中国药科大学学报, 2019, 50(6): 713-720.
[9] Xia X Y, Xu J, Wang X D,. Jiaogulan tea (Gpostemma) potentiates the antidiabetic effect of white tea via the AMPK and PI3K pathways in C57BL/6 mice [J]., 2020, 11(5): 4339-4355.
[10] Yin M J, Zhang J J, Wang L Z,. Ten new dammarane-type saponins with hypolipidemia activity from a functional herbal tea-[J]., 2020, 25(16): E3737.
[11] 王曌, 尹跃, 边媛媛, 等. 绞股蓝三萜类化合物及其抑制α-葡萄糖苷酶和蛋白酪氨酸磷酸酶1B的活性研究[J]. 中草药, 2020, 51(24): 6142-6150.
[12] Wang D C, Pan H Y, Deng X M,. Cucurbitane and hexanorcucurbitane glycosides from the fruits ofcv[J]., 2007, 9(6): 525-529.
[13] Chen J C, Chiu M H, Nie R L,. Cucurbitacins and cucurbitane glycosides: Structures and biological activities [J]., 2005, 22(3): 386-399.
[14] Gan M, Liu M, Liu B,. Cucurbitane glucosides from the root of[J]., 2011, 74(11): 2431-2437.
A new cucurbitane-type saponin from
LOU Yun-yun1, 2, MU Long2, HUANG Ya-ping2, ZHANG Jian3, YIN Zhi-qi2, PAN Ke1
1. Department of Natural Medicinal Chemistry, School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China 2. Department of TCMs Pharmaceuticals & State Key Laboratory of Active Components and Efficacy of Natural Medicines, School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 210009, China 3. Laboratory of Translational Medicine, Jiangsu Provincial Academy of Traditional Chinese Medicine, Nanjing 210028, China
To further study the chemical constituents from the total saponin extract of Jiaogulan ().The chemical constituents ofwere separated and purified by chromatographic methods and structurally elucidated by means of various spectroscopic techniques.Two cucurbitane-type saponins were isolated from the total saponin extract of, and identified as cucurbitacin L-2--{[a--rhamnopyranosyl-(1→2)] [a--arabinopyranosyl-(1→3)]-β--glucopyranosyl}-25--β--xylopyranoside (1), cucurbitacin L-2--[--rhamnopyranosyl- (1→2)] [a--arabinopyranosyl-(1→3)]-β--glucopyranoside (2).Compound 1 is a new compound named cucurbitane-gypenoside A.
(Thunb.) Makino;; cucurbitane-type; triterpenoid saponin; cucurbitane-gypenoside A; cucurbitacinL-2--[a--rhamnopyranosyl-(1→2)] [a--arabinopyranosyl-(1→3)]-β--glucopyranoside
R284.1
A
0253 - 2670(2021)07 - 1872 - 05
10.7501/j.issn.0253-2670.2021.07.002
2020-11-23
江苏省高校青蓝工程资助项目;大学生创新创业训练计划项目成果(202010316044S);2020年江苏省研究生科研创新计划(KYCX20_0676)
娄云云,男,硕士,研究方向为天然药物化学。E-mail: 17805936864@163.com
潘 珂,副教授。E-mail: kpan@cpu.edu.cn
[责任编辑 王文倩]
