基于夏枯草不同生长发育时期化学成分的动态监测阐释“夏枯质优”的科学内涵
2021-04-07刘月新谢菁琛张智敏廖颖妍夏伯候林丽美
刘月新,林 艳,谢菁琛,张智敏,廖颖妍,夏伯候*,林丽美
基于夏枯草不同生长发育时期化学成分的动态监测阐释“夏枯质优”的科学内涵
刘月新1, 2,林 艳1, 2,谢菁琛1, 2,张智敏1, 2,廖颖妍1, 2,夏伯候1, 2*,林丽美1, 2
1. 湖南中医药大学药学院,湖南 长沙 410208 2. 湘产大宗药材品质评价湖南省重点实验室,湖南 长沙 410208
基于紫外(UV)和高效液相(HPLC)全息指纹图谱,化学模式识别技术与多成分定量相结合的方法,整合评价不同生长发育时期的49批夏枯草样品化学成分的变化规律,从而阐明夏枯草由草到药的演变过程,解释夏枯草“夏枯质优”的科学内涵。建立不同生长发育时期49批夏枯草样品的UV和HPLC全息指纹图谱,采用主成分分析(principal component analysis,PCA)、偏最小二乘法-判别分析(partial leastsquares-discriminant analysis,PLS-DA)对其进行评价,筛选出影响夏枯草分类的特异性吸收波段,并对主要差异性化学成分进行含量测定。建立了不同生长发育时期49批夏枯草样品的UV和HPLC指纹图谱,PCA和PLS-DA分析可直观显示夏枯草样品中总的化学组分在不同生长发育时期时动态的变化趋势,其中夏枯草枯萎期可以明显的和其他4个时期区分开来,且其他4个时期有向枯萎期动态渐变的趋势。UV指纹图谱通过PLS-DA 筛选出特异性吸收波段为261 nm,HPLC指纹图谱利用PLS-DA的变量因子(VIP)分布图,筛选出VIP值大于1.3的2个色谱峰,经指认为异迷迭香酸苷和迷迭香酸,确定为主要差异性化学成分。对不同生长发育时期的夏枯草差异性化学成分进行含量测定,其中迷迭香酸的含量为0.020%~0.344%;异迷迭香酸苷的含量为0.0016%~0.0988%。多成分定量结果说明,果穗枯萎期中异迷迭香酸苷和迷迭香酸的含量明显增加。含量测定结果与指纹图谱模式识别结果一致,两者可相互验证。指纹图谱结合化学模式识别技术与多成分定量,多种分析方法并用,全方位整合的技术手段,实现了对夏枯草从草到药的整个生长发育过程中整体化学信息的动态监测。该方法分析全面、操作简便,为阐明“夏枯质优”,规范夏枯草药材采收及全面评价药材质量提供参考。
夏枯草;紫外指纹图谱;高效液相指纹图谱;主成分分析;偏最小二乘法-判别分析;异迷迭香酸苷;迷迭香酸;多成分定量
几千年来,中草药一直被中国人民用作防治疾病的主要工具,日渐积累宝贵的用药知识,并形成一整套中药理论体系。中药材与采收时节密切相关。民间就有这样的俗语:“当季是药,过季是草”,“三月茵陈四月蒿,五月六月当柴烧”,因此,中药在适宜的时间采收,直接影响防病治病的效果。
为何中药一定要到它的最佳采收期采收才可用药?中药作为多组分、多靶点的复合体系,用其中的某一种组分或某一类组分来判定采收时期,很难从整体上评价其结果,因此,本实验以夏枯草为例,借助多维指纹图谱,以及化学计量学等多元数据统计分析的方法[1-3],建立整合模型,研究总的化学组分在夏枯草生长不同时期的动态变化过程,从整体上阐明总的化学组成与不同生长发育时期之间的关系,以科学的手段解释夏枯草“夏枯质优”的科学内涵,它是如何从草到药的。
夏枯草为唇形科(Lamiaceae)植物夏枯草L.的干燥果穗,具有清肝散火、明目、散结消肿的功效[4-5]。其药用部位为果穗,应在植株果穗80%现黄渐变成棕褐色时,趁晴天可挤蔸割下或将果穗割回晒干收籽,其表型变化过程明显。
中药从属于复杂科学体系,任何单一方法都无法清晰准确揭示中药复杂系统的真实本源,主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)目前广泛应用于药品食品和农产品等的快速识别。本实验以夏枯草为研究对象,研究“夏枯”前后化学成分变化的差异性。利用2种指纹图谱实现了对中药全化学成分的全面监测,并将多维指纹谱技术和多元数据分析技术恰当整合,使其成为一种综合鉴别、客观量化和精准评价中药的有效可行方法,使中医中药在中药质量控制、中药药效成分研究、中药作用机制研究等多方面更加科学化[6-7]。
1 材料
1.1 仪器与试剂
TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);Alliance Waters e2695高效液相色谱系统,AllianceWaters 2998PDA检测器,Empower3色谱工作站(Waters公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);SQP型电子分析天平(赛多利科学仪器北京有限公司);所用试剂甲醇、甲酸均为色谱纯;水为超纯水;对照品芦丁(批号B20771)海源叶生物科技有限公司);异迷迭香酸苷、迷迭香酸均为课题组自制,质量分数经高效液相色谱法(面积归一化法)测定大于98%。
1.2 试药
1.2.1 夏枯草种植 湖南中医药大学药植园(112°54′E;28°08′N;88 m),土壤为砂质黄土壤,肥力中等。播种前施入有机复合肥1.2×103kg/hm2作为底肥一次性施入土壤。
1.2.2 夏枯草采收 对夏枯草生长阶段进行划分,依次分为生长期(A1~A5)、花始期(B6~B16)、花盛期(C17~C24)、花萎期(D25~D37)和枯萎期(E38~E49)5个时期,采集各个时期样本共49份,药材经湖南中医药大学药学院王智教授鉴定为唇形科夏枯草属植物夏枯草L.。
2 方法
2.1 供试品溶液的制备
2.1.1 紫外用供试品溶液的制备 精密称取夏枯草药材粉末(过40目筛)约0.1 g,加入溶剂2 mL,密塞,称定质量,超声提取60 min,放冷,再称定质量,用溶剂补足减失的质量,摇匀,静置后取上清液0.5 mL,微孔滤膜(0.45 μm)滤过,定容至8 mL。即得各样品紫外指纹图谱的待测溶液。
2.1.2 HPLC用供试品溶液的制备 精密称取49份夏枯草粉末(过40目筛)约0.2 g,加入溶剂5 mL,密塞,称定质量,超声提取(50 ℃、60 min),放冷,再称定质量,用溶剂补足减失的质量,摇匀,静置后取上清液,微孔滤膜(0.22 μm)滤过,即得各样品高效液相指纹图谱的待测溶液。
2.2 对照品溶液的制备
精密称取异迷迭香酸苷对照品5.20 mg、芦丁对照品2.72 mg、迷迭香酸对照品4.48 mg,分别置于10 mL量瓶中,甲醇溶解并定容至刻度,得各对照品质量浓度分别为0.520、0.272、0.448 mg/mL。分别取异迷迭香酸苷溶液、芦丁溶液、迷迭香酸溶液100、10、500 μL置1 mL量瓶中,甲醇定容至刻度,3个对照品混合溶液质量浓度分别为52.00、2.72、224.00 μg/mL。
2.3 夏枯草紫外指纹图谱的建立
按照“2.1.1”项下方法制备49批夏枯草样品的供试品溶液,依次置于1 cm石英比色皿中,以40%甲醇溶剂作为参比溶液,进行紫外光谱扫描。测定波长范围200~800 nm,狭缝宽度1.0 nm,采样间隔1 nm,采样重复次数3次。结合UV Win6.0软件在200~800 nm内进行监测,分辨率为1 nm,获得600个点样。
紫外光谱进行3组平均,4点平滑,一阶求导处理,以校准基线和强化谱带特征,克服谱带重叠,使图谱信息清晰直观。利用PCA、PLS-DA进行多元统计分析,PLS-DA的VIP得分图分析标志性波段,筛选出区别较大的波数。以此作为检测波长,对样品进行高效液相色谱分析。
2.4 夏枯草高效液相指纹图谱的建立
2.4.1 指纹图谱色谱条件 色谱柱:Agilent 5HC-C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.1%甲酸水溶液(B);梯度洗脱条件为0~10 min:8%~16%A;10~30 min:16%~50%A;30~40 min:50%~75%A;40~45 min:75%~100%A;检测波长261 nm;柱温30 ℃;体积流量1.0 mL/min;进样量10 μL。
2.4.2 高效液相指纹图谱建立 按照“2.1.2”项下方法制备49批夏枯草供试品溶液,按照“2.4.1”项下色谱条件对样品依次进行检测,记录指纹图谱,采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2004A版)建立49批夏枯草共有模式图谱,并进行相似度分析,以及PCA、PLS-DA多元统计分析。
2.5 数据处理与多元统计分析
2.5.1 PCA PCA可被视为“多变量数据分析中所有方法的母亲”。PCA的目标是降维,是计算线性潜变量(组分)的最常用方法。它可从原始变量之间的相互关系入手,利用方差最大原则,通过放大原始数据中的差异性,并将它们线性转换到主成分上。然后通过对主成分作图,能够直观的描述各主成分的差别。它是一种非监督的模式识别方式,反映数据的原始情况,有利于对数据从整体上进行评价。为了便于观察不同生长发育时期的夏枯草之间的差异性,在不损失大量信息的条件,利用PCA将高维的紫外、液相指纹图谱数据转化为低维的数据。所有的数据导入SIMCA 14.1进行聚类分析。
2.5.2 PLS-DA PLS-DA是有监督的模式识别方式,可弥补PCA模式的不足,凸显组间差异。2种模式互为补充。目前已成为一种常用于代谢组分学的分析方法,它可以通过最大自变量数据和应变量数据集之间的协方差来构建正交得分向量(潜变量或主成分),从而拟合自变量数据和应变量数据之间的线性关系。PLS-DA模型的拟合效果通常通过2、2、2这3个指标来评价,这些指标大于0.5较为可信,并且越接近1说明PLS-DA模型的拟合效果越好[8-10]。
为了将各不同生长发育时期的夏枯草更好地进行分类,采用PLS-DA进行紫外、液相的指纹图谱分析。其中液相指纹图谱数据在PLS-DA分析的基础上,根据VIP>1.3、<0.05的变量来筛选导致差异性的主要化学成分。
2.6 特征成分的含量测定
分别取49批夏枯草样品进行含量测定,计算样品中筛选出的导致差异性主要化学成分的含量。从成分定量的角度来说明夏枯草从草到药,即“夏枯质优”的科学内涵。
2.6.1 色谱条件 色谱柱:Agilent 5HC-C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%甲酸水溶液(B);梯度洗脱条件为0~10 min,12%~30%A;10~15 min,30%~35%A;15~25 min,35%~48%A;25~30 min,48%~60%;30~40 min,60%~70%A;40~45 min,70%~100%A。检测波长261 nm,柱温30 ℃,体积流量1 mL/min,进样量10 μL。
2.6.2 精密度试验 按“2.1.2”项下方法制备供试品溶液,按“2.6.1”项下色谱条件,供试品溶液连续进样6次,以迷迭香酸峰(12号峰)为参照峰,计算相对保留时间及相对峰面积,RSD值应小于3%。
2.6.3 重复性试验 按“2.1.2”项下方法制备6份供试品溶液,进行HPLC分析,以迷迭香酸峰(12号峰)为参照峰,计算相对保留时间及相对峰面积,RSD值应小于3%。
2.6.4 稳定性试验 取同一份药材供试品溶液,在0、2、4、8、12、24 h分别测定,计算相对保留时间及相对峰面积,RSD值应小于3%。
3 结果与分析
3.1 紫外指纹图谱的多元统计分析结果
3.1.1 紫外指纹图谱分析 将49批夏枯草样品待测溶液依次扫描,记录200~800 nm在线紫外光谱图,样品在400~800 nm吸收很低,因此确定提取紫外指纹图谱在200~400 nm,这部分以反映夏枯草中主要紫外吸收物质特征。结合UV Win6.0软件在200~400 nm内进行监测,分辨率为1 nm,获得200个点样数据。将所得数据导入Origin2017数据分析软件中,紫外指纹图谱如图1-A所示。可以看出,在200~250 nm、250~300 nm、300~400 nm紫外吸收信号较强,提示可能分别是三萜类、黄酮类、酚酸类成分的紫外光谱特征。其中三萜类成分可能为熊果酸和齐墩果酸,黄酮类可能为芦丁、芸香苷等,酚酸类成分可能为迷迭香酸、咖啡酸等。图1-A的紫外指纹图谱经过Savitzky-Golay平滑再经过一阶导数转换(first derivative),结果如图1-B所示。紫外指纹图谱能够观察到夏枯草中所有的化学成分信息,不同生长时期样品的紫外指纹图谱特征区(200~400 nm)峰型和吸收强度存在差异,共有峰提示不同个体样品主要成分组成相似,吸收强度差异提示样品之间主要成分含量存在差异,图中可以看出,枯萎期的样品图谱和其他4个时期比较,无论化学成分组成或是主要成分含量,都存在较为明显的差异,图1-B较图1-A差异性更为显著。但紫外指纹图谱中峰形和吸收值差异却不能明显观察到各个生长发育时期样品中化学成分的变化过程。故需要对指纹图谱进行多元统计数据分析,以区别不同生长发育时期的样品。将紫外指纹图谱数据导入SIMCA 14.1软件进行PCA分析、PLS-DA分析。
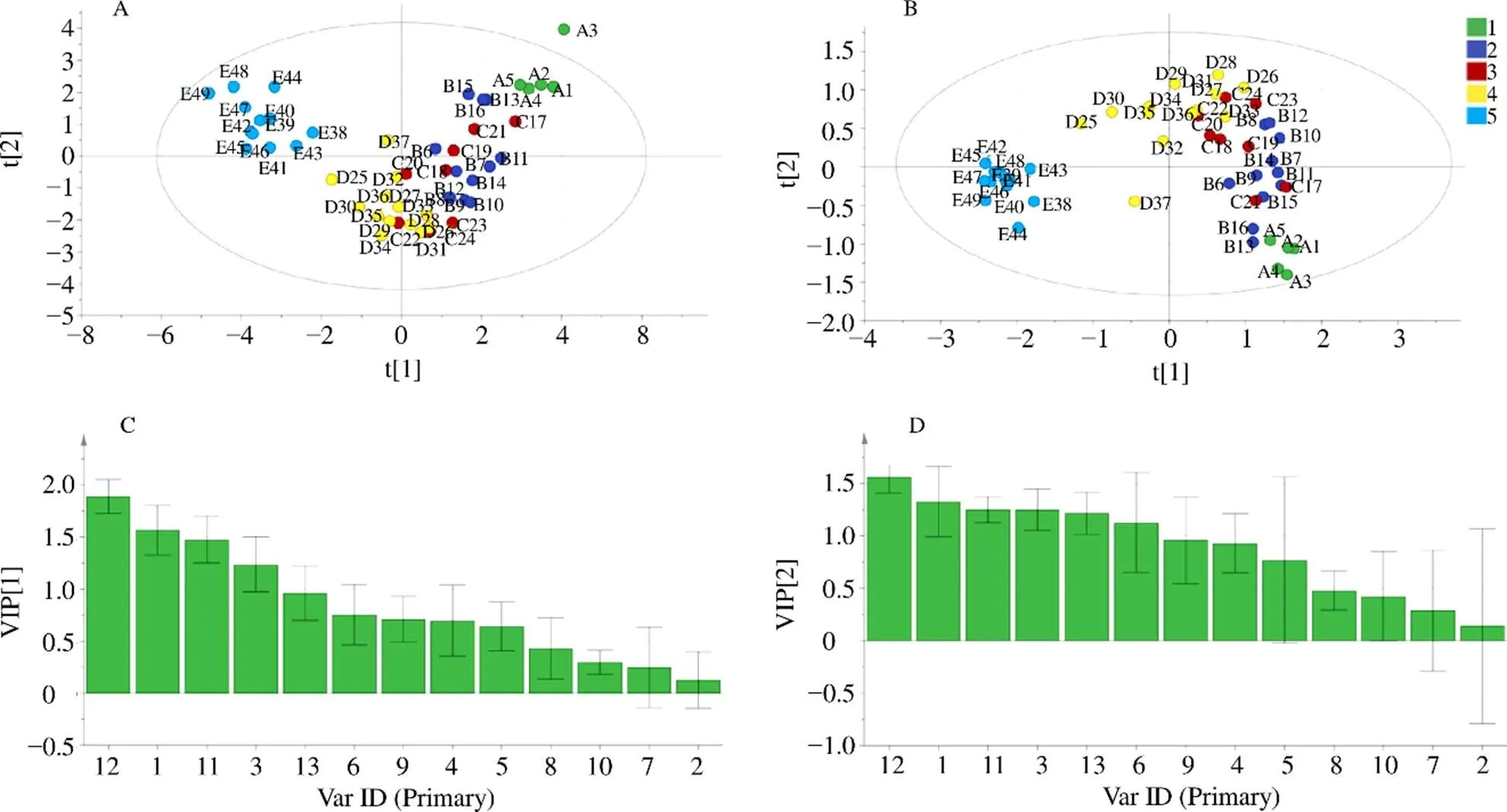
3.1.2 PCA分析结果 为了观察不同生长时期夏枯草之间的差异性,49批样品所得的数据导入SIMCA 14.1进行PCA分析,从PCA得分图可以直观看出,夏枯草不同生长发育时期基本上分成5类,分类结果如图2-A所示。建立的模型累计解释参数2=0.987,预测能力的参数2=0.964,2>0.5,说明该模型的区分程度和预测程度都较好,且结果在95%置信区间内分类结果可信。此外,除枯萎期外的四个时期,依次从生长期、花始期、花盛期、花萎期化学成分有明显的渐变趋势,说明夏枯草中总的化学成分是从生长期开始,逐渐向枯萎期动态演变,最终形成突越,使得枯萎期可以明显的和其他四个时期区分开来,由此说明夏枯草生长期、花始期、花盛期、花萎期,即为“成草期”,归为一类,最终成为可药用的枯萎期,即为“成药期”,归为另一类,说明它从“草”到药的演变过程。
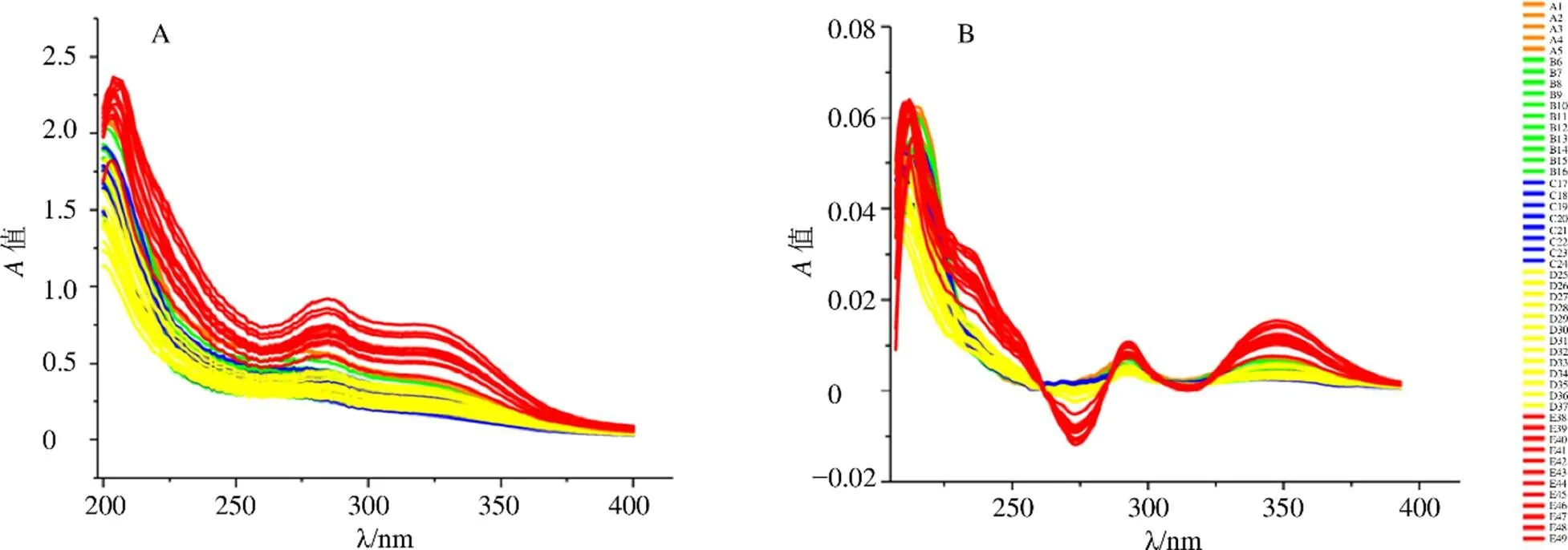
A-夏枯草样品紫外原始指纹图谱 B-夏枯草样品紫外一阶导数图谱
3.1.3 PLS-DA分析结果 为了更好地将各不同时期的夏枯草进行区分,另采用偏最小二乘法-判别分析方法进行进一步分析,PLS-DA分析结果如图2-B所示。前2主成分2=0.949,2=0.523,且结果在95%置信区间内说明分类结果可信。PLS-DA得分图直观显示了49批不同生长时期的夏枯草样品中所含化学成分的动态变化过程。分类结果与PCA分析结果大体相似,以中间轴为界,所有样品大致被分为2类,左边为“成草期”,右为“成药期”。
3.1.4 PLS-DA模型筛选标志性波段 通过PLS-DA变量重要性因子(Variable important for the projection,VIP)分布图分析,筛选出49份夏枯草样品中紫外指纹图谱区别较大的标志性波长,VIP值可以量化PLS-DA的每个变量对分类的贡献,VIP值越大,变量在夏枯草不同生长时期的差异越显著。如图2-C所示,因溶剂吸收区在190~210 nm,干扰较大,观察发现261 nm处干扰较小,VIP值最大,VIP>1.6,故选261 nm作为高效液相指纹图谱的检测波长,如图2-C所示。
3.2 高效液相指纹图谱多元统计分析结果
3.2.1 高效液相指纹图谱的建立 采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2004A版)建立49批夏枯草共有模式图谱,结果见图3-A。
选取时间宽度为0.1 min,以平均数生成对照色谱图,经过多点矫正后自动匹配,确定13个特征峰作为评价的变量指标。并用混合对照品进行指认,确定10、11、12号峰分别为芦丁、异迷迭香酸苷和迷迭香酸,结果如图3所示。

A-夏枯草紫外PCA得分图 B-夏枯草紫外PLS-DA得分图 C-PLS-DA模型VIP图
以上述共有模式为对照指纹图谱,对49批夏枯草的指纹图谱进行相似度评价,夏枯草的相似度在0.24~1.00,表明不同生长发育时期夏枯草相似度较低,差异较大,将相似度评价结果采用热点图形式呈现,如图4所示。(颜色差异大说明相似度差异大,颜色偏蓝偏紫的部分说明相似度较小),为更好的进行分类,需进一步采用其他化学模式识别方法[11]。
采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2004A版)分析夏枯草HPLC指纹图谱数据,以共有峰峰面积为变量,将数据导入SIMCA 14.1软件进行PCA、PLS-DA分析。
3.2.2 PCA分析结果 为了观察不同时期夏枯草之间的差异性,从PCA得分图可知,夏枯草不同生长发育时期能基本分为5类,分类结果如图5-A所示。建立的模型累计解释参数2=0.773,预测能力的参数2=0.512,说明该模型的区分程度和预测程度都较好。结果与紫外指纹图谱分析结果一致,可以看出,依次从生长期、花始期、花盛期、花萎期化学成分有明显的动态渐变趋势,最终的枯萎期则可以明显的和其他4个时期区分开来,这个动态渐变趋势与紫外指纹图谱的分析结果一致。
3.2.3 PLS-DA分析结果 对不同生长发育时期夏枯草高效液相指纹图谱结果进一步进行PLS-DA分类分析。分类结果如图5-B所示,前2主成分2=0.744,2=0.541,说明分类结果较为可信,PLS-DA得分图中的每一个点代表每一个样品,复杂的谱图信息在PLS-DA得分图中能直观显示不同生长发育时期和样品之间的关系,图谱相似的样品聚在较近区域,图谱差异大的样品聚在较远区域,图中枯萎期的样品与其他4个时期的样品差异性较大,因此聚在较远区域,而夏枯草的生长期、花始期、花盛期、花萎期,4个“成草期”的样品差异性较小,相互贴近,聚在较近的区域,并且有向枯萎期转变的渐变趋势。图中直观展现了夏枯草从草到药的演变历程。PCA和PLS-DA分析结果互为补充,相互验证,所得结果具有科学客观性。

10-芦丁 11-异迷迭香酸苷 12-迷迭香酸

图4 夏枯草相似度评价结果
A-夏枯草液相PCA得分图 B-夏枯草液相PLS-DA得分图 C、D-VIP标志物差异图
本实验继续运用PLS-DA方法进一步分析。根据VIP>1.3、<0.05的变量来筛选导致差异性的主要化学成分,提取PLS-DA模型中13个变量的VIP值,对13个共有峰峰面积VIP值大小进行排列,结果如图5-C、5-D所示,选择VIP值大于1.3的共有峰,依次为12号峰(VIP值:1.564 1)、11号峰(VIP值:1.327 1),说明以上化学成分对夏枯草样品分类具有显著的影响,这些成分是引起不同生长时期的夏枯草成分差异的主要标志性成分。经过对照指认,确认11号峰为异迷迭香酸苷,12号峰为迷迭香酸,10号峰为芦丁,而10号峰并未出现在VIP>1.3的色谱峰中,则提示它并不是夏枯草不同时期内在成分差异的主要物质基础。
3.3 方法学考察
3.3.1 精密度试验 按“2.6.2”项下方法考察仪器精密度。结果显示,各色谱峰相对保留时间的RSD为0.45%,各色谱峰相对峰面积的RSD为1.23%,均小于3%,说明仪器精密度良好。
3.3.2 重复性试验 按“2.6.3”项下方法考察方法的重复性。结果显示,各色谱峰相对保留时间的RSD为0.27%,各色谱峰相对峰面积的RSD为2.23%,均小于3%,说明该方法的重复性良好。
3.3.3 稳定性试验 按“2.6.4”项下方法考察供试品溶液的稳定性。结果显示,各色谱峰相对保留时间的RSD为0.58%,各色谱峰相对峰面积的RSD为2.42%,均小于3%,说明夏枯草供试品溶液在24 h内稳定性良好。
3.4 特征成分的含量测定
对“2.2”项混合对照品按“2.6.1”项下色谱条件进样,进样量分别为1、2、4、6、8、10 μL,记录峰面积。以2种成分的质量为横坐标()和峰面积为纵坐标()进行标准曲线回归,得异迷迭香酸苷标准曲线方程和线性范围为=213 600-1 945.7,线性范围为0.052~0.520 μg,2=0.999 7;迷迭香酸标准曲线方程和线性范围为=264 756-8 535.1,线性范围为0.004 4~0.140 8 μg,2=0.999 7。以标准曲线为参照,对夏枯草不同时期2种成分含量进行测定,结果见表1。
夏枯草活性成分随着植物的生长不断发生变化,其中异迷迭香酸苷和迷迭香酸2个活性成分占据主导作用。为进一步分析2种活性成分在夏枯草生长过程中变化规律,采用HPLC法对其进行含量测定,结果显示,异迷迭香酸苷随着果穗的不断枯萎,其含量明显增加,枯萎期含量最高,异迷迭香酸苷的含量为0.001 6%~0.098 8%(<0.01);迷迭香酸含量在夏枯草枯萎前期较低,随着果穗不断的枯萎,其含量变化明显,到枯萎期含量达到最高,迷迭香酸的含量为0.02%~0.344%(<0.01)。

表1 夏枯草不同时期2种成分含量变化
**<0.01,显著性差异
**< 0.01, significant difference
自夏枯草列入《中国药典》以来,迷迭香酸含量一直作为夏枯草质控标准,《中国药典》2015年版规定迷迭香酸含量不得低于0.2%,这说明只有当夏枯草完全枯萎时,其药效方能达到标准,这对“夏枯质优”进行了阐释,也对夏枯草的栽培采收提供参考依据。上述迷迭香酸和异迷迭香酸苷含量测定结果与指纹图谱模式识别结果一致,两者可相互验证。
4 讨论
夏枯草的主要药效成分较为复杂,不同极性溶剂提取的成分组成和含量存在差异。本实验对样品的提取溶剂、溶剂浓度、提取时间进行考察,以A1样品为分析对象,准确称取0.100 0g样品3份,分别加入超纯水、甲醇和乙醇,超声提取,方法同“2.3”项。依次测定紫外光谱图。考查不同提取溶液的吸收峰数目,吸收强度,确定最佳提取溶剂。最终采用40%甲醇超声提取60 min作为前处理方法。该条件下所得峰的数量较多,且操作简便。
中药指纹图谱分析方法大多数以色谱指纹图谱为主,近年来,由于中药提取液中包含整体化学物质组分,光谱指纹图谱更能从宏观、整体上清晰提供所含全部化学成分方面的信息。其中紫外光谱能够反映样品中所有不饱和化学键(如双键、三键、共轭体系及助色团)的特征规律信息,依据峰形、收波长和吸光度的不同,结合化学计量学方法探讨供试样品的差异,在中药鉴别方面应用较为广泛[11-14]。再加上其样品前处理简单、分析时间较短,检测成本低廉等特点受到广大分析工作者的日益关注。因此光谱指纹图谱可以辅助色谱指纹图谱从整体上实现对中药的科学化研究和评价。
指纹图谱技术结合化学计量学能有效地区别不同生长发育时期夏枯草样品,其中PCA分析可以实现将大量的变量降维成二维空间数据,降低观测空间的维数,以获取最主要的信息,通常可以通过少数几个主成分即可最大限度地描述数据特点,对样品加以区分。复杂的紫外光谱图信息和液相色谱图信息可以在PCA和PLS-DA得分图中直观显示夏枯草样品中总的化学组分在不同生长时期时动态的变化过程,夏枯草枯萎期可明显和其他时期区分开来,说明枯萎期所包含化学成分无论从组成或是含量都发生了质的改变,由此阐明夏枯草“夏枯质优”的科学内涵,它是如何从草到药的。
《中国药典》2015年版规定的夏枯草质量控制组分为迷迭香酸,检测波长为330 nm,而本研究的液相指纹图谱检测波长是在紫外指纹图谱指导下,通过PLS-DA变量重要性因子VIP分布图筛选出区别较大的标志性波长,即261 nm。药典中是以单一组分作为质量控制的标准,但中药本身是个多种成分的集合体,以单一组分控制中药质量并不全面,本实验是把夏枯草中所有化学组分看作一个整体,收集49批不同生长发育时期夏枯草样品,并通过紫外指纹图谱、高效液相指纹图谱与PCA、PLS-DA模式识别方法相结合,以及对差异性成分定量的方法,来比较不同时期夏枯草样品的差异性。从而阐明夏枯草由草到药的演变过程。同时,本实验多了一个质控标准的参考检测波长261 nm,对于完善夏枯草的质量控制标准具有一定参考意义,目前,由于采收不同时期的时间较短,收集的夏枯草各个时期的样品批次还相对较少,后续实验可以增加样品批次,细化不同时期采收的时间、方法,不断修正夏枯草的特征图谱。
目前对夏枯草的研究较为片面,主要集中在其果穗枯萎阶段。以往文献对不同生长发育时期夏枯草化学成分变化规律的研究也只局限于一、两个或几大类成分为指标,难以全面反映夏枯草次生代谢产物累积变化规律。本课题以夏枯草为研究对象,从整个植物动态发育角度进行分析,从整体上阐明总的化学组成与夏枯草不同生长时期之间的关系,跟踪整个生长发育过程,以科学的手段解释夏枯草“夏枯质优”的科学内涵,该方法分析全面、操作简便,为规范夏枯草药材采收及药材科学、合理加工方法的确定提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 夏伯候, 熊苏慧, 唐洁, 等. 基于多元统计分析的夏枯草多重药效物质与抗氧化活性分析 [J]. 中国中药杂志, 2018, 43(23): 4645-4651.
[2] 唐洁, 柏玉冰, 熊苏慧, 等. 不同产地夏枯草指纹图谱研究 [J]. 中南药学, 2017, 15(8): 1025-1028.
[3] 皮胜玲, 胡玉珍, 彭曦, 等. 野生与栽培夏枯草HPLC指纹图谱研究及模式识别分析 [J]. 中国药学杂志, 2017, 52(5): 367-371.
[4] 中国药典 [S]. 一部. 2015: 280.
[5] 张金华, 邱俊娜, 王路, 等. 夏枯草化学成分及药理作用研究进展 [J]. 中草药, 2018, 49(14): 3432-3440.
[6] 孙国祥, 侯志飞, 李文颖, 等. 中药多元多维指纹图谱特征与构成方式及评价方法研究 [J]. 中南药学, 2014, 12(6): 497-504.
[7] 樊岩, 黎阳, 刘素香. 数理统计方法在中药质量评价中的应用 [J]. 中草药, 2009, 40(5): 836-840.
[8] Szymańska E, Saccenti E, Smilde A K,. Double-check: Validation of diagnostic statistics for PLS-DA models in metabolomics studies [J]., 2012, 8(suppl 1): 3-16.
[9] Boulesteix A L, Strimmer K. Partial least squares: A versatile tool for the analysis of high-dimensional genomic data [J]., 2007, 8(1): 32-44.
[10] Westerhuis J A, Hoefsloot H C J, Smit S,. Assessment of PLSDA cross validation [J]., 2008, 4(1): 81-89.
[11] 钟贵, 胡健, 张霁, 等. 野三七紫外可见指纹图谱结合多元统计方法的鉴别分析 [J]. 南昌大学学报: 医学版, 2017, 57(2): 11-16,95.
[12] 王元忠, 钟贵, 张霁, 等. 紫外指纹图谱结合化学计量学对不同产地中药三七的鉴别研究 [J]. 光谱学与光谱分析, 2016, 36(6): 1789.
[13] 李智敏, 王元忠, 王瀚墨, 等. 不同产地茯苓皮紫外指纹图谱的分析与鉴别 [J]. 云南大学学报: 自然科学版, 2015, 37(6): 902-908.
[14] 谭树慧, 任卫琼, 刘月新, 等. 不同产地生/醋炙乌药指纹图谱的建立及模式识别研究 [J]. 药物分析杂志, 2018, 38(10): 1803-1809.
Scientific connotation of “summer withering with good quality” based on dynamic monitoring of chemical constituents at different growth and development stages of
LIU Yue-xin1, 2,LIN Yan1, 2, XIE Jing-chen1, 2,ZHANG Zhi-min1, 2, LIAO Ying-yan1, 2, XIA Bo-hou1, 2,LIN Li-mei1, 2
1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 2. Hunan Key Laboratory for Quality Evaluation of Bulk Herbs, Changsha 410208, China
Based on the UV and HPLC fingerprints ofsamples, combined with multi-component quantitative analysis and chemical pattern recognition methods, the changes of chemical components in 49 batches ofsamples at different growth stages were evaluated, so as to clarify the evolution process offrom herbs to medicines, and explain the scientific connotation of “summer withering with good quality” of.UV and HPLC holographic fingerprints of 49 batches ofsamples at different growth stages were established, which were evaluated by principal component analysis (PCA) and partial least squares-discriminant analysis (PLS-DA). The specific absorption bands affecting the classification ofwere screened out. The chemical constituents that cause the difference ofat different growth and development stages were determined.UV and HPLC fingerprints of 49 batches ofsamples at different growth stages were established. PCA and PLS-DA analysis intuitively showed the dynamic changes of total chemical components insamples at different growth stages. The withering period ofcan be clearly distinguished from the other four periods, and the other four periods had a trend of dynamic gradual change towards the withering period. The specific absorption band of UV fingerprint was 261 nm through PLS-DA. By using the VIP distribution map of PLS-DA, two peaks with VIP value greater than 1.3 were screened out by HPLC fingerprint. Isorosmarin and rosmarinic acid were identified as the main differential chemical components. Determination of chemical components ofin different growth stages was carried out, The content of rosmarinic acid was 0.020%—0.344%. The content of isorosmarin was 0.0016%—0.0988%. Multi-component quantitative results showed that the contents of isorosmarin and rosmarinic acid increased significantly in the withering period of cluster. The results of the content determination were consistent with the fingerprint pattern recognition results, and they can be verified mutually.Fingerprint combined with chemical pattern recognition methods and multi-component quantitative analysis was used to monitor the overall chemical information ofduring the whole growth and development process from herbs to medicines. This method is comprehensive and easy to operate. It can be used as a reference for elucidating the “summer withering with good quality”, standardizing the collection ofand comprehensively evaluating its quality.
L.; UV fingerprint; HPLC fingerprint; principal component analysis; partial least squares method-discriminant analysis; isorosmarin; rosmarinic acid; multi-component quantification
R286.2
A
0253 - 2670(2021)07 - 2082 - 09
10.7501/j.issn.0253-2670.2021.07.025
2020-08-09
长沙市科技计划项目(kq2004063);湖南中医药大学中药学开放基金项目(2020ZYX11)
刘月新(1983—),女,硕士,实验师,从事中药药效物质基础研究。E-mail: 158769882@qq.com
夏伯候(1983—),男,副教授,从事中药药效物质基础及其质量标准化研究。E-mail: 411816629@qq.com
[责任编辑 时圣明]
