蛋白质与多酚相互作用研究进展
2021-04-07黄子林孔祥珍张丽娜华欲飞
黄子林 孔祥珍 张丽娜 华欲飞
(江南大学食品学院,无锡 214122)
蛋白质是由不同的氨基酸组成的高度复杂的复合物,其广泛存在于奶类、肉类、蛋类和油料种子中。多酚则以天然抗炎、抗病毒、抗氧化活性物质著称[1]。多酚与蛋白的相互作用近年来已经逐渐称为新的研究热点,这些研究根据多酚来源的不同主要可以分两种:一种是研究食品体系中天然存在的多酚与蛋白质的相互作用,例如大豆、核桃、葵花籽等油料作物榨油后的残渣中多酚与蛋白之间的相互作用[2-4],通过研究粕中脱酚与未脱酚蛋白的性质和营养价值的不同来探究二者的相互作用;另一种通过外加多酚,探究多酚与蛋白质的相互作用及对二者各自性质的影响,根据其性质的改变以探究其应用潜力[5,6]。例如通过二者相互作用可以改善多酚稳定性,故可将蛋白质作为稳定多酚的载体[7-9];通过其相互作用可提高蛋白质产品的抗氧化性,故将二者复合物作为易氧化食品的包装材料[10];也有研究发现二者的相互作用能够改善蛋白质的乳化性质,从而将其用于制备乳液饮料等[11]。
广泛的应用方向为蛋白质与多酚相互作用的研究提供了不竭的动力。为了研究蛋白质与多酚的相互作用对各自结构、功能和营养性质的影响,首先需要了解二者相互作用的可能机理及其分析方法。蛋白质与多酚的相互作用可以分为共价作用和非共价作用,其中非共价作用可逆,其作用力主要包括疏水相互作用、氢键、静电相互作用和范德华力等。共价作用主要是源于多酚的氧化和亲核加成过程,其作用力是共价键且反应不可逆。但多数情况下,共价和非共价作用可能同时发生,例如绿原酸与蛋白质的结合[12]。本文主要从多酚与蛋白质的相互作用机理、分析方法、影响因素和对蛋白与多酚的影响几个方面进行综述。
1 蛋白质与多酚的相互作用机理
1.1 非共价相互作用机理
蛋白质与多酚非共价作用包括疏水相互作用、氢键、范德华力、静电相互作用等,如图1所示。其中疏水相互作用被认为是蛋白质与多酚非共价相互作用最主要的驱动力,氢键次之。疏水相互作用主要表现在蛋白质脂肪族、芳香族氨基酸与多酚的苯环之间。Wei等[13]研究了花色苷与β-酪蛋白的非共价相互作用机理发现其主要由疏水相互作用驱动。氢键则主要通过多酚化合物中氢原子与蛋白质中N、O或S原子等电负性原子的相互作用形成。Wang等[14]研究了富含多酚物质的乌饭树叶色素与大米蛋白的相互作用,发现其作用力主要包括疏水相互作用和氢键。

图1 多酚与蛋白质非共价作用机制[17]
有假说提出蛋白质与多酚的非共价作用可以分为三个阶段:第一阶段,形成小的蛋白质-酚类复合物,多酚物质可以结合到蛋白质分子疏水性基团等多个作用位点上,使得蛋白质结构从随机卷曲转变为与酚类化合物结合更紧密的结构,疏水相互作用被认为是第一阶段的主要作用力;第二阶段,由蛋白质-酚类复合物通过交联自结合形成小聚集体,导致复合聚集体的形成,氢键起到稳定和加强复合物的作用;第三阶段,大尺寸复合物由于聚结而沉淀。此外,各阶段主要驱动力还取决于蛋白质的结构、酚类化合物结构、浓度和化学性质[15]。
虽然非共价相互作用很弱,一般比通常共价键能小1~2 个数量级,但这些分子间弱相互作用力可在一定条件下起协同作用,形成具有一定方向性和选择性的强作用力[16]。例如啤酒、葡萄酒、茶饮料等在销售期间容易形成浑浊,其最常见、最重要的原因之一就是蛋白质与多酚的非共价相互作用。
1.2 共价相互作用的机理
酚类化合物具有较高的反应活性,容易被氧化成相应的醌,它们能与亲核试剂发生共价反应,例如蛋白质的游离氨基、赖氨酸、半胱氨酸和色氨酸等。
图2为邻醌与氨基或巯基的亲核加成示意图,反应后酚环与蛋白质上的氨基或巯基反应形成共价的C—N键或C—S键,邻醌被还原成酚类。故该加成产物可以再次被氧化成醌类,进一步形成二聚体或继续被还原,如图3所示。邻醌类物质由于其亲电性,易在后续反应中形成二聚体或多聚体,导致形成蛋白质聚合物。关于邻醌与蛋白质形成共价键的作用位点说法不一,图2、图3中分别示意蛋白质在酚羟基间位和邻位取代形成共价键,但Tran等[1]则示意蛋白质会取代苯环上的一个酚羟基从而使二者共价交联。推测蛋白质与多酚的种类不同会导致其共价交联作用位点出现变化。

图2 邻醌与氨基、巯基的1,4-亲核加成反应示意图[17]
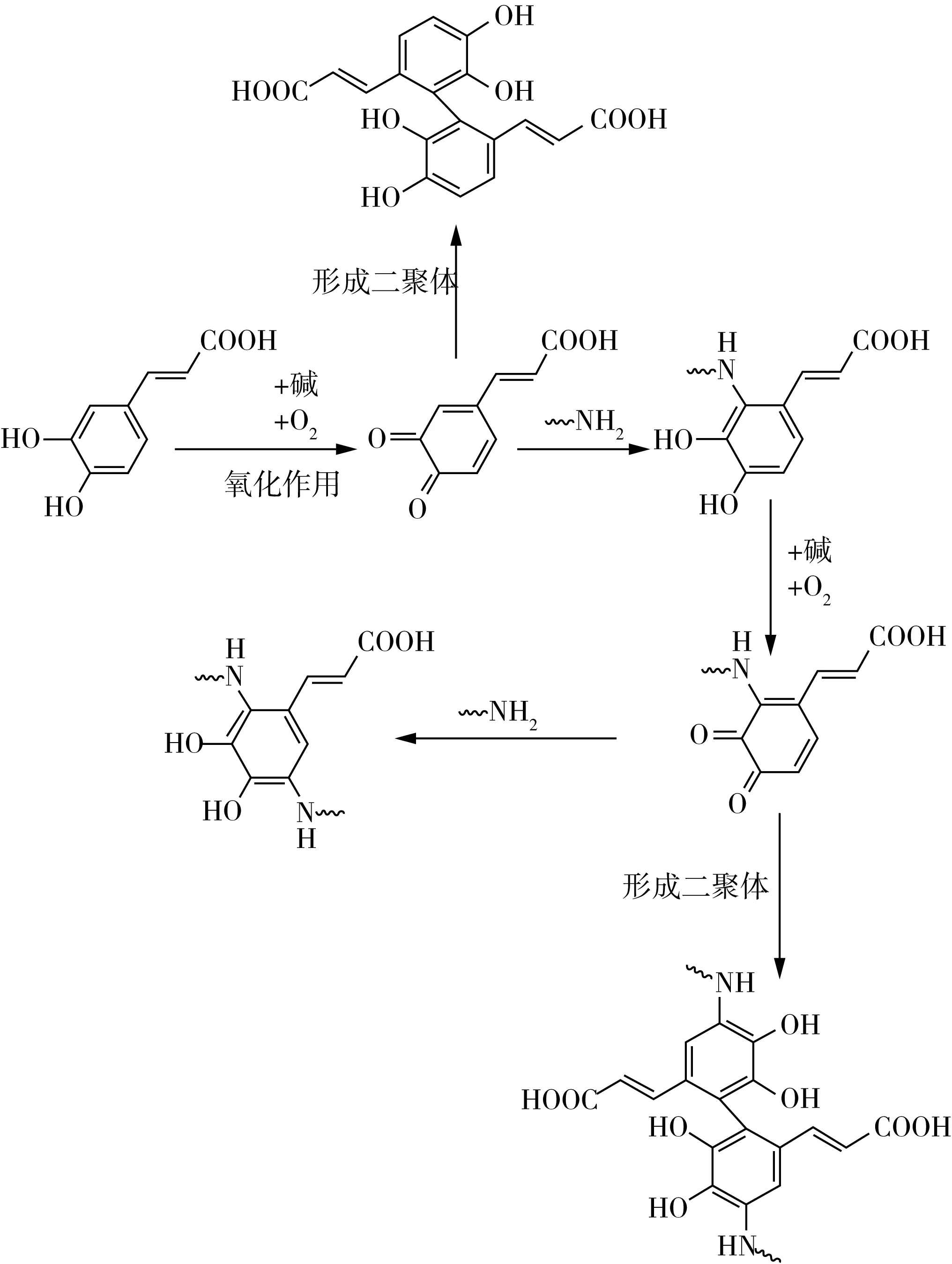
图3 碱处理形成蛋白质-多酚偶联物的机理[18]
2 研究蛋白质与多酚相互作用的分析方法
由于蛋白质-多酚的相互作用较为复杂,没有单一的技术能提供全面的信息,一般通过多种技术进行表征。这些技术包括荧光色谱、圆二色光谱、傅里叶变换红外光谱、等温滴定量热法、差示扫描量热法、核磁共振光谱等。本文对部分分析方法进行简单阐述。
2.1 荧光光谱法
荧光光谱法又称荧光猝灭法,是研究多酚与蛋白质间相互作用的重要手段。荧光猝灭法又分为动态猝灭和静态猝灭。此方法可以测得多酚与蛋白质的结合点数和结合常数,分析多酚与蛋白质间作用力类型,还可计算结合距离和能量转移效率。Zou等[19]用荧光光谱法表征葡萄籽原花青素(GSP)与大豆分离蛋白(SPI)的相互作用,发现随着GSP浓度的增加,GSP对SPI的荧光猝灭作用更加明显且主要是静态猝灭,即证明了二者确实形成了复合物。Ren等[20]的研究表明,相比β-伴大豆球蛋白,与氰基-3-O-葡萄糖苷(C3G)结合能力更强的大豆球蛋白在荧光猝灭中有更大的结合常数。
荧光猝灭法能得到较可靠的表征参数,但其也有对环境敏感,易受干扰,无法确定多酚与蛋白质相互作用的结合位点等缺点。
2.2 圆二色谱法(CD)
蛋白质的远、近紫外圆二色谱可分别用于观测蛋白质的二、三级结构变化,也常被用于表征多酚与蛋白质相互作用。如Al-Hanish等[21]通过圆二色谱发现EGCG与牛α-乳蛋白相互作用诱导了α-螺旋向β-结构的转变;相反,Ren等[22]则通过圆二色谱发现大豆蛋白与C3G结合会诱导大豆蛋白的β-折叠结构转变为α-螺旋和无规卷曲。可以发现,不同的蛋白质与多酚相互作用导致其二级结构的变化也不尽相同。
2.3 等温滴定量热法(ITC)
等温滴定量热法主要用于检测多酚与蛋白质相互作用过程中的热力学变化,可得到如亲和力、熵、焓、比热容以及化学计量学的信息,因此可以直接和定量测量多酚与蛋白质之间的相互作用及其对多酚或蛋白质结构的影响。例如C3G与SPI的相互作用结合常数Ka较大,熵值为负值,焓值相对较低,即可分别说明二者相互作用亲和力较高,反应为焓驱动且作用力为非共价作用[20]。
等温滴定量热法灵敏度高、重复性好,可一次性测定多个结合参数,受沉淀影响小,但也有加热效应弱、测试耗时等缺点。
2.4 核磁共振光谱法(NMR)
核磁共振光谱法通过检测分子结构中标记的碳元素的化学位移,来表明多酚与蛋白质是否发生结合作用或构象的改变。多酚-蛋白质相互作用的所有结合位点都与特定NMR峰相关。Faurie等[23]采用NMR成功表征了糖通过螯合部分多酚,降低其与唾液蛋白结合的有效浓度,间接起到抑制涩味的过程。Lucarini等[24]也通过此技术发现儿茶素与胶原蛋白的结合位点在儿茶素B环与胶原蛋白的脯氨酸(Pro)或羟脯氨酸(Hyp)之间。
NMR可精确识别结合位点信息,解释相互作用机理,但也存在需样量大、对样品浓度和稳定性要求较高、图谱解析复杂等问题。
3 蛋白质与多酚相互作用的影响因素
3.1 温度
在蛋白质与多酚的体系中,温度主要会影响氢键和疏水相互作用。当温度升高时,氢键作用力减弱甚至消失,疏水相互作用力增强。大部分研究报道指出,蛋白质对多酚的亲和力随温度升高而降低[12]。Kaspchak等[25]研究指出,温度升高不利于BSA与单宁酸的相互作用,并解释可能是温度升高使蛋白质空间结构改变所致。
温度持续升高会还导致蛋白质与多酚的作用形式发生改变,如Condict在[26]超高温至140 ℃瞬时条件下研究了β-酪蛋白与阿魏酸之间的温度诱导相互作用,发现阿魏酸在热处理后与蛋白质共价结合。即温度过高会诱导蛋白质与多酚之间共价键的产生。此外,温度也会影响多酚的稳定性,例如,红酒和葡萄皮中的花青素在温度升高时会发生降解[27]。
3.2 pH
pH对蛋白质和多酚相互作用的影响较为复杂,其不仅能影响多酚与蛋白质的结合程度;还能通过影响多酚在溶液中的化学结构进而影响相互作用力的种类,例如使多酚在碱性pH下产生自由基和醌式结构。
在酸性条件下,多酚与蛋白质之间的相互作用主要为非共价相互作用。这种作用在稍低于蛋白质等电点时的pH环境中最强,因为此时蛋白质与多酚的静电排斥力最弱[1]。在碱性条件下,多酚易被氧化,从而与蛋白质生成共价键,且共价结合程度随 pH的增加而加强。
pH的影响效果在具体反应中也有所差异,如Rawel等[12]发现在非碱性pH范围内,当pH升高时,BSA与槲皮黄酮和没食子酸的结合常数增加,而BSA与阿魏酸、绿原酸的结合常数减小,结合量增大。
pH还可以在一定程度上决定蛋白与多酚结合的影响因素,例如Engstrom等[28]研究了BSA与7种水解单宁或表没食子儿茶素没食子酸酯(EGCG)的相互作用。当pH为7.6时,单宁的氧化性是影响单宁-牛血清白蛋白络合物形成的主要因素。然而,在稍低的pH即6.7左右,其他单宁特征,如单宁的大小和弹性,决定了高度稳定的单宁-蛋白质复合物的形成。
3.3 多酚化合物种类和结构
多酚化合物自身的分子大小、形状和所带没食子酰基基团和羟基数量都会影响其与蛋白质的反应。Dobreva等[29]研究了不同分子量和分子形状的鞣花单宁与BSA的相互作用,结果发现,鞣花单宁的分子柔性越高、自由没食子酰基越多时,其与BSA的结合常数越大,结合位点越多。相似的,Liu等[9]发现玉米醇溶蛋白与EGCG和槲皮素的相互作用比与绿原酸强。EGCG和槲皮素的酚羟基数量多于绿原酸可能是这种现象发生的原因。
即使是结构上微小的差异也会导致酚类与蛋白质相互作用发生改变[30],例如Rezende等[31]研究人血清白蛋白(HSA)与白藜芦醇(RES)及其类似物RESAn1结合的热力学和动力学。结果表明RES和RESAn1的结构上的微小差异显著影响了与HSA形成复合物的热力学和动力学。
此外,酚类物质羟基的位置和甲基化也会导致其与蛋白质结合亲和力的改变,例如Wu等[32]用71种酚酸及其衍生物来研究其与β-乳球蛋白结合的亲和性关系,研究发现在3位上的羟基化增加了酚酸对β-乳球蛋白的亲和力,而在2位或4位上的羟基化产生了负面影响。用2位甲基取代羟基对结合也具有积极作用。
3.4 蛋白质结构和性质
蛋白质与多酚间的相互作用也受蛋白质分子量、疏水性、等电点和氨基酸组成等因素影响。未折叠蛋白质比致密和球形蛋白质对多酚有更强的亲和力[33,34]。Girard等[35]用缩合单宁(PA)与不同分子量的面筋蛋白反应发现PA优先结合更大的蛋白质组分。这进一步表明了多酚更倾向于与分子量大的蛋白组分反应。
此外,蛋白质表面的脯氨酸含量也决定了蛋白质和多酚之间的结合能力。富含脯氨酸的蛋白质通常分子柔性好,例如明胶的特殊结构大大增加了肽键与多酚形成氢键的几率[36]。Chanphai等[37]的研究成果也证明了这一点,即三种蛋白质对多酚的亲和力顺序为β-酪蛋白>α-酪蛋白>β-乳球蛋白,其中β-酪蛋白脯氨酸含量最高。
3.5 其他因素
溶剂中盐浓度、超声辐射、高压条件等因素也可以影响多酚与蛋白的相互作用。例如Kaspchak等[38]研究发现离子强度会影响BSA与单宁酸的相互作用,即高离子强度可使单宁酸与牛血清白蛋白之间的亲和力更大。研究发现二价阳离子可以增加蛋白质与单宁结合的亲和力,影响蛋白质与单宁结合的焓和熵的变化[39]。
其他方面,Chen等[40]研究发现高静水压(HHP)可以通过改变大豆蛋白的二级结构来影响其与茶多酚的相互作用。在HHP处理下,茶多酚使蛋白质溶解度提高,乳化活性提高近3倍,最高可达43.5%。Zhang等[41]研究发现,超声处理可以有规律地影响EGCG与BSA的相互作用,并能诱导BSA的构象变化。
4 多酚与蛋白质相互作用对其性质的影响
4.1 对加工性质的影响
蛋白质与多酚的相互作用会引起蛋白质结构的改变,包括其亲-疏水性,热稳定性和溶解度等,从而进一步影响蛋白质的功能性质,包括其乳化性、起泡性等。同时,蛋白质-多酚结合物的功能性质受蛋白质类型、多酚类型和它们发生相互作用的环境的影响很大。
多酚和蛋白质之间的反应既可能促进蛋白质溶解[7],也可能降低它们的水溶性[10]。例如Jiang等[42]研究乳清分离蛋白和酪蛋白与绿原酸在pH 7.0的室温下的非共价相互作用,发现其蛋白质-多酚复合物的溶解性相比原蛋白得到了提高,这一发现可以使绿原酸应用于乳制品中,从而改善其中蛋白质的溶解性和起泡性,提高产品的氧化稳定性。当非极性多酚与蛋白质发生非共价相互作用时,结果则可能相反,例如缩合单宁与丝素蛋白在中性条件下形成非共价相互作用会显著导致其溶解度显著降低[10]。但由于其抗溶性提高,也增加了其在生物医药、食品包装和其他领域的应用价值。共价作用方面,在pH≥8.0时,溶菌酶在绿原酸存在下的溶解度下降,是由于绿原酸碱性条件下氧化形成醌[43]。故蛋白质与多酚相互作用一般会使溶解度降低,但影响也存在一定差异性。另一方面,蛋白质与多酚的相互作用形成复合物,也有助于提高多酚的溶解性和稳定性。Xu等[30]研究指出β-LG与蒽酮类物质的络合可显著提高蒽醌类化合物的水溶性。类似地,Liu等[44]研究发现卵清蛋白作为载体能显著提高姜黄素的水溶性和光稳定性,姜黄素的溶解度比游离姜黄素提高了370倍,光稳定性也显着提高。
乳化性质方面则表现为极性多酚与蛋白质反应常常能够改善原蛋白质的乳化性质,如Sui等[45]研究花青素与SPI的相互作用发现二者倾向于发生共价结合。与花青素络合后,SPI的乳化和发泡性能得到改善,这一发现为花青素在豆奶饮品中的添加应用提供了理论基础。Karefyllakis等[11]也发现绿原酸和向日葵分离蛋白(SFPI)形成复合物对SFPI界面和乳化性质有利,这种作用除了使乳化性质增强外,还能在油水界面处增强其抗氧化能力,故复合物有作为胃肠道中的载体系统的潜力。
相互作用也会导致产物的热稳定性发生变化,例如Yan等[46]研究发现鞣花酸可以改善了卵清蛋白的热稳定性。此外,EGCG与SPI结合得到的共价复合物有更高的热稳定性,即热变性温度提高[47]。可以看出,蛋白质与多酚相互作用是一种潜在的提高蛋白质热稳定性的方法。
4.2 对营养价值的影响
蛋白与多酚的相互作用也会影响蛋白质的营养价值和消化率,且产生的主要是不利影响。这主要是由于相互作用对必需氨基酸的破坏和酚类成分对消化酶活性的抑制。Zhou等[47]研究EGCG与SPI的相互作用发现其产生共价复合物的相应抗消化能力更强,因此在肠道消化率降低。另一方面,Sun等[48]研究多种多酚对猪胰腺α-淀粉酶(PPA)的体外活性抑制作用发现单宁酸、绿原酸和咖啡酸对PPA的抑制作用较强。证实了多酚类物质对消化酶活性的抑制能力。Rawel等[12]通过研究类黄酮、黄酮、芹菜素、山奈酚、槲皮素和杨梅素与大豆蛋白的相互作用会导致大豆蛋白中的赖氨酸、半胱氨酸和色氨酸残基的减少。由此看出多酚与蛋白质相互作用可影响必需氨基酸的生物利用率从而改变蛋白质的营养价值。
除此之外,蛋白与多酚的相互作用也能在一定条件下起到有益作用,如Wu等[49]通过将β-LG与EGCG和绿原酸共价结合成功降低了β-LG的致敏性。
4.3 对抗氧化活性的影响
抗氧化活性也是蛋白质多酚复合物的重要性质之一。大量研究表明,不论形成共价或非共价复合物,其抗氧化活性都显著高于对照蛋白。Jiang等[42]研究发现,高浓度绿原酸和两种蛋白质在中性条件下形成的非共价复合物均表现出相较于对照蛋白更强的清除自由基活性。Zhou等[47]则用SPI与EGCG碱性条件下共价结合,生成的复合物抗氧化活性更高。同样的,Ma等[10]的研究也有相似的结论,丝素蛋白-单宁复合膜展现出了丝素蛋白本身不存在的抗氧化活性,且其活性与单宁浓度呈正相关。蛋白质与多酚复合物的抗氧化活性由于多酚中的羟基引入蛋白质中而增加。Wu等[32]研究酚酸与β-乳球蛋白相互作用发现酚酸-β-乳球蛋白复合物的抗氧化活性高于单独的酚酸,推测是β-乳球蛋白与酚酸的抗氧化活性产生的协同作用。因此,蛋白质多酚复合物可以用来增强抗氧化性能,改善食品的氧化稳定性。
5 结论与展望
蛋白质和多酚都有其独特的功能特性和营养价值。蛋白质除了作为营养物质外还拥有乳化性和起泡性等加工特性;多酚具有生物活性,与蛋白质有较高亲和度的同时还对人体健康有利。蛋白质与多酚的相互作用受到环境条件以及蛋白质和多酚的类型或结构的影响,并且会引起其加工性质、营养价值、抗氧化活性等方面的变化。蛋白质与多酚的相互作用能够拓宽蛋白和多酚的应用领域,赋予其新的价值,并可能进一步影响其所在食品体系,如增强食品的抗氧化活性、改善乳化性、改变营养价值等。因此,可通过研究来自不同食物来源的蛋白质和多酚的结合,以开发具有更好的营养、功能、感官质量以及生物活性的新食物成分或产品。
