离子强度对菜籽分离蛋白气液界面行为及泡沫特性的影响
2021-04-07姚轶俊刘昆仑熊文飞王立峰
王 梅 姚轶俊 刘昆仑 熊文飞 王立峰
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心1,南京 210023) (河南工业大学粮油食品学院2,郑州 450001)
我国是油菜种植大国,油菜的产量常年位列全球首位,菜籽制油后剩余的菜籽粕每年可达700万t以上,其中含有大量未利用的菜籽蛋白,但是目前我国的菜籽蛋白利用率很低,主要原因有:一是菜籽中有一些不易去除的有害物质,如硫苷、芥酸等,会对菜籽蛋白的营养价值产生一定影响;二是目前我国对菜籽蛋白的研究程度还不深入,未能构建出产业链条[1]。目前,我国的菜籽粕主要还是用于废料或者动物饲料,不利于我国油菜种植业的可持续发展,如何充分利用菜籽粕中的蛋白质,开发出相应的具有功能特性和生理活性的产品,是当前面临的一项重要挑战。菜籽粕中重要的蛋白质包含清蛋白和球蛋白,均为贮藏性蛋白。菜籽蛋白营养丰富,营养价值高,尤其是菜籽粕中氨基酸模式平衡[2]。且对菜籽蛋白的消化比率为2.64,大豆蛋白为2.19[3]。菜籽蛋白的潜在价值高,可用于食品开发[4]。而且,菜籽蛋白的蛋白质利用率、净利用率和生物学价值均高于其他植物蛋白[5]。NaCl和CaCl2在植物蛋白如大豆蛋白中有着广泛的应用,可以使植物蛋白的组织结构发生一定改变,从而增强其溶解性、疏水性、起泡性及起泡稳定性。当溶液体系中的离子强度发生变化时,蛋白质分子的静电相互作用和疏水相互作用也相应发生改变,从而导致蛋白质的二、三级结构发生变化。有研究表明,在NaCl的作用下,大豆蛋白二级结构中的α-螺旋结构的比例呈现出减少的趋势,而β-折叠和无规则卷曲结构的比例则呈现出相反的变化趋势。同时,NaCl产生的电荷屏蔽效应也使其原有的三级结构也遭到破坏。为了更好地了解菜籽分离蛋白食品分散体系的特性,本实验系统研究了不同浓度、pH值和不同离子强度条件下菜籽分离蛋白在气液界面上的吸附动力学。
1 材料与方法
1.1 实验材料
双低菜籽收购于安徽当地的市场,所用的实验试剂蛋白质质量分数为50.5%,含水量为4.9%,残油量0.2%,豆粕经研磨粉碎,过100目筛备用。
1.2 仪器与设备
DF-101S型恒温加热磁力搅拌器,FW100型高速万能破碎机,TGL-16G型高速离心机,FD-1型真空冷冻干燥机,PHS-3C型pH计,ZK-82A型高炉干燥炉,UV2600型紫外可见分光光度计,S-3400N型扫描电镜,Q2000型差示扫描量热分析仪,Dycz-24d型微型垂直电泳槽,YY-5型电压电流电泳仪,F7000型荧光光度计,XW-80A型Zeta电位和纳米粒度仪,OCA20型视频光学测量系统。
1.3 实验方法
1.3.1 菜籽分离蛋白的制备
首先将菜籽粕倒入粉碎机中进行粉碎,然后用80目的筛子进行过筛。将过完筛的固体粉末加入到石油醚中,在30~80 ℃的温度下脱脂12 h,而后将其倒入NaOH溶液中开始菜籽蛋白的提取,浸泡之后将溶液放入离心机中,5 000 r/min离心20 min,收集上层清液。用1 mol/L的HCl调节上清液pH值, 5 000 r/min再次离心20 min,收集得到的沉淀物,用去离子水冲洗沉淀物至中性,冷冻干燥,得到菜籽分离蛋白。
1.3.2 界面压力的检测
采用动态滴形分析法来对菜籽分离蛋白溶液在气液界面上的界面张力(σ)随吸附时间(t)变化规律进行分析,采用的分析仪器仍为OCA20食品光学接触角测量系统。本章所进行的全部吸附实验均在室温进行,菜籽分离蛋白溶液质量分数为0.5%,pH 7,离子强度分别为0、10、20、50、100 mmol/L,每次实验持续时间为180 min。
1.3.3 起泡性及起泡稳定性测定以及泡沫照片
菜籽蛋白的起泡性及起泡稳定性实验方案是[6],用电子分析天平准确称取菜籽蛋白100 mg,将其溶解在10 mL的去离子水中,用0.1 mol/L的HCl或者NaOH溶液将菜籽蛋白溶液的pH分别调节至5、7、9、11,然后离心机以1 000 r/min离心1 min,量取初始泡沫体积,之后每间隔5 min测一次泡沫体积,共测量12次。每次在同样条件下拍摄泡沫的形态。
起泡性(FA)=(起始泡沫体积/总泡沫体积)×100%
起泡稳定性(FS)=(60 min泡沫体积/起始泡沫体积)×100%
1.3.4 荧光光谱测定
荧光光谱法用于研究每种蛋白质溶液系统内部荧光基团微环境的影响,以反映蛋白质分子的构象变化和蛋白质之间的相互作用[7]。用F7000荧光分光光度计对菜籽蛋白溶液进行荧光光谱测试,发射波长为290~500 nm,激发波长为280 nm,发射和激发狭缝宽度均为5.0 nm,电压为550 MV,测量温度恒定在25 ℃。
1.4 数据处理
采用SPSS 20.0软件进行数据分析,结果均表示为平均值±标准偏差,应用Origin8.5进行图形绘制,每组实验重复3次。不同小写字母表示差异显著(P<0.05)。
2 结果与分析
2.1 表面压力随吸附时间的变化
图1是菜籽分离蛋白在质量分数为0.5%、pH 7,离子强度分别为0、10、20、50、100 mmol/L时,表面压力随吸附时间的变化曲线。从图1中可知,表面压力(π)在整个吸附过程中,随着离子强度的增大,其速率以及最大值迅速增加,这也表明菜籽蛋白分子逐渐吸附到气液界面上的速度越来越快。在离子强度为0 mmol/L,表面压力(π)的增加还是分为3个阶段,在0~1 000 s时,处于诱导阶段;而后在1 000~4 000 s时,进入快速增长阶段,表面压力(π)迅速增加,从图中也可以发现曲线在此范围内也有着最大的斜率;在4 000~12 000 s时,为缓慢增长阶段,表面压力(π)的最大值为8 mN/m。在离子强度为10 mmol/L时,诱导阶段为0~500 s,进入快速增长阶段后,π增大的速率提高,同时气液界面的π值更大,可以达到10 mN/m。而当离子强度进一步增大,达到20、50、100 mmol/L时,从π-t曲线上可知,诱导期消失,从吸附一开始,表面压力(π)便迅速上升,并且表面压力随着离子强度的增大而增大,在离子强度为100 mmol/L时,达到最大,为28 mN/m。

注:质量分数0.5%,pH 7,余同。图1 离子强度对菜籽蛋白表面压力的影响
离子强度对气液界面表面压力(π)有着显著的影响,离子强度越大,表面压力(π)上升速度越快,数值越大。这说明了在菜籽蛋白溶液中,随着金属离子的加入,使得菜籽蛋白分子的结构更加松散,更容易吸附到气液界面上,使得界面张力显著降低,表面压力显著增大[8]。
2.2 离子强度对气液界面扩散动力学的影响
当气液界面蛋白浓度较低时,表面压力(π)较小,可以用改进的Ward-Tordai扩散模型表示π和t的关系。不同离子强度下的π-t1/2曲线如图2所示,特征参数和相应的线性回归系数如表1。在离子强度为0、50 mmol/L时,菜籽分离蛋白溶液的π-t1/2曲线图是相似的,诱导期很短,斜率较大,表面压力π的值也大体相同。而在离子强度为10 mmol/L时,气液界面的表面压力π值却大幅下降,π值小于10 mN/m,此时和Ward-Tordai扩散模型有着良好的相关性,π-t1/2曲线近似一条直线,表明了在离子强度为10 mmol/L时,菜籽蛋白分子的吸附动力学受扩散作用影响。在离子强度为20 mmol/L时,相比于离子强度为10 mmol/L,诱导期缩短,斜率变大,π值增大到15 mN/m。

图2 菜籽蛋白在不同离子强度下的气液界面扩散动力学特征曲线
离子强度对扩散动力学有着明显的影响。从表1中发现,离子强度开始增加时,诱导期边长,π-t1/2曲线的斜率变小,扩散控制吸附动力学的时间变长。原因可能时随着溶液中离子强度的增加,带电荷的离子和菜籽蛋白分子发生了相互作用,菜籽蛋白分子表面电荷耗尽,这导致了菜籽蛋白分子之间的静电斥力减少,菜籽蛋白分子之间发生了团聚,使得溶解度下降,疏水性变差,导致扩散速度降低,表面压力下降[9]。随着离子强度的进一步增强,菜籽蛋白分子表面电荷开始增多,蛋白分子之间的静电排斥力又重新开始变大,此时溶解度开始上升,疏水性也提高,使得表面压力开始增大,在离子强度为50mmol/L时,菜籽蛋白分子表面的电荷量与离子强度为0时的电荷量基本一致,此时从π-t1/2曲线上看,就会发现这2种条件下曲线走向趋势和表面压力π的最大值极为相似。
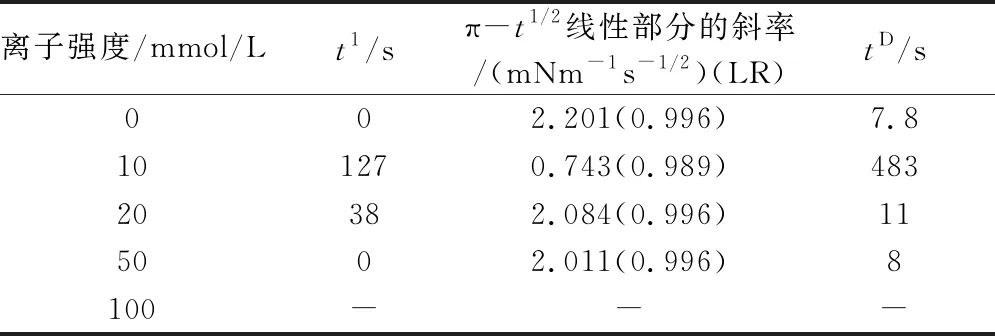
表1 离子强度对菜籽分离蛋白气液界面扩散动力学特征参数影响
总体来说,在离子强度为10 mmol/L时,表面压力π小于10 mN/m,菜籽分离蛋白在气液界面上的吸附动力学由扩散控制,π-t1/2曲线呈直线,与Ward-Tordai扩散模型相符,扩散速率随着离子强度的增大而加快。
2.3 离子强度对气液界面展开和重排动力学的影响
由图3可知,随着离子强度的进一步增大,在表面压力π大于10 mN/m时,π-t1/2曲线呈曲线的形式,偏离直线,这就说明了在离子强度较大时,扩散不在控制吸附动力学。这是因为,随着π的增大,扩散作用所需的能量进一步增大[10]。此时,吸附速率是由蛋白质分子在气液界面上获得空间进而使其展开和重排的能力所确定。
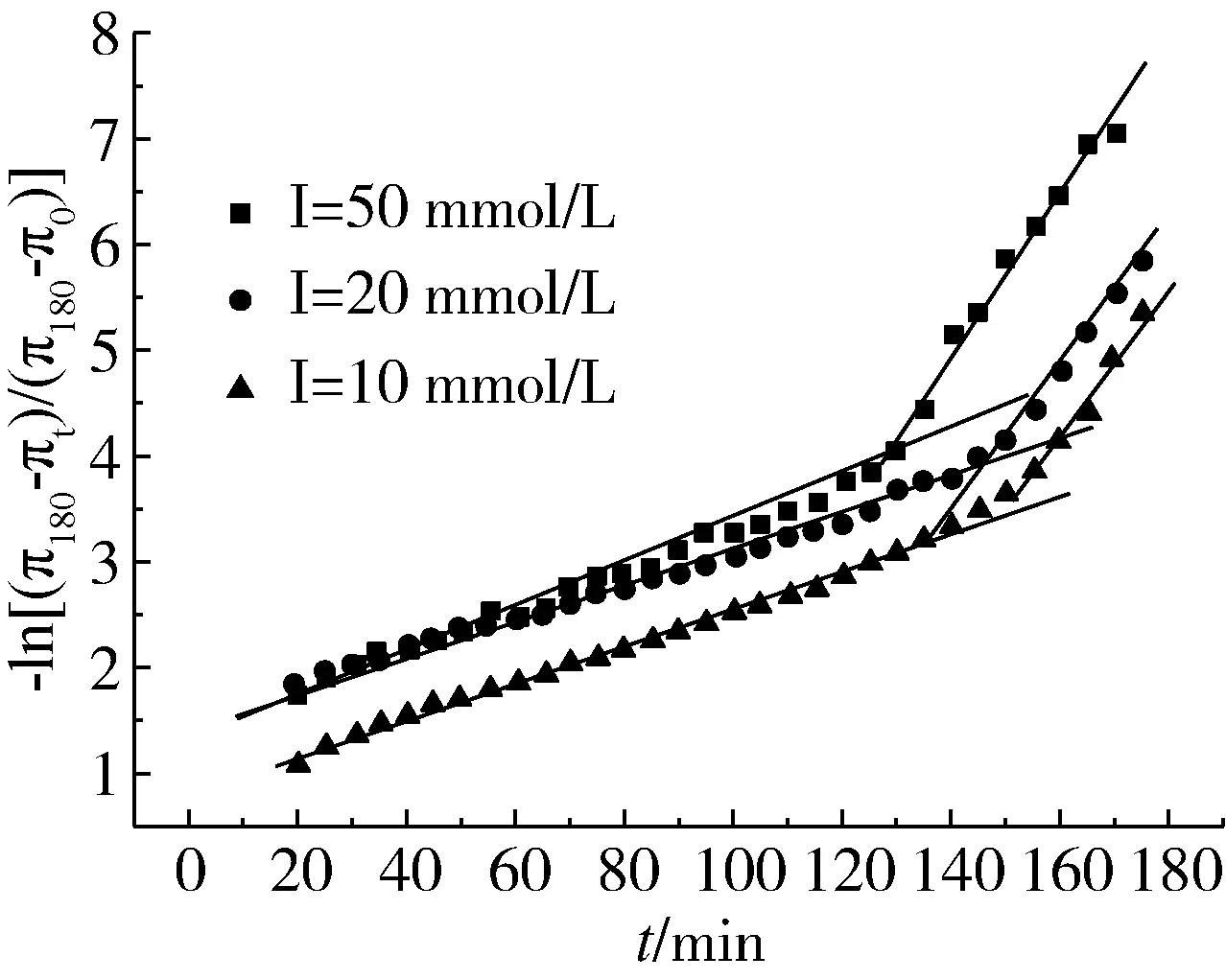
图3 菜籽蛋白在不同离子强度下的气液界面展开和重排动力学特征曲线
对于π值大于10 mN/m的监测体系,扩散控制吸附过程之后,ln[(π180-πt)/(π180-π0)]-t曲线产生了2个线形区域,这2个区域代表了菜籽分离蛋白分子在气液界面展开KP和重排KR的第一速率常数,由此可以断定,菜籽蛋白扩散到气液界面后,展开和重排机制控制吸附动力学。
从表2可知,离子强度影响着展开和重排动力学参数的大小,总体的变化趋势是,随着离子强度的增大,KP和KR的数值也在不断增大,这就说明了在较高的离子强度下,蛋白分子更容易进行展开和重排。这说明了,离子强度的增大,菜籽分离蛋白的柔性增强,蛋白分子的疏水基团有更大的概率暴露在气液界面上,同时离子强度大,使得气液界面的张力减小,导致展开和重排的速率加快。在离子强度为50 mmol/L时,KP和KR均高于其他离子强度下的KP和KR值。这说明了在高离子强度下,菜籽蛋白的结构会变得松散,展开的蛋白分子更容易渗透吸附,也更容易在气液界面上发生展开和重排[11~13]。

表2 离子强度对菜籽分离蛋白向气液界面上展开和重排动力学特征参数的影响
总体来说,当π值大于10 mN/m时,π与吸附时间之间的线性变化复合第一速率方程,ln[(π180-πt)/(π180-π0)]-t曲线产生了两个线形区域,菜籽蛋白分子在气液界面的吸附动力学由展开和重排机制控制。展开和重排速率受到离子强度的影响,随着离子强度的增大,展开和重排速率也随着变大,在离子强度较低时,蛋白分子较为团聚,难以在界面展开和重排[14]。
2.4 离子强度对起泡性及泡沫稳定性的影响
菜籽分离蛋白质量分数为0.5%,pH值为7,离子强度分别为为0、10、20、50、100 mmol/L时,菜籽分离蛋白的起泡性能及泡沫稳定性图及泡沫体积随时间变化图如图4所示。
离子强度对起泡性的影响主要是通过改变菜籽蛋白的溶解度实现的。从图4可知,随着离子强度的增大,菜籽分离蛋白的起泡性逐渐增大,这是由于高的离子强度可以提高菜籽蛋白的溶解度[15],而溶解度的增大就可以获得良好的起泡性。当离子强度较低时,溶解的菜籽蛋白较少,溶液中的菜籽蛋白主要以固体的形式存在,起泡性较差,随着离子强度的逐渐增强,溶解度增大,此时菜籽蛋白溶液中溶解的和未溶解的菜籽蛋白比例越发得当,经过搅拌后,有固液气三相泡沫产生,而且固液面相接触的面积越来越匹配,阻止了起泡的粗化,故起泡性最好[16]。
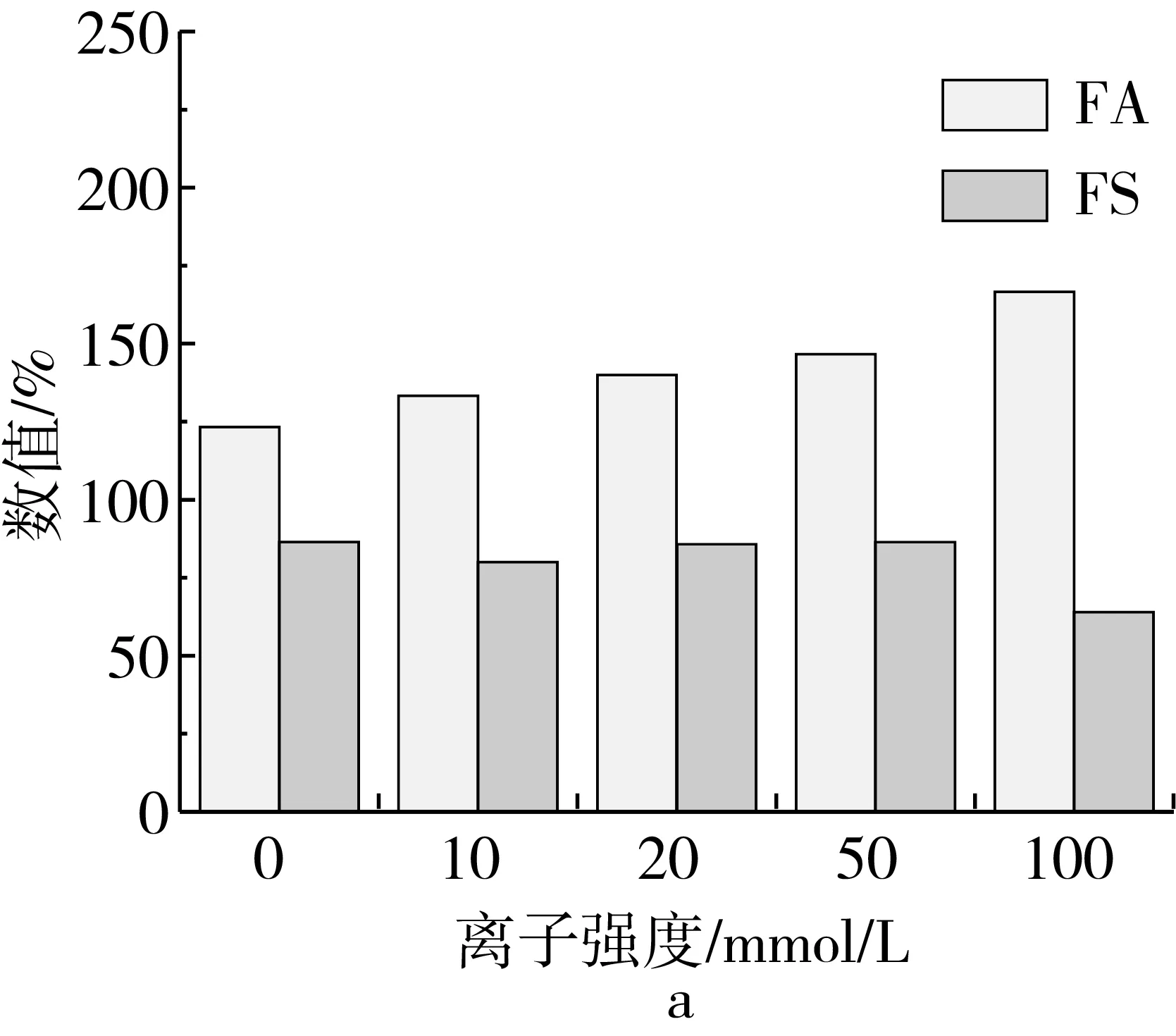

图4 菜籽蛋白在不同离子强度下的起泡性和泡沫稳定性
从图4可知,菜籽分离蛋白的泡沫稳定性随着离子强度的增大而降低。从图5可知,离子强度越大,初始泡沫体积和稳定态泡沫体积之差越大,这也从另一个角度证明了离子强度增大泡沫稳定性降低这一现象。影响泡沫稳定性的因素有两点:一是在泡沫的形成过程中蛋白质分子界面膜的形成;二是形成的界面膜的流变学特性。
因此,若要有高的泡沫稳定性,则在每个泡沫的周围都要有一个厚的、弹性好、连续且不透气的膜。菜籽蛋白分子在柔性较好时,会促进分子在气液界面发生重排,这便使得相邻的分子快速的结合,从而在周围形成了一个高弹性的膜。而在很高的离子强度下,会导致菜籽蛋白的分子结构柔性下降[17],使得其难以在气液界面发生重排,这会使高弹性膜的形成变得更加困难,进而导致了菜籽分离蛋白溶液的泡沫稳定性降低。图5是菜籽分离蛋白浓度为0.5%,pH值为7,离子强度分别为为0、10、20、50、100、200 mmol/L时,菜籽分离蛋白溶液的发泡照片,从照片中也可以发现随着离子强度的增大,溶液泡沫逐渐增多,且泡沫越发致密,这与前面得到的结论是相符和的[18]。

图5 菜籽蛋白发泡照片
2.5 不同离子强度下的菜籽分离蛋白荧光光谱分析
菜籽分离蛋白质量分数为0.5%,pH值为7,离子强度分别为为0、10、20、50、100 mmol/L时的菜籽分离蛋白溶液荧光光谱图如图6所示。
从图6可知,与不含有金属离子的荧光图像对比发现,在离子强度为10、20、50 mmol/L时,菜籽分离蛋白的荧光强度发生了显著的下降。对比最大吸收峰所处的波长也可以发现,在离子强度为0时的波长为320 nm,而在离子未强度为10、20、50 mmol/L时,最大吸收峰的波长分别为303、319、330 nm,先发生小幅度的蓝移,之后开始红移。在发生蓝移的时候,说明菜籽蛋白中的色氨酸残基所在的环境极性降低。同时荧光强度的降低说明了菜籽蛋白的构象发生了改变[19]。在溶液中,蛋白分子本身所携带的电荷和离子电荷发生了中和,使得蛋白分子本身的带电量下降,分子之间的排斥作用降低,蛋白分子之间发生团聚,使得芳香族的氨基酸在溶液中的暴露程度下降。同时蛋白质的聚集也会导致二硫键的形成,而二硫键对芳香族的氨基酸残基有着较强的淬灭作用,进而也导致了荧光强度的下降[20]。同时也有研究表明[21-22],在蛋白分子发生团聚时,芳香族的氨基酸之间会发生能量的转移,这也会使荧光强度下降。在离子强度为100 mmol/L时,最大吸收峰所在处波长为334 nm,发生红移,同时荧光强度发生显著增强,接近6 000 A.U.,比离子强度为0时,增长了近3倍。这说明了随着离子强度的进一步增大,溶液中电荷量的增多,蛋白质溶液中色氨酸残基的极性发生了增强。同时荧光强度的大幅增加说明蛋白质分子的构象也发生了改变,由于电荷量的增加,导致蛋白质分子之间的排斥作用重新增强,分子间不在发生团聚,柔性增强,变得更为舒展[23,24],使得芳香族氨基酸重新暴露在蛋白质的表面上,这就使得菜籽蛋白分子发生红移和荧光强度的改变。

图6 不同离子强度下菜籽分离蛋白荧光光谱图
3 结论
本文通过测定气液界面表面压力π的变化,研究了离子强度对菜籽分离蛋白气液界面的吸附动力学的影响,并讨论了离子强度对蛋白起泡性和起泡稳定性的影响。

随着离子强度的增大,菜籽分离蛋白的起泡性逐渐增大,在pH值为11时有小幅下降;在很高的离子强度下,会导致菜籽蛋白的分子结构柔性下降,导致了菜籽分离蛋白溶液的泡沫稳定性降低。
荧光光谱分析表明随着离子强度的增加,菜籽蛋白构象先发生团聚,而后又逐渐展开,在谱图上体现为荧光强度先降低在增加,最大吸收峰所处波长先发生蓝移,再发生红移。
