贝类中麻痹性贝类毒素的蓄积及代谢研究进展
2021-04-07呼晓群解万翠董泽群杨锡洪
呼晓群 解万翠,2 李 敏 董泽群 杨锡洪,2
(1. 青岛科技大学海洋科学与生物工程学院,山东 青岛 266042;2. 山东省生物化学工程重点实验室,山东 青岛 266042)
海洋赤潮中有毒甲藻产生的毒素可经食物链蓄积于贝类、鱼类等体内,对水产加工产业和公众健康造成潜在威胁[1-2]。其中,麻痹性贝类毒素(Paralytic Shellfish Toxins,PSTs)毒性强、分布广、衍生物多,甚至在北极楚科奇海和临近北极的白令海的底栖软体动物也被PSTs污染[3]。中国最近一次的PSTs中毒事件发生在2019年5月,河北省秦皇岛等地发生赤潮,期间有人疑似食用受PSTs污染的贻贝引起中毒。麻痹性贝类毒素通过阻断神经细胞膜上的钠通道和抑制动作电位的转导来攻击神经系统。PSTs主要源自淡水蓝藻和海洋鞭毛藻,如亚历山大藻属(Alexandrium)、裸甲藻属(Gymnodinium)等。双壳贝类由于其滤食性特征能过滤海水摄食有毒藻,并通过食物链中的营养转移导致人类麻痹性贝类毒素中毒。近年来海洋污染加剧有害赤潮频发,由此导致的PSTs污染及中毒事件日益受到人类的关注。
科研人员[4-7]在实验室条件下模拟双壳贝类在自然条件下摄食有毒藻的过程,研究了PSTs从毒藻到贝类的蓄积、转化及排出过程。文章拟从PSTs的蓄积、转化、代谢及净化对麻痹性贝类毒素的相关研究进行综述。
1 PSTs食物链蓄积的特异性
PSTs可通过食物链富集于许多海洋生物中,包括双壳类、棘皮动物、甲壳类动物、被囊动物、头足类动物、腹足动物和鱼类等,其蓄积具有物种特异性。Terrazas等[8]对智利部分海域的水生生物进行了STX毒素组的毒性分析,发现毒素含量为岩石地层双壳类>沙地双壳类>腹足类>被囊类>棘皮类动物>头足类>鱼类,且毒素含量较高的为膝沟藻毒素(GTX3/GTX2)>石房蛤毒素(STX)>膝沟藻毒素(GTX4/GTX1)>新石房蛤毒素(neoSTX)>脱氨甲酰基石房蛤毒素(dcSTX)。说明PSTs在整个食物链中的主要传递媒介为双壳贝类,与之相比,鱼类对PSTs的敏感程度比贝类更敏感,贝类可以累积一定量的毒素而本身无明显不利反应,但毒素在鱼体内较低水平累积便可导致鱼类死亡。
贝类滤食产毒藻不具有选择性,只要藻细胞大小合适,即可进入贝体内,PSTs最先累积在消化系统,之后随血液流动分散至其他组织。贝类蓄积PSTs的能力存在差异性,受贝种类、大小、暴露毒素期间的生理状态以及环境状况的影响,并且与其生长阶段有关[9]。
毒素除蓄积含量有物种特异性外,在不同组织中的毒性分布也具有特定性。一般情况下,贝的运动组织如闭壳肌等蓄积PSTs较少,消化腺或内脏团是贝体内PSTs累积最多的部位,蓄积含量最高可占贝体内总毒素的98%,同时消化系统中毒素的排出也相对其他组织要快[10-11],且PSTs在不同双壳贝类组织中的蓄积含量存在差异,这与不同贝类之间对有毒藻的消化吸收差异及选择性排出有关。Andres等[12]研究发现,前18 h内毒素主要存在于贻贝的外套膜中,之后逐渐向肠道转移,24 h后其主要蓄积部位为消化系统。Li等[13]对中国黄海北部的扇贝和蛤蜊进行了毒素分析,发现PSTs主要累积在扇贝的消化系统中。Estrada等[14]用G.catenatum喂食扇贝(Nodipectensubnodosus),发现消化腺中的PSTs浓度最高,其次是唇瓣、肠、鳃、外套膜和闭壳肌,内脏中的毒素含量超过了贝体的80%。邴晓菲等[15]将栉孔扇贝(Chlamysfarreri)直接暴露于产毒藻,发现贝体存在PSTs累积和生物转化,不同器官的PSTs累积含量按内脏团、性腺、外套膜和闭壳肌的顺序依次降低。Oyaneder等[10]对智利部分海域的双壳贝类不同组织中的毒素进行分析发现,各组织毒素含量为消化腺(81.5%)>斧足(8.6%)>外套膜(5.3%)>闭壳肌(4.6%)。厚蛤蜊[16]、麦哲伦海扇贝[17]以及薪蛤[18]、栉孔扇贝[19]等贝类中的闭壳肌是累积毒素最少的组织。但毒素的蓄积规律在某些种类的贝中存在例外,如奶油蛤(Saxidomusgiganteus)将其毒素集中在含黑色素较多的进出水管[20]。
2 PSTs的生物转化
PSTs是一类四氢嘌呤三环化合物毒素的总称,由STX及其衍生物组成,衍生物种类繁多,结构复杂多样,且在特定条件下可以发生相互转化,并对生物体内的代谢产生影响。
2.1 PSTs的分类
1957年,STX毒素首次从阿拉斯加石房蛤(Saxidomusgigangteus)中被分离出。由于STX高极性特征使其具有较差的结晶条件,因此阻碍了其结构的阐明,直至1975 年Bordner和Schantz两个团队确定了STX的结构(见图1)。自发现以来,在多种生物体中相继发现多种天然存在的STX类似物,统称为PSTs(见表1)。

图1 麻痹性贝类毒素的化学结构式Figure 1 Chemical formula of paralytic shellfish toxins
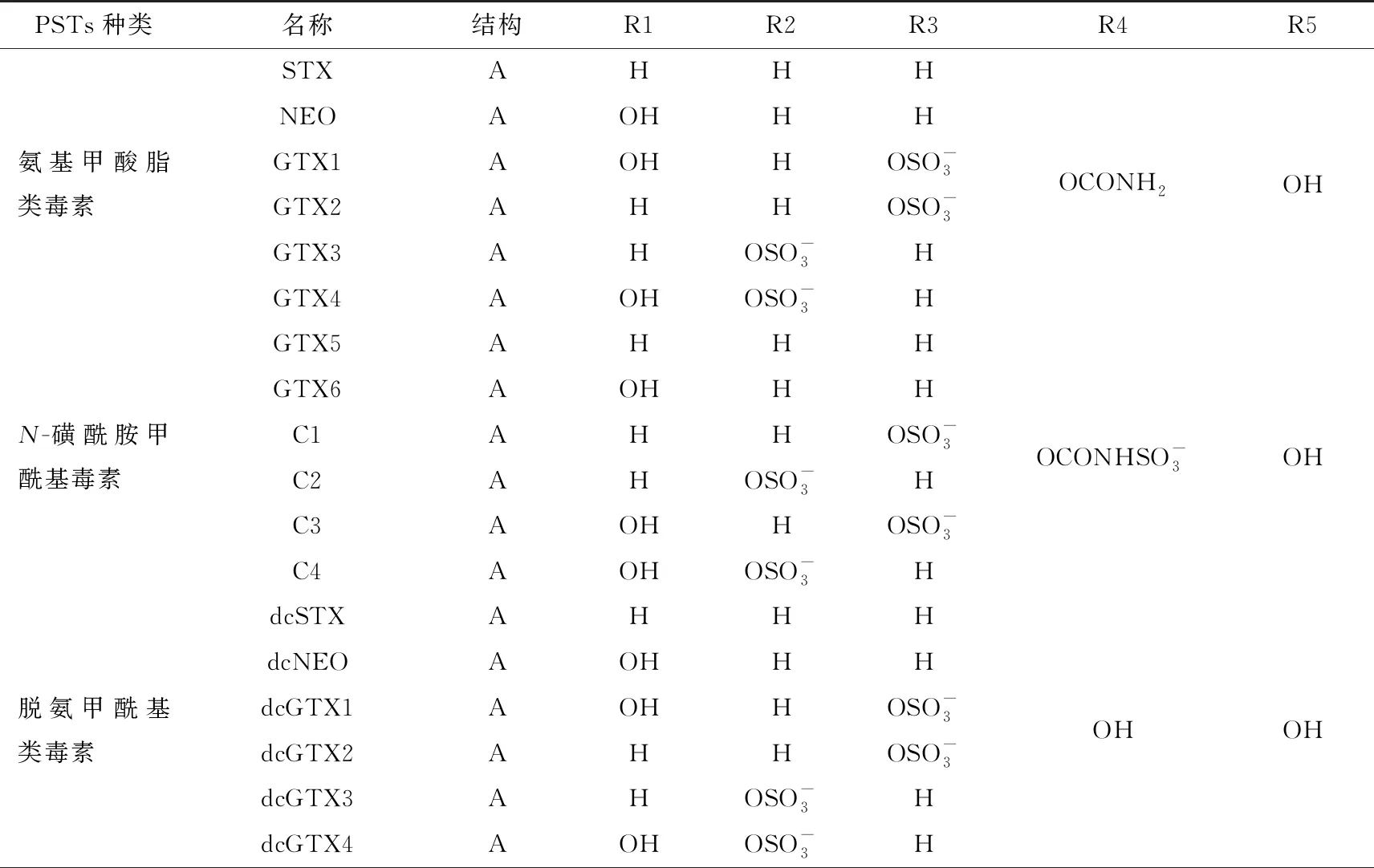
表1 麻痹性贝毒的种类及结构

续表1
对已发现的STX及其衍生物根据各可变取代基的不同进行分类命名,根据R4基团的不同可将常见的毒素分为4类:氨基甲酸酯毒素、N-磺酰氨甲酰基毒素、脱氨甲酰基毒素、脱氧脱氨甲酰基毒素。此外,PSTs衍生物还包括N-羟基衍生物、鞘丝藻毒素(LWTX1-6)[21]、Zetekitoxin AB[22]、安息香酸盐衍生物(GC1-6,GC1-6a,GCb1-6b)[23],以及PSTs在贝类体内的新型代谢产物(M1-12)[13,24-27]等,其中毒性最高的一类为氨基甲酸酯类毒素。
PSTs的结构由于碳骨架的存在较为稳定,但在一定条件下各可变取代基较易发生生物转化。C11上的R2,R3取代基存在同分异构现象,此外,毒性较小的PSTs也可转化为毒性较大的类似物(如C-毒素→GTXs类),反之亦然。因此,为了更准确地预测毒性水平,需更清楚地了解PSTs的相互转化。
2.2 PSTs的相互转化
PSTs在贝类的累积传递过程中会发生转化反应,且这种生物转化能力存在明显的种间差异,常见的蛤类、扇贝有较强的PSTs转化能力,而牡蛎、贻贝和其他贝类的PSTs转化能力相对较弱。田华等[4]通过培养A.minutum得到PSTs,研究了3种贝类的内脏、肌肉组织中PSTs的体外转化反应,包括菲律宾蛤仔(Ruditapesphilippinarum)、栉孔扇贝(Chlamysfarreri)和竹蛏(Solenstrictus),发现PSTs的体外转化存在明显的种间差异和组织特异性,其中Chlamysfarreri内脏对PSTs的转化能力最强,Ruditapesphilippinarum和Solenstrictus的内脏和肌肉对PSTs几乎无转化能力。类似地,邴晓菲等[15]研究指出,内脏团是扇贝体内PSTs蓄积和代谢的主要组织。
天然存在的PSTs可以通过各种生物学因素进行结构修饰,而贝类的生物转化会得到一些新的藻类不能单独合成的PSTs产物,根据已有研究[17,26,28-30],PSTs在贝内的转化(图2)主要包括① C-11位羟基磺酸基的差向异构化:甲藻细胞内以β型(C2、C3、GTX3、GTX4)为主的毒素在经贝类滤食后会向更稳定的α型毒素(C1、C4、GTX2、GTX1)转化,染毒2~5周后α∶β型毒素的比例趋于稳定,约为3∶1;②N-1或C-11位的还原反应:存在于贝类体内的天然还原剂谷胱甘肽、半胱氨酸等可促使PSTs分子中N-1位-OH或C-11位-OSO3H基团脱去,如NEO转化为STX,C1/2、C3/4转化为GTX5、GTX6;③ 水解反应:N-磺酰氨甲酰基毒素(GTX5、GTX6和C1-4)在贝体内或者低pH、温度升高的条件下可转化为相对应的氨基甲酸酯类毒素(STX、NEO和GTX1-4),该转化会导致贝类总毒性升高;④ 酶促反应:从双壳贝类体内分离出的氨甲酰基水解酶能催化R4基团的氨甲酰基或N-磺酰氨甲酰基水解,转化为相应的脱氨甲酰基类毒素(GTX1/4→dcGTX1/4、GTX2/3→dcGTX2/3以及C1/2→dcGTX2/3),且β型有比α型毒素更快的水解速率;⑤ C-11位的羟基化:贝类中的PSTs脱掉C-11位的亚硫酸根,生成一个羟基或两个羟基的衍生物(M-毒素)。
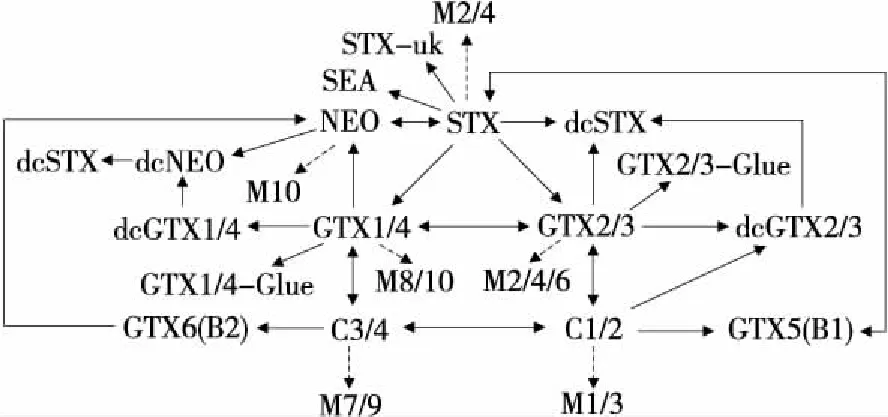
图2 PSTs的生物转化Figure 2 Biotransformation of different types of PSTs
近年来,随着检测技术和结构解析方法的改进,新型PSTs有所增加。Quilliam等[31]建立了亲水交互作用液相色谱电喷雾串联质谱(HILIC-ESI-MS)法,可同时分析主要的PSTs毒素。Dell’Aversano等[25]采用HILIC-ESI-MS法发现贻贝中存在毒藻中不存在的5种毒素类似物(M1~M5),并通过串联质谱、1D和2D-NMR光谱以及化学互转换试验确定了M1~M4的结构。Li等[13]在中国北部沿海采集的有毒扇贝(Patinopectenyessoensis)和蛤(Saxidomuspurpuratus)中使用HILIC-ESI-MS法检测到M1、M3和M5,以及3个未报告的假定代谢物M6、M8和M10。Ding等[26]收集并分析了2016年4月秦皇岛中毒事件中的致病贻贝(Mytilusgalloprovincialis)毒素含量,检测到浓度较高的新代谢物M2、M8和M10,微量的M4和M6,且在塔玛亚历山大藻ATHK藻株喂养的贻贝中检测到了新型代谢产物M1、M2、M3、M7、M8和M9,这些产物大多毒性较低,其是否存在未发现的新型M类毒素结构还有待研究。
根据化学结构(分子量和产物离子谱)可以对各种新型代谢产物的形成进行推测,Ding等[26]研究表明M1和M3可能是由C2转化而来(如图3所示),而M7和M9可能是由C3/4转换而来。此外,代谢物M2、M4和M6可能是GTX2/3的产物,而代谢物M8和M10可能来自GTX1/4;为了更具体地研究N-磺酰基氨甲酰基类毒素的代谢转化,采用仅产生C1/2和GTX5(暴露于更简单的PSTs谱)的塔玛亚历山大菌TIO108喂养未污染的贻贝,由于C1/2毒素的代谢,贻贝中产生了M1和M3。Che等[32]进一步证实了化学转化途径M1→M3→M5,并确定了两个新的转化途径:M2→M4→M6和NEO→M10。
2.3 氧化应激和体内代谢
PSTs与其他主要海洋污染物(重金属、多环芳烃、多氯联苯和DDT)一样,在进入贝类或鱼类等生物体后,会增加细胞内自由基水平,特别是增加活性氧(ROS)水平,当ROS的产生超过抗氧化防御时,将诱导严重的氧化应激,可能导致生物分子如DNA、蛋白质、脂类和其他物质的氧化损伤,同时,PSTs还会导致双壳类动物发生各种生化和细胞变化,包括抗氧化反应、免疫防御和解毒过程,但生物体可通过调节自身的抗氧化酶(SOD、CAT、GSH-Px、GSH-Rd)活力变化以减少危害[33-35]。

图3 由C2转化为M1和M3的生物转化示意图Figure 3 Determined biotransformation pathway of metabolites M1 and M3 from C2
邱江兵[36]通过模拟虾夷扇贝和紫贻贝滤食塔玛亚历山大藻(Alexandriumtamarense,ATHK)发现,在PSTs的积累和净化时期,活性氧ROS迅速生成并消失在扇贝和贻贝组织中,两种不同的双壳类中的活性氧ROS发生了不同的抗氧化酶反应。扇贝组织中,SOD活性明显受到抑制,而有毒藻对CAT活性没有刺激作用;贻贝组织中,SOD和CAT活性均被诱导,能有效清除超氧阴离子自由基和H2O2,体现了喂养产毒藻A.tamarense的扇贝和贻贝的抗氧化酶的物种特异性反应。Melegari等[37]将Neu-ro-2A细胞和绿藻Chlamydomonasreinhardtii暴露于STX,通过定量丙二醛水平作为脂质过氧化的生物标志物,发现STX可以诱导脊椎动物细胞系的严重氧化应激。
牡蛎(Crassostreagigas)对A.minutum的生理反应非常复杂,涉及多种代谢系统,包括基于谷胱甘肽和铁的代谢系统,以及其他解毒和/或抗氧化系统,并且指出负责呼吸和过滤的鳃作为双壳类贝类与海水接触的第一个器官,可能对A.minutum产生的细胞外毒素反应强烈而产生基于谷胱甘肽的解毒途径。与喂养无毒藻的牡蛎相比,太平洋牡蛎(Crassostreagigas)鳃中编码抗氧化/解毒酶的7个基因的mRNA[如σ-谷胱甘肽S-转移酶(GST),谷胱甘肽还原酶(GR)和铁蛋白(Fer)]的转录水平显著提高。 GST、GR和Fer还可以促进抗氧化功能,以防止增加的ROS对细胞的损害,这些活性氧或直接来自A.minutum细胞,或来自免疫应答期间的牡蛎血细胞,或来自作为解毒副产物的其他鳃细胞[7]。Costa等[38]研究表明,裸甲藻G.Catenatum细胞被转移至其他器官前保留在鳃中,由此产生一系列的消除和生物转化途径。Xie等[39]通过15N同位素替换A.minutum培养基中的14N,以15N标记PSTs以期将15N-PSTs作为生物标志物示踪PSTs在贝类体内的代谢。目前,PSTs在双壳贝类体内的代谢机制仍不明确,其在双壳贝类体内代谢的差异代谢物的筛选对其代谢机制的明确具有重要意义。
3 PSTs的消减及净化
不同贝类对PSTs的积累能力存在较大差异,贝类毒素排出的速率因物种差异和季节不同而存在明显差异[40]。与扇贝相比,牡蛎和贻贝表现出较快的解毒速度。Takata等[41]发现牡蛎在流动海水中存活48 h内排出62%的麻痹性贝类毒素。扇贝由于代谢率低,对PSTs的敏感性低导致其在组织中积聚毒素的程度更大,且在有毒藻华停止后,扇贝中的毒性滞留仍可持续数月之久[42]。Braga等[43]发现海水变暖和酸化会触发贝类产生不同的适应机制,适应升温的贻贝显示较低的积累/消除率,而适应酸化的贻贝显示更高的积累毒素能力,但清除率更高。
贝类中PSTs的净化方式可归结为化学法、生物学法和物理法[44]。根据化学法规对PSTs的氯水降解是欧洲委员会批准的一种净化受污染产品的方法,但该方法存在氯残留或副产品等问题[45-46]。生物学方法是利用微生物代谢[47-48]或酶[49-50]转化贝类中的PSTs,但该方法存在效率低、成本高等问题。物理净化是通过加热、吸附和临时净化来消减PSTs的方法。暂养净化期间,PSTs的排泄率受贝类品种[49]影响。食用无毒藻类可加速毒素排出[51]。由于加热会改变贝类材料的性能,生物吸附法已成为去除PSTs[52]的研究热点。
壳聚糖[5]、壳聚糖覆膜的贝壳粉[53]、黏土[54]、活性炭[55]和海藻多糖[56]等均可用作吸附PSTs的吸附剂。Xie等[5]发现壳聚糖对牡蛎(OstrearivularisGould)净化去除PSTs的效果显著。Qiu等[55]比较了8种不同粒径的活性炭对PSTs的吸附效果,发现活性炭能有效加速麻痹性贝毒的脱除。Li等[54]发现改性黏土的应用可以有效防止滤食性双壳类摄入有毒藻类,并通过沉积物来减少毒素的积累,且沉积物中积累的毒素比扇贝组织中的毒素更快解毒。Romero等[57]制备了一种磁性共价有机骨架(COF),将该复合材料应用于海水中海洋生物毒素的磁力固相萃取,其效率较高。综上表明,添加生物吸附剂可提高PSTs从染毒贝类中的排出速度。不同的吸附剂对PSTs的吸附机理不同,活性炭在吸附时,静电作用与非静电作用共同发挥作用,而海藻多糖的主要吸附机制是静电作用。
4 结论
近年来发现的新型低毒M类毒素被认为是贝类解毒过程的代谢中间体或终产物[34],以此为贝类体内PSTs代谢的靶标,为研究PSTs在贝类体内的代谢组学奠定了基础。目前暂无PSTs毒素特效解毒剂,基于PSTs在贝类体内生物转化及代谢的理论依据,能否将暂养净化、生物吸附法、微生物代谢等净化方式进行优化或结合,对水产品进行高效脱毒仍需进一步研究。此外,PSTs在贝类体内蓄积、转化及代谢机制的明确有助于科学地监测PSTs的危害,为保障食品安全及保护水产品养殖加工产业的健康发展提供科学支撑。
