基于可编程逻辑控制器的超声阵列辅助酶解控制系统设计与试验
2021-04-07丁艳华马海乐曲文娟
丁艳华 马海乐 曲文娟 肖 凤
(1. 江苏大学机械工程学院,江苏 镇江 212013;2. 江苏大学食品与生物工程学院,江苏 镇江 212013)
近年来,国内外研究学者[1-4]将超声技术应用于生物酶解,通过超声空化效应增强酶解底物与酶的接触,使酶解效果得到了明显改善。超声作用时采用的频率模式和作用时间是影响其效果的重要参数。已有学者[5-7]指出,当给定超声频率接近反应系统的共振频率时,输出的化学产额接近最大,因此采用多频模式更容易找到与处理系统匹配的谐振频率,产生较好的超声处理效果。然而,目前有关超声辅助酶解的报道[8-9]中使用最多的是单频和双频,三频及以上的复合频率使用较少,因此,超声在酶解中的应用受到限制。
另外,目前大多超声辅助酶解系统多为手动操作,酶解产物的理化特性、生物活性等指标需要离线测定化学值进行判断,需要多次采样测定,耗时、耗力,而且酶解终点无法及时判断,易造成酶解不足或过度酶解。基于以上问题,试验拟设计S型五频超声阵列的多频多模式频率控制,并将近红外光谱原位实时监测与可编程逻辑控制器(Programmable logic controller,PLC)控制技术相结合,以期实现酶解终点的自动控制。
1 系统结构及方案设计
1.1 整体结构
以PLC为主控制器的S型五频超声阵列辅助酶解系统的结构如图1所示。
系统的工作过程:将需要酶解的料液置于酶解槽内,选择超声模式,再加入反应酶并启动超声设备开始酶解。酶解过程中将光谱数据发送到上位机,利用Matlab软件建立预测模型,将模型计算得到的血管紧张素转换酶(Angiotensin I-converting enzyme,ACE)抑制率预测值进行迭代计算,若达到目标值,利用PC ACCESS改写对应的变量存储器状态,终止酶解,进行后续的灭酶工作。

1. 上位机(计算机) 2. PLC 3. 触摸屏 4. 近红外光谱仪 5. 20 kHz超声电源 6. 28 kHz超声电源 7. 35 kHz超声电源 8. 40 kHz超声电源 9. 50 kHz超声电源 10. 20 kHz超声反应腔 11. 28 kHz超声反应腔 12. 35 kHz超声反应腔 13. 40 kHz超声反应腔 14. 50 kHz超声反应腔 15. 橡胶管 16. 烧杯 17. 水浴锅 18. 蠕动泵图1 S型五频超声阵列辅助酶解系统结构图Figure 1 Structure of S-type five-frequency ultrasound-array-assisted enzymatic hydrolysis system
1.2 硬件配置
1.2.1 控制器配置 系统的主控制器采用西门子公司生产的S7-200 PLC。该款控制器性能稳定,抗干扰能力强,编程方便、指令丰富、可实现多种先进控制算法[10-11],主要包括CPU、存储器、输入输出接口、电源和通信模块。PLC配置如表1所列。
1.2.2 人机交互装置 人机界面采用西门子Smart 700触摸屏。模块采用高端的ARM处理器,数据处理速度快,画面切换流畅。与上位机通过PC/PPI连接进行通信,组态好、项目传送完毕后通过RS485端口连接到S7-200 PLC编程口建立二者通信。

表1 S7-200 PLC配置
1.2.3 S型五频超声阵列 S型五频超声阵列共有20,28,35,40,50 kHz 5种频率。频率可设定为单频、双频和三频。设计的频率组合如表2所示。组合频率(双频和三频)可为同步或顺序两种工作模式。同步模式为2种或3种频率超声同时工作,顺序模式为2种或3种频率超声依次按照顺序工作。

表2 五频超声阵列频率模式†
超声结构为腔式,超声换能器直接作用于反应腔。将开始酶解的料液通过蠕动泵送入超声腔,从超声腔的下管进上管出,自下而上的循环使超声处理更均匀。使用多种频率组合时,将不同超声反应腔上的物料管依次串联相接,类似S型。每台超声波发生器均设有远程控制端口,因此PLC可对发生器电源内部嵌入式芯片发送高、低电平,由此决定超声波换能器是否发出超声波。
1.2.4 近红外光谱采集 近红外光谱所反应的主要是含氢基团的信息,因此在分子的结构识别尤其是蛋白质结构的定性及定量分析中具有较强的技术优势[12-13]。选用美国海洋光学(上海)有限公司的NIRQUEST型近红外光谱仪,采用对近红外光灵敏度比较高的InGaAs检测器,波长范围900~2 500 nm,如图2所示。
1.3 超声阵列控制系统设计
1.3.1 超声工作模式控制流程 根据表2所列的超声阵列频率模式,设计PLC控制系统。地址分配表见表3。顺序流程图见图3。系统通电后,首先上电初始化。再通过触摸屏中模式选择变量指定一种频率模式,进入选择性分支。第一分支为单频模式,选定一种频率,设置超声时间和间歇时间(单位为s),间歇时间是超声工作和停止的比例,最后启动超声。第二和第三分支对应双频和三频模式。双频和三频的顺序模式下需要设置不同频率工作的具体时间,称为交替时间。

1. 恒温水浴锅 2. 电动搅拌器 3. 水浴烧杯 4. 光纤 5. 铁架 6. 光源 7. 近红外光谱仪图2 近红外光谱采集装置Figure 2 Near-infrared spectroscopy acquisition device

表3 PLC的变量地址分配

图3 超声阵列模式控制流程图Figure 3 Flow chart of ultrasound-array mode control
1.3.2 人机界面设计 根据超声模式控制流程设计终端控制人机界面。触摸屏组态软件为Wincc flexible。该设计共组态了4个画面,分别为模式选择主界面、单频、双频和三频模式。其中主界面如图4所示。
1.4 酶解过程光谱采集
将采集的光谱建立数学模型对化学值进行预测,建模时首先要建立校正模型和预测模型。酶解样品中共采集90个光谱,采集光谱的同时采样,离线测定化学值。
图4 触摸屏主界面Figure 4 Home interface of touch screen
采用化学计量学方法,在数学与建模专业软件Matlab中完成近红外光谱原位监测。
2 酶解试验验证
2.1 材料、试剂与仪器
大米蛋白:总蛋白含量79%,西安金硕果业有限公司;
碱性蛋白酶(Alcalase 2.4 LFG):酶活2×105U/mL,诺维信(南京)生物技术有限公司;
血管紧张素转换酶(ACE):实验室自制;
马尿酰组氨酰亮氨酸(Hippury1-His-Leu,HHL):美国Sigma公司;
可编程控制器:S7-200型,上海控鸿自动化设备有限公司;
超声阵列:S型,课题组自主研制;
电动搅拌器:JJ-1型,江苏金坛市中大仪器厂;
离心机:LD5-2A型,北京医用离心机厂;
近红外光谱仪:NIRQUEST型,美国海洋光学(上海)有限公司。
2.2 试验方法
2.2.1 酶解方法 据课题组已有研究成果,低频超声相对高频对大米蛋白辅助酶解处理效果更好[14],因此选择单频28 kHz连续模式;顺序双频20 kHz/28 kHz,2种频率的超声时间各6 s和顺序三频20 kHz/28 kHz/35 kHz,3种频率的超声时间各4 s。
用烧杯配置浓度为40 g/L的大米蛋白悬浮液(溶解介质为3 mmol/L的稀碱溶液)1 500 mL。将大米蛋白悬浮液在50 ℃的水浴中搅拌平衡10 min,用1 mol/L的NaOH将pH值调节到8.5,立即加入碱性蛋白酶,加酶量2.4 mL/L。开始酶解后将悬浮液通过蠕动泵在超声腔中循环。每个超声波发生器的额定功率为300 W,酶解时长为90 min,酶解过程中每间隔3 min采集一次样品,3种模式共采集样品90个。将采集的样品离心后取上清液,冷藏备用。
2.2.2 光谱采集方法 将光谱仪插入式光纤探头置于酶解料液,在Ocean View软件中设置采集条件:波长范围为800~2 500 nm,背景为蒸馏水,透射方式,光程为4 mm,扫描次数为10次,分辨率选定6.4 nm,共有256个变量。每个样本连续采集3次光谱,取其平均值作为该样本的原始光谱。酶解过程中每3 min采集一次光谱,与实时取样一致。背景光谱的采集条件除了将酶解料液换成蒸馏水外,其他与酶解时条件一致。光谱数据以文本格式发送至上位机。
2.2.3 ACE抑制率测定 将酶解过程中采集的90个样品按照吴琼英等[15]的方法测定ACE抑制活性。取10 μL 酶解液的上清液溶于25 μL的ACE溶液,37 ℃下预热10 min,加入HHL溶液后反应30 min,之后立即加入1 mol/L 的HCl溶液终止反应。反应溶液利用高效液相色谱仪分析并测定马尿酸的生成量。用双蒸馏水代替酶解产物作为空白样。ACE抑制率的计算公式为:
(1)
式中:
IACE——血管紧张素转换酶抑制率,%;
A1——空白样对照中马尿酸的面积,mAU·s;
A2——加入大米蛋白酶解产物样品的马尿酸的峰面积,mAU·s。
2.2.4 模型建立与终点控制 将采集的90个光谱进行多元散射校正预处理,以消除散射影响。再将光谱集分为校正集(75个)和预测集(15个),采用联合区间最小二乘法结合实际测得的ACE抑制率建立校正模型和预测模型,方法参照文献[16]。对采集到的光谱进行预处理后筛选区间,建立校正模型。再对需要预测的样品酶解,过程中采集光谱并进行平滑处理,然后利用已经建立的校正模型(预测模型)进行预测。酶解过程的原位实时监测流程如图5所示。
将得到的ACE抑制率预测值在Matlab中进行迭代运算。终点控制以两个参数为指标,一个为n个ACE抑制率预测值的平均值,另一个为相邻两个ACE抑制率预测值平均值的差,计算公式如式(2)和式(3)所示。
(2)
(3)
式中:
xi——第i次预测值;

em——相邻两次预测值的平均值之差。

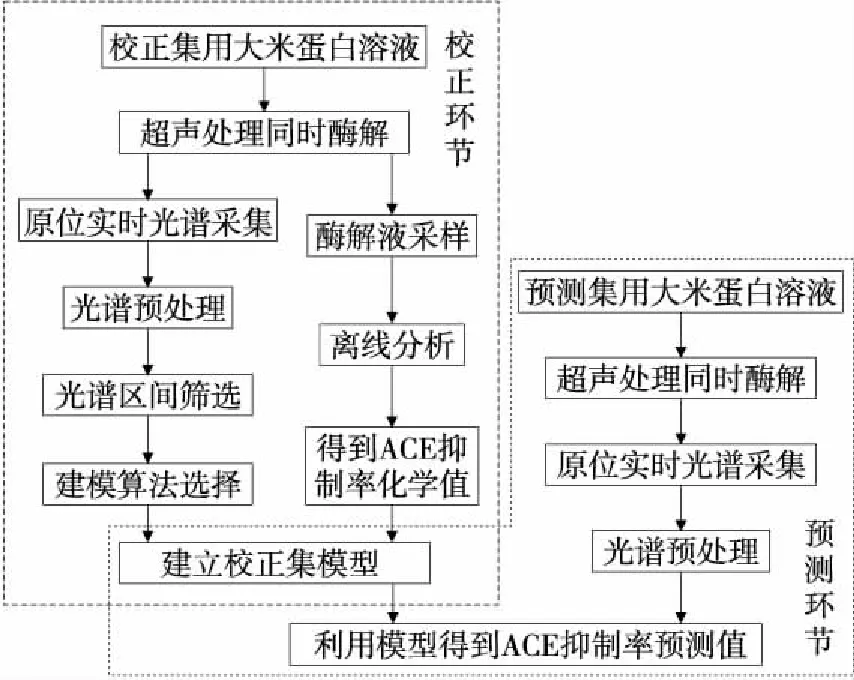
图5 酶解过程的原位实时监测流程Figure 5 Flow of In-situ real-time monitoring inenzymatic hydrolysis process

图6 终点判断流程Figure 6 End-point determination process
2.3 结果与分析
将建立的模型应用于酶解过程,对实时采集的光谱预测化学值。图7为单频、双频和三频模式下在酶解终点时得到的ACE抑制率预测值和实测值对比图。超声辅助酶解控制系统在28 kHz单频时酶解时长为78 min,终点时的ACE抑制率预测值为65%,实测值为63.67%,27组数据之间的相关系数R2值0.842 6。顺序双频20 kHz/28 kHz模式下得到酶解时长为72 min,终点时的ACE抑制率为68.70%,预测值为60%,25组数据之间的相关系数R2值为0.889 6。顺序三频20 kHz/28 kHz/35 kHz模式下得到酶解时长为105 min,终点时的ACE抑制率为65.72%,预测值为61%,36组数据之间的相关系数R2值为0.901 6。可以看出,3种模式下的预测值和实测值相关性均较高,预测效果良好。以ACE抑制率为指标,发现3种频率模式中顺序双频20 kHz/28 kHz 的酶解效果最好,时间最短,抑制率最高。

图7 ACE抑制率的预测值与实测值Figure 7 Predictive value and measured value of ACE inhibitory rate
3 结论
试验以可编程逻辑控制器为核心,对超声阵列辅助酶解过程进行设计和优化,通过人机交互终端操作,完成了超声的多模式快速选择与切换。同时,将化学计量学方法—近红外光谱原位监测、Matlab数学运算与通信和可编程逻辑控制技术结合,完成了大米蛋白超声辅助酶解过程中以血管紧张素转换酶抑制率为指标的终点控制,改善了传统酶解需要离线测定化学值、效果不可预知的状况。该系统为超声辅助酶解过程提供了多种模式,后期考虑将该系统应用于不同蛋白酶在植物蛋白酶解过程中的柔性切换的控制,以达到更好的酶解效果。
