银甘汤对转化生长因子-β1重组腺病毒载体诱导肺纤维化小鼠的干预作用及机制研究
2021-04-07夏瑶丹曹芳杨浩婕李国栋顾潇枫刘浩歌庞庆禄焦扬
夏瑶丹 曹芳 杨浩婕 李国栋 顾潇枫 刘浩歌 庞庆禄 焦扬
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种原因不明的,病情呈进行性加重的间质性肺疾病,主要临床表现为渐进性、不可逆的呼吸困难,死亡率高,目前西医尚未有理想有效的药物。转化生长因子β1(transforming growth factor-β1,TGF-β1)是目前研究发现的最主要的致纤维化因子,由哺乳动物的巨噬细胞等合成并释放。Patricia J.Sime等[1]首次利用腺病毒载体将TGF-β1转入大鼠体内,成功复制出肺纤维化模型。经过多年临床观察[2-3]及实验研究[4-5],已证实肺痹汤对肺纤维化有显著改善作用。本研究所用银甘汤由金银花和生甘草组成,均是肺痹汤的主要组成部分,方中金银花辛凉解表,清热解毒,现代药理研究证实有抗炎、调节免疫作用[6];生甘草清热解毒,祛痰止咳,调和诸药,现代药理研究证实有抗炎、抗纤维化、调节免疫作用[7-8]。本实验在前期研究基础上,以TGF-β1重组腺病毒载体诱导肺纤维化小鼠模型为研究对象,观察银甘汤对小鼠肺纤维化的影响,探讨其作用机制,为临床治疗提供理论依据。
1 材料与方法
1.1 实验动物
SPF级C57BL/6雄性小鼠40只,7~8周龄,体重(22±2)g,购自斯贝福(北京)生物技术有限公司,动物生产许可证编号:SCXK(京)2016-0002,所有小鼠饲养于北京中医药大学科研中心动物室,环境温度20~25℃,相对湿度60%~70%,12小时/12小时明暗周期照射,自由饮水与进食。适应性喂养一周后使用。
1.2 试剂与仪器
1.2.1 主要试剂 银甘汤制备:银甘汤颗粒剂按照金银花与生甘草3∶1比例制备,每付颗粒40 g,购自北京康仁堂药业有限公司。将颗粒剂用100度开水冲泡后,调整浓度为0.6007 g/mL。质粒小量快速提取试剂盒(离心柱型)(北京艾德莱生物科技有限公司);限制性内切酶类(美国Thermo Fisher Scientific公司);DNA Ligase(北京合生基因科技有限公司);腺病毒包装试剂盒(北京合生基因科技有限公司);EpFectTMTransfection Reagent(北京合生基因科技有限公司);EvaGreen®qPCR 2×Master Mix(北京合生基因有限公司);DMEM高糖培养基(美国Gibco公司);RPMI 1640培养基(美国Gibco公司);胎牛血清(美国Gibco公司)。Trizol(Invitrogen;批号:10296028);DEPC水(MDL;批号:md911875);超纯琼脂糖(ABI-invitrogen;批号:16500100);反转录试剂盒(ABI-invitrogen;批号:11752050);SYBR qPCR mix(ABI-invitrogen;批号:4472920);改良Masson三色染色试剂盒(北京索莱宝科技有限公司;批号:20180906);Mouse TGF-β1 ELISA kit(达科为生物技术有限公司;批号:I217102);Mouse BRP-39 ELISA kit(武汉华美生物工程有限公司;批号:I11034872);Mouse IL-17 ELISA kit(武汉华美生物工程有限公司;批号:G19034871);Mouse IL-13 ELISA kit(武汉华美生物工程有限公司;批号:I11034870)。
1.2.2 主要仪器 Sorvall Legend Mircro 17台式离心机(美国Thermo Fisher Scientific公司);Sorvall ST 16R 冷冻离心机(美国Thermo Fisher Scientific公司);超低温冷冻冰箱(美国Thermo Fisher Scientific公司);恒温二氧化碳细胞培养箱(德国Binder公司);RM2135石蜡切片机(德国LEICA公司);1150H石蜡包埋机(德国LEICA公司);Asp-300自动脱水机(德国LEICA公司);NanoDropTMLite分光光度计(美国Thermo Fisher Scientific公司);Applied Biosystems®StepOneTMReal-Time PCR Systems(美国Thermo Fisher Scientific公司);EPS 300电泳仪(美国BIO-RAD公司);2500凝胶成像仪(美国BIO-RAD公司);HWS-24电热恒温水浴槽(上海一恒科学仪器有限公司)。
1.3 TGF-β1重组腺病毒载体构建
根据目的基因序列,分别进行全基因合成,并插入腺病毒表达骨架质粒载体中,完成腺病毒过表达质粒构建。将3~5×106个AD293细胞传代接种至100 mm细胞培养皿中,置于37℃ 5% CO2培养箱中,培养16~24小时,腺病毒包装系统转染、收集、浓缩。最后利用构建完成的基因过表达腺病毒质粒、AD293细胞以及腺病毒包装试剂盒,进行腺病毒包装。
1.4 动物分组与造模
1.4.1 实验动物分组 按照随机数字表将40只小鼠随机分为4组,即空白组、空载体组、模型组、银甘汤组,每组10只。银甘汤组予银甘汤6.007 g/(kg·d)灌胃;空白组、空载体组及模型组予生理盐水10 mL/(kg·d)灌胃。各组于造模次日开始连续灌胃28天,银甘汤组小鼠灌胃剂量与人体折算倍数为9.01。
1.4.2 模型制备 异氟烷∶丙二醇体积比3∶2配置麻醉用药,将1 mL上述麻醉药物滴入自制麻醉装置中,然后将小鼠放入其中,当小鼠呈现深而慢的呼吸状态时,将其上牙齿迅速悬挂于预置悬吊线,用镊子将小鼠舌头拽出,向模型组、银甘汤组小鼠气管内快速滴入50 μL AdTGF-β1(5.0×108PFU),空载体组小鼠气管中滴入50 μL AdEGFP(5.0×108PFU),空白组小鼠气管中滴入等体积的PBS,呛入气管后直立旋转小鼠数秒,放回鼠笼,待自然苏醒。造模当天记为0天。
1.5 样本采集
干预第28天结束后,异氟烷麻醉,摘眼球取血,静置2小时,4℃ 3000 rpm离心15分钟,收集血清,-20℃保存,用于ELISA检测。取血之后处死,剪取左肺浸泡于4%多聚甲醛,用于病理形态学检测;右肺放入液氮中速冻,转移至-80℃用于RT-qPCR检测。
1.6 肺组织形态学检测
取4%多聚甲醛固定的左肺组织常规脱水、石蜡包埋及切片,行HE染色、Masson染色。显微镜下观察分析各组小鼠纤维化程度。
1.7 RT-qPCR检测肺组织TGF-β1、BRP-39、IL-17基因表达水平
提取小鼠肺组织RNA,测定总RNA含量,电泳检测RNA完整性。反转录按照以下体系建立反应体系(RNA均取200 ng,补水到10 μL):RNA 200 ng(10 μL),Oligo-dT 1 μL,Random 1 μL。上述反应体系混匀,65℃保温5分钟,结束后置于冰上。在上述反应体系中加入下列反应液:dNTP(10 μM)1 μL,0.1M DTT 1 μL,5×Buffer 4μL,RT酶 1 μL,混匀后置于42℃水浴60分钟,取出后置于85℃反应10分钟,灭活逆转录酶。反应结束后置于-20℃待用。每个样本分别用待检测基因和内参基因引扩增,每个反应做3个重复,按照以下体系建立扩增体系(20 μL):cDNA 2 μL,PCR mix 10 μL,primer F 1 μL,primer R 1 μL,dd H2O 6 μL,于荧光定量PCR仪上,按照以下条件反应:预变性95℃ 5分钟1个循环;变性95℃10秒,退火58℃ 20秒,延伸72℃ 20秒,三者共40循环;熔解曲线 95℃ 15秒,60℃ 60秒,95℃ 15秒,1个循环。基因引物序列见表1。每个样本检测3次,读取Ct值,采用以下公式进行计算相对表达量(RQ)∶RQ=2-(Ctq-Ctab)(Ctq=待测组目的基因平均Ct值-待测组内参基因平均Ct值;Ctab=对照组目的基因平均Ct值-对照组内参基因平均Ct值)。

表1 引物信息
1.8 ELISA检测血清TGF-β1含量及BRP-39、IL-17、IL-13表达情况
按试剂盒说明书进行实验;根据标准品浓度,应用Excel软件绘制标准曲线,R2>0.999为拟合较好,根据曲线的公式计算待测样品浓度。
1.9 统计学处理
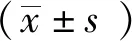
2 结果
2.1 HE染色
空白组和空载体组小鼠肺组织结构正常,肺泡壁完整,未见明显肺泡融合,未见炎症细胞浸润。模型组小鼠肺组织可见肺泡间隔增宽,肺泡塌陷甚至闭合,大部分肺组织可见实变,间质散在较多炎症细胞。银甘汤组实变区占比减少,肺泡结构得到改善,炎症细胞明显减少。见图1。

注:A.空白组;B.空载体组;C.模型组;D.银甘汤组;标尺=100 μm。
2.2 Masson染色
空白组和空载体组小鼠肺组织除在气道和血管周围外,仅见少量蓝色胶原纤维增生,肺泡间隔未增宽。模型组小鼠肺组织片状实变区及增厚的肺泡间隔均可见大量的蓝色胶原纤维沉积。银甘汤组小鼠肺组织胶原纤维增生程度较模型组减轻。见图2。
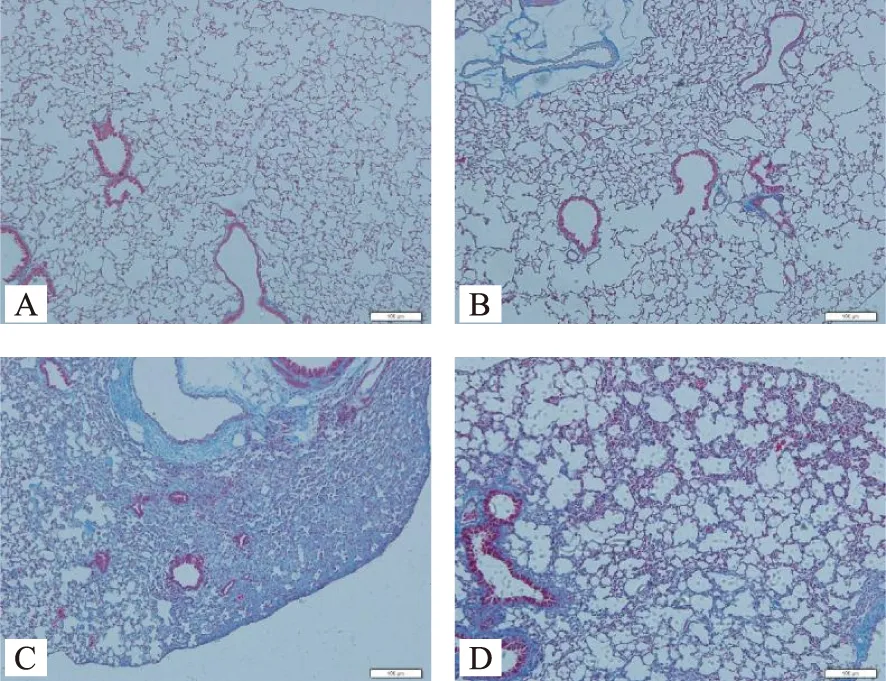
注:A 空白组、B 空载体组、C 模型组、D 银甘汤组;标尺=100 μm。
2.3 各组小鼠肺组织和血清TGF-β1含量情况
采用RT-qPCR检测各组小鼠肺组织中TGF-β1 mRNA水平,空载体组与空白组比较,指标无统计学意义(P>0.05);模型组TGF-β1 mRNA水平显著高于空白组及空载体组,差异具有统计学意义(P<0.01);与模型组比较,银甘汤组TGF-β1 mRNA水平显著降低(P<0.01)。见表2。
采用ELISA法检测各组小鼠血清中TGF-β1含量,空载体组与空白组比较,指标无统计学意义(P>0.05);模型组TGF-β1 含量显著高于空白组及空载体组,差异具有统计学意义(P<0.01);与模型组比较,银甘汤组TGF-β1含量显著降低(P<0.01)。见表2。
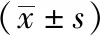
表2 各组TGF-β1重组腺病毒载体诱导肺纤维化小鼠TGF-β1含量情况
2.4 各组小鼠肺组织BRP-39、IL-17 mRNA表达情况
模型组BRP-39 mRNA、IL-17 mRNA水平明显高于其他组,与空白组和空载体组比较,BRP-39 mRNA水平无统计学差异(P>0.05),IL-17 mRNA水平有统计学差异(P<0.01)。银甘汤组两者水平较模型组有不同程度的下降,其中,IL-17 mRNA水平的差异具有统计学意义(P<0.01),而BRP-39 mRNA水平无明显统计学意义,但具有下调趋势。见表3。
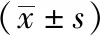
表3 各组TGF-β1重组腺病毒载体诱导肺纤维化小鼠肺组织BRP-39、IL-17 mRNA水平
2.5 各组小鼠血清BRP-39、IL-17、IL-13表达水平
模型组小鼠血清中BRP-39、IL-17、IL-13水平均有升高,与空载体组比较,BRP-39、IL-17水平有统计学差异(P<0.05),IL-13水平无统计学差异(P>0.05)。经过银甘汤治疗后,小鼠血清中三种炎症因子的蛋白表达水平均有下调。与模型组比较,银甘汤组BRP-39、IL-17水平下调具有统计学意义(P<0.05),而银甘汤组IL-13水平虽无明显统计学差异(P>0.05),但有下调趋势。见表4。
表4 各组TGF-β1重组腺病毒载体诱导肺纤维化小鼠血清BRP-39、IL-17、IL-13表达水平
3 结论
目前,制备肺纤维化动物模型的诱导方式多用博来霉素,存在制模时间长等局限性[9]。Sime等[1]研究组以腺病毒为载体将TGF-β1基因转入大鼠体内,并使其在肺泡上皮中高表达,成功制备了TGF-β1单基因过表达诱发的大鼠肺纤维化动物模型。随后,李建等[10]的实验也表明以TGF-β1重组腺病毒诱导是一种可靠的肺纤维化动物模型制备方法,腺病毒诱发的肺纤维化的发病急、炎症反应强烈、细胞外基质增生迅速等特点与特发性肺纤维化病理过程相似。再者,以TGF-β1作为目的基因,用重组腺病毒载体进行包装导致的肺纤维化,直接针对TGF-β1信号传导通路,靶点明确。
本研究所用银甘汤由金银花和生甘草按3∶1比例配伍而成,均是肺痹汤的主要组成部分。方中金银花辛凉解表,清热解毒;生甘草清热解毒,祛痰止咳,调和诸药。两药配合,药理研究表明能起到抗炎、抗纤维化、调节免疫的作用。
本次实验从病理形态学结果来看,模型组小鼠炎性细胞浸润、肺泡间隔增厚程度以及胶原纤维增生程度都比空白组和空载体组严重;而且模型组肺组织中TGF-β1 mRNA的表达及血清中TGF-β1含量均比空白组和空载体组高,且具有统计学意义(P<0.01),这两者都提示了本实验肺纤维化小鼠模型制备的成功。
从病理形态学结果看,银甘汤组小鼠炎性细胞浸润、肺泡间隔增厚程度以及胶原纤维增生程度较模型组有所减轻。通过肺组织匀浆RT-qPCR和血清ELISA,发现银甘汤可以降低肺组织中BRP-39 mRNA、IL-17 mRNA表达及血清中BRP-39、IL-17、IL-13表达水平。
此次研究表明,使用TGF-β1重组腺病毒进行气管滴注,能够较好地制备肺纤维化动物模型。TGF-β1可以促进BRP-39、IL-17、IL-13等炎性因子的分泌,而银甘汤可以减轻AdTGF-β1诱导C57BL/6小鼠的炎性反应,从而在一定程度上缓解TGF-β1重组腺病毒诱导的小鼠肺纤维化。本次研究仅针对造模后第28天的结果,对于炎性因子的动态变化缺少观察,今后可在造模后第3、7、14、28天分阶段取材,深入研究AdTGF-β1诱导的小鼠肺纤维化模型,使其更好地应用于肺纤维化研究领域。
