低温电化学合成氨催化剂研究进展
2021-04-06荣杨佳王成雄张秀娟许晓坤赵云昆
荣杨佳,王成雄, 2,张秀娟,许晓坤,赵云昆, 2 *
低温电化学合成氨催化剂研究进展
荣杨佳1,王成雄1, 2,张秀娟1,许晓坤1,赵云昆1, 2 *
(1. 昆明贵金属研究所 稀贵金属综合利用国家重点实验室,昆明 650106;2. 昆明贵研催化剂有限责任公司 贵金属催化技术与应用国家地方联合工程实验室,昆明 650106)
传统的高温高压Haber-Bosch法合成氨工艺消耗大量化石能源,并排放大量的温室气体。在常温常压下通过电化学方法将氮还原成氨是一种潜在策略。电化学固氮领域的主要研究方向之一是通过开发有效的氮还原催化剂来提高电流效率和氨产率。基于对50多篇文献的分析,本文综述了近20年来电化学合成氨催化剂的研究进展,通过对低温下电化学合成氨的金属基和非金属基不同催化剂以及催化效率进行总结和比较,关注具有高法拉第效率和高氨产率的几种金基催化剂,以及电解质性质、掺杂改性对于开发高效的过渡金属基、非金属基催化剂的重要性,对比分析了这3类催化剂的优缺点以及发展潜力。
合成氨;电化学;低温;催化剂
合成氨一直是化学工业的支柱,并且是人类历史上的重要里程碑。催化合成氨技术在20世纪化学工业的发展中起着核心作用,并在维持世界人口增长中发挥了关键作用[1]。如果没有氨合成催化剂,就不会有目前的氨工业,三分之一到一半的人将会饿死,氨的工业化合成可以说是20世纪具有重要现实意义的科学发现[2]。一百年来,我们生活在一个极度依赖于哈伯-博世(Haber-Bosch)工艺合成氨的世界中[3]。由于N2的特殊性和惰性极强的分子结构,传统的Haber-Bosch合成工艺,反应式为N2(g)+3H2(g)→2NH3(g)。该反应需要高温和高压(350℃~550°C和15~35 MPa)并采用铁催化剂来吸附和活化N2,同时会消耗大量的煤、石油和天然气能源来获取原料气,并进行净化处理得到纯N2和H2,目前合成氨的综合能耗约占全球总能耗的1.4%[4]。Haber-Bosch工艺自发现以来已逐步得到改善,主要是发现了一些能够在较低压力和温度下运行的更具耐腐蚀性的催化剂。
面对全球能源和气候挑战,迫切需要开发一种可持续的氨合成技术,以减少对化石燃料的依赖并减轻CO2排放。在过去的三十年中,除了优化催化剂之外,还研究了氨合成的替代途径,包括生物催化、光催化和电催化[5]。光催化N2还原受到可用波长和快速载流子重组的限制,而生物催化N2还原则存在稳定性和循环利用问题。与光催化和生物催化的氨生产路线相比,电化学途径具有可替代性且低能耗。电催化N2还原反应是由电势而不是热力学驱动,具有显着降低输入能量(超过20%)的优势,可以在低温和低压条件下进行,同时,它大大降低了因天然气或煤重整制H2过程的二氧化碳排放[6]。然而,由于N2分子在极性电解质中的溶解度低,即使在具有电极电位驱动力的情况下也难以破坏高惰性的N≡N三键,加之剧烈的竞争性氢析出反应(HER),导致氨的产率和法拉第效率仍然与实际工业水平相差甚远[7]。迄今为止,低的NH3产率,昂贵的电解质等仍然阻碍着电化学固氮技术的发展,在常温常压条件下几乎没有能以高收率产生NH3的有效电催化剂[8]。因此,开发具有足够活性和选择性的高效催化剂对于将N2电还原为NH3来说是具有挑战性的[9]。
1 氮气合成氨反应
1.1 氮气合成氨反应机理
在氨合成中,该过程包括两个主要机理:解离和缔合,如图1所示。
解离过程首先需要破坏氮分子的三键,导致非常高的能量消耗和对催化剂的高性能要求。缔合过程是通过氢化过程在氮分子三键的一个或两个末端破坏氮分子的三键,直到氢化过程中最后一个N-N键被破坏,这可以显着降低能耗并提高催化效率。根据氢化顺序,缔合机理又可分为交替和末端机理。在交替缔合途径中,两个氮原子被连续氢化。在远程缔合路径中,远离第一电极表面的氮原子被氢化并以游离的NH3分子形式释放,剩余的氮原子形成M≡N(M代表催化剂),而后将其氢化以形成第二个游离的NH3分子[10]。
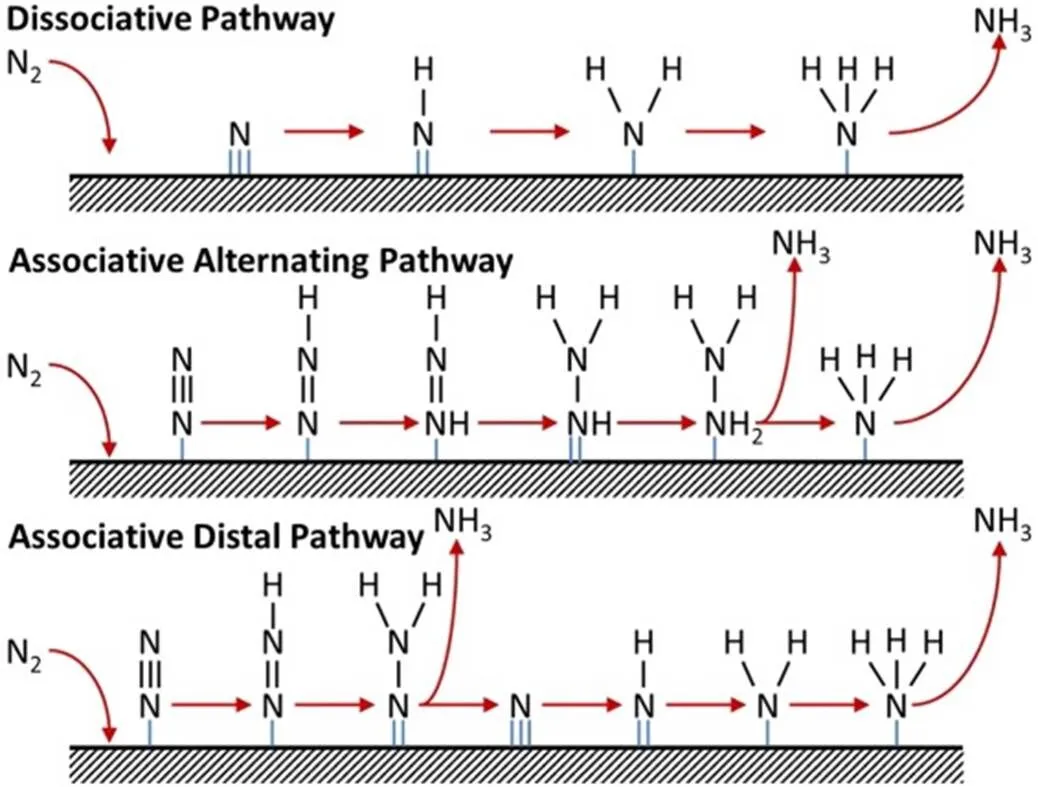
图1 通过解离和缔合途径合成氨的示意图[7]
当前研究表明,先解离N≡N三键的解离机理主要存在于Haber-Bosch的工业过程中,这可能归因于高的热力学能量输入。而电催化倾向于遵循加氢后破坏N-N键的缔合机理:游离的氮分子首先物理吸附在催化剂的活性位点,然后催化剂将接收到的电子注入到氮的最高空通道以吸附和活化氮分子,随后从环境中接收质子以进行氢化反应,吸附的活性中间物种通过不同的氢化方式形成,氮分子的三键断裂后,生成氨分子并从催化剂表面脱附。
1.2 电催化氮气还原反应(ENRR)
电催化N2还原反应(ENRR,见下页图2)的主要氮源是氮气,氢源是水,由电解液、离子交换膜、阴阳两电极和电解槽组成电化学工作站,在电极两端施加一定的电压,并将催化剂装载在阴极上,同时将高纯N2通入阴极室,使N2吸附在催化剂活性位点上,在催化剂的作用下,N2在阴极被外加电流提供的电子还原,与质子生成NH3,水在阳极被氧化生成O2。其中特定的阳极和阴极半反应取决于电解质的性质[11]。

图2 电催化N2还原反应(ENRR)示意图[12]
高温下的电化学反应,不仅需要高能耗下的高温反应条件,还有苛刻的设备要求,且氨气在高温下容易降解和氧化,使得高温下电化学合成氨速率很难提高。因此,与高温相比,低温下电化学合成氨具有明显的优势[13]。N2分子的化学惰性在于其强大的N≡N键能(941 kJ∙mol-1),HOMO和LUMO能级之间的较大能量差(10.82 eV)及其非极性性质,所以在低温条件下,它不容易吸附和活化[12]。采用具有低过电势,高选择性和优异法拉第效率()的电催化剂可以增强这个动力学缓慢的反应[13-14]。在低过电位下实现高NH3产率仍然是一个挑战,目前,低温下电化学合成氨的氨合成速率较低(通常,法拉第效率<10%)。因此,提高电催化氮还原合成氨反应(ENRR)活性是促进该领域发展的关键[15]。电化学氨合成催化剂可分为3类:贵金属催化剂、过渡金属催化剂和非金属催化剂。
2 低温电化学合成氨
2.1 贵金属催化剂
贵金属具有耐高温和抗腐蚀的优点,近年来已成为电催化领域中的热门研究材料。用于氨的低温电化学合成的贵金属催化剂主要由基于Pt、Ir、Pd、Ru、Au组成[16]。通常,将贵金属元素掺杂在电极中或沉积在电极表面上用作电极催化剂。
因为N≡N的结合能非常高,所以控制氨合成的反应速度取决于N≡N的裂解步骤。而贵金属Ru、Pd、Pt等可以促进N≡N键断裂[6, 17]。这些金属可以吸引N≡N成键轨道中的电子,同时,N≡N的反键轨道也可以接受这些元素提供的外部电子,以加快N≡N断裂过程,达到提高氨合成速率的目的。然而,电化学合成氨技术仍然存在挑战性,并且其发展受到催化剂的低选择性和低活性的严重限制。研究表明,贵金属基催化剂通常面临“选择性-活性”的两难困境:具有较高理论活性的催化剂通常伴随强烈的析氢副反应(HER)和较低的反应选择性。而理论选择性较高的催化剂对氮的吸附过强,从而使产物难以脱附,减少了反应的活性位点[17-18]。因此,如何兼顾两者的优缺点,寻找一种既能促进N≡N键断裂,又能抑制氢生成反应的催化剂,已成为贵金属催化领域研究的热点。
表1(见下页)列出了近年来在低温(<100℃)下电化学合成氨的研究进展。由表1可知,法拉第效率高的催化剂其氨产率非常低,而具有较高反应速率(NH3)的则具有较低的法拉第效率。Li等[29]报道了最高的反应速率(2.7×10−8mol∙s−1∙cm−2),Wang等[25]报道了最高的氨产率(1305 μg h-1mg-1cat),Xue等[24]报道了最高的(67.8%)。Li等[29]制备的非晶/低结晶金纳米颗粒,并将其对NH3合成的反应性与结晶对应物的反应性进行了比较:非晶态具有更大的结构畸变,并具有较高浓度的电催化N2还原反应(ENRR)活性位,将非晶Au/CeO纳米颗粒锚固在还原型氧化石墨(RGO)上形成阴极电催化剂。研究发现,当使用非晶而不是结晶颗粒时,氨收率和法拉第效率均显著提高,所获得的具有高性能和低负载贵金属的无定形催化剂,可以与苛刻的温度或压力下的产量和效率相媲美。实际上,在表1的研究中,几乎所有>10%的研究,其反应速率都低于10-10mols-1·cm-2,特别的,Li等人[29]的研究中为10.1%时,其反应速率接近2.7×10-8mol s-1cm-2。Xue等[24]开发了一种简单的电流置换法来沉积与Ni纳米粒子相邻的Au纳米粒子,构造出Ni和Au纳米粒子的无机供体-受体对,高度偶联的Au和Ni纳米颗粒对于ENRR的重复使用和长期性能稳定具有重要作用,从而使电化学过程在实际应用中更具可持续性,其研究结果如图3所示。根据图3结果,Au6/Ni催化剂可提供很高的法拉第效率(> 67.8%),远胜过所有报道的基于Au、Ru或Pd的电催化剂的法拉第效率值,极大地提高了氮还原反应的选择性。这项工作使用金属-金属电子转移实现了电化学固氮的高选择性,为实际应用的新型反应器提供了电催化剂的制备指南,同时提供了一种直接而有趣的方法来开发高效催化剂以应对小分子活化的挑战。
表1 低温下(<100℃)贵金属催化合成氨的实验研究

Tab.1 Experimental research on the synthesis of ammonia catalyzed by noble metals at low temperature (t<100℃)
Wang等[25]在氮化碳上制备了原子分散的金(Au1/C3N4),得益于有效的原子利用和高的法拉第效率,已达到1305 μg h-1mg-1cat的NH4+产率,约为负载型Au纳米颗粒(Au NPs/C3N4)的22.5倍。密度泛函理论(DFT)计算结果表明,在Au1/C3N4和Au NPs/C3N4上都进行了交替氢化机理,而第一步氢化所需的较低能量解释了Au1/C3N4上形成NH4+具有更高法拉第效率的原因。此外,已经在能量利用率为4.02 mmol kJ-1的两电极电解槽中实现了由N2和H2无副产物的NH3合成过程。虽然Haber-Bosch工艺在很长一段时间内可能会主导工业NH3合成,但这项研究提供了一种更节能的电化学合成氨策略的可能性。
综合反应速率、氨产率和法拉第效率3方面,因Au具有高亲和力和活化N2进行电化学还原的能力及通常较低的氢形成趋势。因此Au是ENRR的最有效催化剂之一,在Au基ENRR催化剂上选择性吸附和活化N2分子属于低温氨合成的研究前沿。但是考虑到生产成本和资源的稀缺,Au基ENRR催化剂未来可以朝着单原子和合金方向发展,以实现最大化的活性原子利用效率和ENRR选择性。

(a). Au和富电子Au的NRR的吉布斯自由能图,插图为相应的优化吸收结构(Gibbs free energy diagram of the NRR for Au and electron-rich Au, the insets show the corresponding optimized absorption structures); (b). 计算得出的吸附在Au和富电子Au(Au + e-)表面的N2的电子密度图(The calculated electron density maps for N2adsorbed onto the surface of Au and electron-rich Au (Au + e−); (c). 计算得出的N2吸附能和NH3吸附到Au和Au + e-上的解吸能(The calculated adsorption energies of N2and desorption energies of NH3adsorbed onto Au and Au + e-; (d). 通过Au含量归一化的Ni,Au6/Ni和Au40/Ni催化剂的N2-TPD结果,插图显示了相应的结构模型(The N2-TPD results of the Ni, Au6/Ni, and Au40/Ni catalysts normalized by the Au content, the insets show the corresponding structural models); (e). 各种贵金属基电催化剂对ENRR的法拉第效率(Faradaic efficiencies for the NRR over various noble-metal-based electro-catalysts)
2.2 过渡金属催化剂
贵金属由于其昂贵的成本和稀缺的储量而被限制大规模的商业化应用。在理论模拟和实验研究中,许多过渡金属催化剂均显示出优异的氮还原性能。另外,它们便宜且其催化活性也易于调节,常用作电极材料[33]。考虑到活化分子的能量因素,化学吸附不能太强也不能太弱,太强的吸附会导致不可逆的吸附,而太弱的吸附不足以活化分子反应[34]。
不同的金属表面对ENRR中间体的亲和力非常不同,基于Marcus理论的动力学模型被用于计算N2电化学加氢步骤的电势依赖性反应的势垒。计算结果表明,速率决定步骤是在Fe(110)和Mo(110)表面上的第五氢化步骤:*NH→*NH2,在Rh(111)和Ru(001)表面上的第一氢化步骤:*N2→*NNH[35]。由速率决定步骤在4个金属电极上的电势依赖性速率常数预测的电催化活性依次降低:Fe(110)> Mo(110)> Ru(001)> Rh(111)[16]。与此同时,铁基催化剂因其低成本和高活性生产NH3而受到了广泛的关注,目前工业上广泛采用的催化剂主要是含多种助剂的熔铁催化剂[14]。本文归纳有关过渡金属催化剂的文献,并从ENRR的效率和反应选择性方面将近年来各大研究工作进行了比较,结果列于表2。
表2 低温下(<100℃)过渡金属催化合成氨的实验研究

Tab.2 Experimental study on synthesis of ammonia catalyzed by transition metals at low temperature (t <100℃)
表2包含了低温下的实验结果。这些研究中使用的质子传导电解质为全氟磺酸基聚合物(Nafion)和磺化聚砜(SPSF),Nafion膜是公认的具有优异机械和化学性能的最佳聚合物质子交换膜。在低温下运行具有两个优点:首先,N2+3H2↔2NH3反应是自发的;其次,Nafion类低温电解质的质子传导率远高于在中高温下运行的电解质的质子传导率。另一方面,在低温下反应动力学相当慢。由表中数据可得,Xu等[44]使用SmFe0.7Cu0.1Ni0.2O3(SFCN)作阴极材料,以Nafion膜为电解质,氨合成温度为25℃~ 100℃,80℃时具有最高的氨产率,氨的最大析出速率为1.13×10-8mol·cm-2·s-1,电流效率高达90.4%。
目前有关ENRR的铁基催化剂的报道主要集中在Fe2O3纳米颗粒。Hu等[18]报道了用于环境电化学合成氨的Fe/Fe3O4催化剂,用其300°C氧化Fe箔,然后进行原位电化学还原制备,如图4所示。对比评估了商业Fe、Fe3O4和α-Fe2O3纳米颗粒在相同条件下的ENRR,发现Fe/Fe3O4的ENRR选择性优于三者,在−0.3 V时产生NH3的法拉第效率达8.29%,为原始Fe箔的120倍左右;最高产率0.19 μg cm-2h-1,约为Fe箔的25倍。这是因为Fe/Fe3O4催化剂有效抑制了HER活性,ENRR活性提高多达9倍而实现高选择性,表明Fe/Fe氧化物复合物是环境电化学合成氨的有效催化剂。
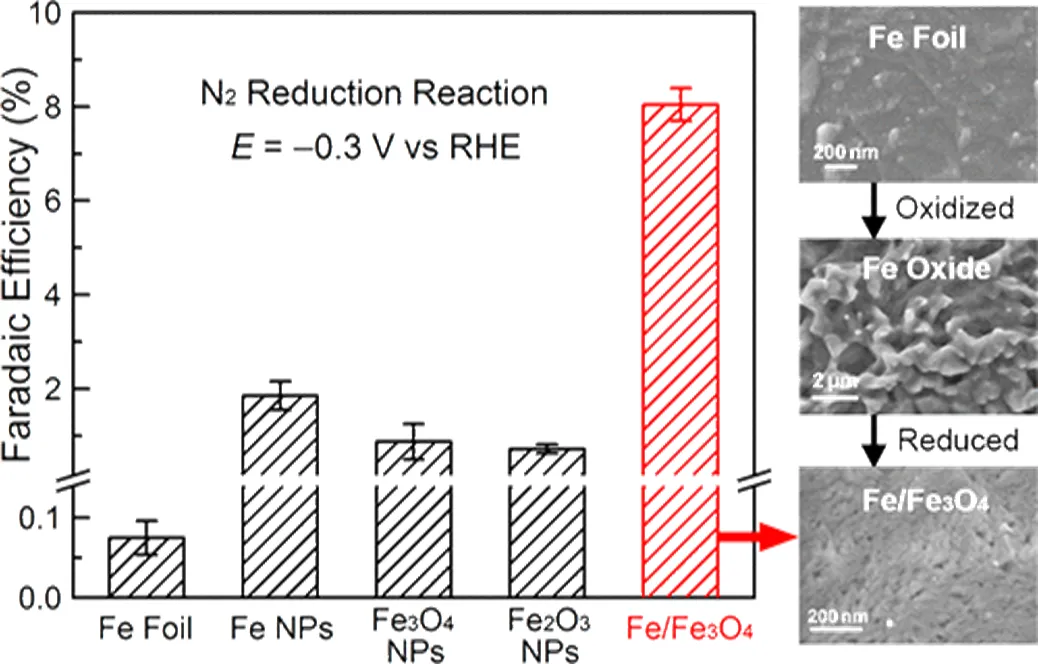
图4 铁基催化剂在−0.3 V下合成氨的法拉第效率[16]
综上,寻求合适的电解质和过渡金属电催化剂仍然是材料和能量研究最活跃的领域之一。电池反应器分为碱性或酸性系统,在酸性介质中,电化学合成氨有个明显的局限性:HER在酸中占主导地位,这表明酸性介质中的电流密度比碱性电解质中高两个数量级。因此为了抑制HER而提高NRR的选择性,可以选择在碱性介质中开发高效的过渡金属基电催化剂。
2.3 非金属催化剂
一方面,金属基催化剂在催化氮还原期间释放金属离子,会造成环境污染;另一方面,多种过渡金属固有的易腐蚀和氧化敏感性极大地限制了它们在酸性质子交换膜基电化学装置中的应用。基于密度泛函理论(DFT)计算的预测,与金属基电催化剂相比,由于非金属元素上的弱氢吸附,许多非金属电催化剂对HER副反应有抑制作用。研究人员已开始转向高性能、环保型非金属催化剂的研究[15]。通过总结各种非金属纳米催化剂的性能,包括有机聚合物,杂原子掺杂的碳基材料,碳三极体,聚合氮化碳,B4C纳米片,硼化合物和黑磷等,并从ENRR的法拉第效率和氨产率方面进行了比较,结果列于表3。
表3 低温下(<100℃)各种非金属催化合成氨的实验研究

Tab.3 Experimental research on the synthesis of ammonia by various non-metals at low temperature ( t <100℃)
从表3可以看出,由于碳基材料的丰富性及其对酸性条件的耐受性,它在特定的催化作用方面具有独特的优势,但纯碳材料在电化学反应中表现为惰性,为了提高反应物和中间体在碳材料上的结合能,通常需要改变表面结构或掺入一些杂原子[51]。掺杂非金属杂原子(如B,S,N,P等)已被证明是调节此类材料的电子特性和电化学性质的可行方法。Mukherjee等[52]为了获得最佳的电催化性能,在1100℃的高碳化温度下获得的催化剂(C-ZIF)在KOH电解液中具有最高的NH3产率(72.25 μg h-1mg-1cat)和较高的法拉第效率(=10.2%)。作为比较,还研究了PANI和N掺杂碳管中的N掺杂碳,但它们的活性比C-ZIF低得多,突出了ZIF衍生碳的重要性,包括形成富含缺陷且稳定氮掺杂的无序无定形碳。此外,Song等[1]报道了一种由N掺杂的碳纳米钉组成的高度织构化的物理催化剂,可在环境条件下以电化学方式还原溶解的N2,从而降低水性电解质的含量,其在−1.19 V时达到11.56 ± 0.85%,最大的氨生产率为97.18 ± 7.13 μg h-1mg-1cat。Liu等人[47]将F原子引入3D多孔碳骨架中,从而开发出了一种高效的无金属催化剂,在−0.2 V下,掺F的碳对NH3的最高为54.8%,是原始碳骨架的3.0倍(18.3%)。值得注意的是,在−0.3 V时,NH3的产率达到197.7 μg h-1mg-1cat。在迄今为止接近环境条件下,NH3产率值比其它非金属的电催化剂高一个数量级,这项工作通过抑制HER过程并提高活性位点的利用,为合理设计新型高效碳基催化剂提供指导。
显然,非金属材料具有很强的活化氮的竞争能力,然而,类似于金属基催化剂,非金属催化剂在氮还原效率和氨生产率方面也面临重大挑战,远低于可接受的应用水平(50%和10-4mol h-1cm-2)。可采取缺陷位调控(如引入C缺陷、N缺陷)和异质原子掺杂的手段,对非金属基电催化剂的电子结构进行优化,促进电荷传递,降低反应能垒,从而提高活性位点的利用率。
3 结语
1) 贵金属在低温下氨的电化学合成中显示出最佳催化活性,若要实现工业应用,仍需要提高其对NRR的特定催化活性,并大幅降低其负载量。
2) 非贵金属基电催化剂不受储量和价格限制,且非贵金属基电催化剂对N原子的结合相对优化,在环境条件下具有作为高效ENRR催化剂的巨大潜力。尽管非贵金属催化剂在低温下用于氨的电化学合成方面取得了巨大进展,但与贵金属催化剂的催化活性相比仍有很大差距。
3) 过渡金属催化剂价格便宜,且催化活性也易于调节;但由于溶剂水直接成为氢源,水性电解质容易发生竞争性析氢反应而限制了传统过渡金属的催化总效率。非金属元素固有的耐腐蚀性,使其在酸性介质中得到广泛应用,以及很强的活化氮能力与低氢选择性,很有希望成为过渡金属催化剂的替代品;但是仍需要通过掺杂改性的手段来优化电子结构,以此开发出具有丰富路易斯酸位点(电子缺陷的C原子)和活性位的非金属基电催化剂。
[1] SONG Y, JOHNSON D, PENG R, et al. A physical catalyst for the electrolysis of nitrogen to ammonia [J]. Science Advances, 2018, 4(4): e1700336.
[2] KYRIAKOU V, GARAGOUNIS I, VASILEIOU E, et al. Progress in the electrochemical synthesis of ammonia [J]. Catalysis Today, 2017, 286: 2-13.
[3] 刘化章. 氨合成催化剂100年:实践、启迪和挑战[J]. 催化学报, 2014, 35(10): 1619-1640.
LIU H Z. 100 years of ammonia synthesis catalyst: Practice, enlightenment and challenge [J]. Chinese Journal of Catalysis, 2014, 35(10): 1619-1640.
[4] KITANO M, INOUE Y, YAMAZAKI Y, et al. Ammonia synthesis using a stable electride as an electron donor and reversible hydrogen store [J]. Nature Chemistry, 2012, 4(11): 934-940.
[5] BROWN D E, EDMONDS T, JOYNER R W, et al. The genesis and development of the commercial BP doubly promoted catalyst for ammonia synthesis [J]. Catalysis Letters, 2014, 144(4): 545-552.
[6] GARAGOUNIS I, VOURROS A, STOUKIDES D, et al. Electrochemical synthesis of ammonia: Recent efforts and future outlook [J]. Membranes, 2019, 9(9): 112.
[7] GIDDEY S, BADWAL S P S, KULKARNI A. Review of electrochemical ammonia production technologies and materials [J]. International Journal of Hydrogen Energy, 2013, 38(34): 14576-14594.
[8] SHIPMAN M A, SYMES M D. Recent progress towards the electrosynthesis of ammonia from sustainable resources [J]. Catalysis Today, 2017, 286: 57-68.
[9] KONG J, LIM A, YOON C, et al. Electrochemical synthesis of NH3at low temperature and atmospheric pressure using a gamma-Fe2O3catalyst [J]. ACS Sustainable Chemistry & Engineering, 2017, 5(11): 10986-10995.
[10] FOSTER S L, BAKOVIC S I P, DUDA R D, et al. Catalysts for nitrogen reduction to ammonia [J]. Nature Catalysis, 2018, 1(7): 490-500.
[11] 熊梓林. 电化学合成氨催化剂的制备与性能研究[D]. 宜昌: 三峡大学, 2021.
XIONG Z L. Preparation and properties of catalysts for electrochemical synthesis of ammonia [D]. Yichang: Three Gorges University, 2021.
[12] ZHANG L, CHEN G F, DING L X, et al. Advanced non-metallic catalysts for electrochemical nitrogen reduction under ambient conditions [J]. Chemistry- A European Journal, 2019, 25(54): 12464-12485
[13] ZHAO R, XIE H, CHANG L, et al. Recent progress in the electrochemical ammonia synthesis under ambient conditions [J]. EnergyChem, 2019, 1(2): 100011.
[14] MATSUMOTO H, HAMAJIMA S, IWAHARA H. Electro-chemical hydrogen pump using a high-temperature-type proton conductor: Improvement of pumping capacity [J]. Solid State Ionics, 2001, 145(1/4): 25-29.
[15] ZHOU J H, ZHANG Y W. Metal-based heterogeneous electrocatalysts for reduction of carbon dioxide and nitrogen: Mechanisms, recent advances and perspective [J]. Reaction Chemistry & Engineering, 2018, 3(5): 591-625.
[16] GUO J P, CHEN P. Recent progress in heterogeneous ammonia synthesis [J]. Chinese Science Bulletin, 2019, 64(11): 1114-1128.
[17] 王鲁丰, 钱鑫, 邓丽芳, 等. 氮气电化学合成氨催化剂研究进展[J]. 化工学报, 2019, 70(8): 2854-2863.
WANG L F, QIAN X, DENG L F, et al. Research progress of nitrogen electrochemical catalyst for ammonia synthesis [J]. Journal of Chemical Engineering, 2019, 70(8): 2854-2863.
[18] HU L, KHANIYA A, WANG J, et al. Ambient electro-chemical ammonia synthesis with high selectivity on Fe/Fe oxide catalyst [J]. ACS Catalysis, 2018, 8(10): 9312-9319.
[19] SKULASON E, BLIGAARD T, GUDMUNDSDOTTIR S, et al. A theoretical evaluation of possible transition metal electro-catalysts for N2reduction [J]. Physical Chemistry Chemical Physics, 2012, 14(3): 1235-1245.
[20] LAN R, TAO S. Electrochemical synthesis of ammonia directly from air and water using a Li+/H+/NH4+mixed conducting electrolyte [J]. RSC Advances, 2013, 3(39): 18016-18021.
[21] KORDALI V, KYRIACOU G, LAMBROU C. Electro-chemical synthesis of ammonia at atmospheric pressure and low temperature in a solid polymer electrolyte cell [J]. Chemical Communications, 2000, (17): 1673-1674.
[22] CAI W, HAN Y, LI H, et al. Significantly enhanced electrocatalytic N2reduction to NH3by surface selenization with multiple functions [J]. Journal of Materials Chemistry A, 2020, 8(39): 20331-20336.
[23] WANG J, YU L, HU L, et al. Ambient ammonia synthesis via palladium-catalyzed electrohydrogenation of dinitrogen at low overpotential [J]. Nature Communications, 2018, 9: 1-7.
[24] XUE Z H, ZHANG S N, LIN Y X, et al. Electrochemical reduction of N2into NH3by donor-acceptor couples of Ni and Au nanoparticles with a 67. 8% faradaic efficiency [J]. Journal of the American Chemical Society, 2019, 141(38): 14976-14980.
[25] WANG X Q, WANG W Y, QIAO M, et al. Atomically dispersed Au-1 catalyst towards efficient electrochemical synthesis of ammonia [J]. Science Bulletin, 2018, 63(19): 1246-1253.
[26] QIN Q, HEIL T, ANTONIETTI M, et al. Single-site gold catalysts on hierarchical N-doped porous noble carbon for enhanced electrochemical reduction of nitrogen [J]. Small Methods, 2018, 2(12): 1800202.
[27] SAHOO S K, HESKE J, ANTONIETTI M, et al. Electro-chemical N2reduction to ammonia using single Au/Fe atoms supported on nitrogen-doped porous carbon [J]. ACS Applied Energy Materials, 2020, 3(10): 10061-10069.
[28] SHI M M, BAO D, WULAN B R, et al. Au sub-nano-clusters on TiO2toward highly efficient and selective electrocatalyst for N2conversion to NH3at ambient conditions [J]. Advanced Materials, 2017, 29(17): 1606550.
[29] LI S J, BAO D, SHI M M, et al. Amorphizing of Au nano-particles by CeO-RGO hybrid support towards highly efficient electrocatalyst for N2reduction under ambient conditions [J]. Advanced Materials, 2017, 29(33): 1700001.
[30] WANG H, WANG L, WANG Q, et al. Ambient electro-synthesis of ammonia: Electrode porosity and composition engineering [J]. Angewandte Chemie-International Edition, 2018, 57(38): 12360-12364.
[31] BAO D, ZHANG Q, MENG F L, et al. Electrochemical reduction of N2under ambient conditions for artificial N2fixation and renewable energy storage using N2/NH3cycle [J]. Advanced Materials, 2017, 29(3): 1604799.
[32] LIU H M, HAN S H, ZHAO Y, et al. Surfactant-free atomically ultrathin rhodium nanosheet nanoassemblies for efficient nitrogen electroreduction [J]. Journal of Materials Chemistry A, 2018, 6(7): 3211-3217.
[33] VOJVODIC A, MEDFORD A J, STUDT F, et al. Exploring the limits: A low-pressure, low-temperature Haber-Bosch process [J]. Chemical Physics Letters, 2014, 598: 108-112.
[34] VOJVODIC A, NORSKOV J K. New design paradigm for heterogeneous catalysts [J]. National Science Review, 2015, 2(2): 140-143.
[35] SHI J-L, XIANG S-Q, ZHANG W, et al. A thermodynamic and kinetic study of the catalytic performance of Fe, Mo, Rh and Ru for the electrochemical nitrogen reduction reaction [J]. Physical Chemistry Chemical Physics, 2020: 25973-25981.
[36] CHEN S M, PERATHONER S, AMPELLI C, et al. Room-temperature electrocatalytic synthesis of NH3from H2O and N2in a gas-liquid-solid three-phase reactor [J]. ACS Sus-tainable Chemistry & Engineering, 2017, 5(8): 7393-7400.
[37] CHEN S M, PERATHONER S, AMPELLI C, et al. Electro-catalytic synthesis of ammonia at room temperature and atmospheric pressure from water and nitrogen on a carbon-nanotube-based electrocatalyst [J]. Angewandte Chemie-International Edition, 2017, 56(10): 2699-2703.
[38] SURYANTO B H R, KANG C S M, WANG D B, et al. Rational electrode-electrolyte design for efficient ammonia electrosynthesis under ambient conditions [J]. ACS Energy Letters, 2018, 3(6): 1219-1224.
[39] ZHAO X R, YIN F X, LIU N, et al. Highly efficient metal-organic-framework catalysts for electrochemical synthesis of ammonia from N2(air) and water at low temperature and ambient pressure [J]. Journal of Materials Science, 2017, 52(17): 10175-10185.
[40] ZHOU F L, AZOFRA L M, ALI M, et al. Electro-synthesis of ammonia from nitrogen at ambient temperature and pressure in ionic liquids [J]. Energy & Environmental Science, 2017, 10(12): 2516-2520.
[41] KIM K, LEE N, YOO C Y, et al. Communication-electro-chemical reduction of nitrogen to ammonia in 2-propanol under ambient temperature and pressure [J]. Journal of the Electrochemical Society, 2016, 163(7): F610-F612.
[42] ZHANG Z, ZHONG Z, LIU R. Cathode catalysis perfor-mance of SmBaCuMO5+δ(M=Fe, Co, Ni) in ammonia synthesis [J]. Journal of Rare Earths, 2010, 28(4): 556-559.
[43] WANG J, LIU R-Q. Property research of SDC and SSC in ammonia synthesis at atmospheric pressure and low temperature [J]. Acta Chimica Sinica, 2008, 66(7): 717-721.
[44] XU G, LIU R, WANG J. Electrochemical synthesis of ammonia using a cell with a nafion membrane and SmFe0.7Cu0.3-xNiO3(=0-0.3) cathode at atmospheric pressure and lower temperature [J]. Science in China Series B - Chemistry, 2009, 52(8): 1171-1175.
[45] SHIPMAN M A, SYMES M D. A re-evaluation of Sn(II) phthalocyanine as a catalyst for the electrosynthesis of ammonia [J]. Electrochimica Acta, 2017, 258: 618-622.
[46] ZHANG L L, DING L X, CHEN G F, et al. Ammonia synthesis under ambient conditions: Selective electro-reduction of dinitrogen to ammonia on black phosphorus nanosheets [J]. Angewandte Chemie-International Edition, 2019, 58(9): 2612-2616.
[47] LIU Y, LI Q, GUO X, et al. A highly efficient metal-free electrocatalyst of F-doped porous carbon toward N2electro-reduction [J]. Advanced Materials, 2020, 32(24): 1907690.
[48] CHEN G F, CAO X R, WU S Q, et al. Ammonia electro-synthesis with high selectivity under ambient conditions via a Li+incorporation strategy [J]. Journal of the American Chemical Society, 2017, 139(29): 9771-9774.
[49] CHENG H, DING L X, CHEN G F, et al. Molybdenum carbide nanodots enable efficient electrocatalytic nitrogen fixation under ambient conditions [J]. Advanced Materials, 2018, 30(46): 1171-1175.
[50] ZHAO J X, YANG J J, JI L, et al. Defect-rich fluoro-graphene nanosheets for artificial N2fixation under ambient conditions [J]. Chemical Communications, 2019, 55(29): 4266-4269.
[51] HUANG H, XIA L, CAO R R, et al. A biomass-derived carbon-based electrocatalyst for efficient N2fixation to NH3under ambient conditions [J]. Chemistry- A European Journal, 2019, 25(8): 1914-1917.
[52] MUKHERJEE S, CULLEN D A, KARAKALOS S, et al. Metal-organic framework derived nitrogen-doped highly disordered carbon for electrochemical ammonia synthesis using N2and H2O in alkaline electrolytes [J]. Nano Energy, 2018, 48: 217-226.
[53] CHEN H Y, ZHU X J, HUANG H, et al. Sulfur dots-graphene nanohybrid: A metal-free electrocatalyst for efficient N2-to-NH3fixation under ambient conditions [J]. Chemical Communications, 2019, 55(21): 3152-3155.
[54] SONG P F, WANG H, KANG L, et al. Electrochemical nitrogen reduction to ammonia at ambient conditions on nitrogen and phosphorus Co-doped porous carbon [J]. Chemical Communications, 2019, 55(5): 687-690.
[55] LV C, QIAN Y M, YAN C S, et al. Defect engineering metal-free polymeric carbon nitride electrocatalyst for effective nitrogen fixation under ambient conditions [J]. Angewandte Chemie-International Edition, 2018, 57(32): 10246-10250.
[56] ZHANG X X, WU T W, WANG H B, et al. Boron nano-sheet: An elemental two-dimensional (2D) material for ambient electrocatalytic N2-to-NH3fixation in neutral media [J]. ACS Catalysis, 2019, 9(5): 4609-4615.
[57] QIU W B, XIE X Y, QIU J D, et al. High-performance artificial nitrogen fixation at ambient conditions using a metal-free electrocatalyst [J]. Nature Communications, 2018, 9: 1-8.
[58] LIU Y M, SU Y, QUAN X, et al. Facile ammonia synthesis from electrocatalytic N2reduction under ambient conditions on N-doped porous carbon [J]. ACS Catalysis, 2018, 8(2): 1186-1191.
Research progress of low-temperature electrochemical ammonia synthesis catalyst
RONG Yang-jia1, WANG Cheng-xiong2, ZHANG Xiu-juan1, XU Xiao-kun1, ZHAO Yun-kun1, 2 *
(1.State Key Laboratory of Advanced Technologies for Comprehensive Utilization of Platinum Metals, Kunming Institute of Precious Metals, Kunming 650106, China;2. State-Local Joint Engineering Laboratory of Precious Metal Catalytic Technology and Application,Kunming Sino-platinum Metals Catalysts Co. Ltd., Kunming 650106, China.)
The traditional high temperature and high pressure Haber-Bosch process for ammonia synthesis consumes a lot of fossil energy and emits a lot of greenhouse gases.Electrochemical reduction of nitrogen to ammonia at ambient temperature and pressure is a potential strategy. One of the main research directions in the field of electrochemical nitrogen fixation is to improve current efficiency and ammonia yield by developing efficient nitrogen reduction catalysts. Based on the analysis of more than 50 literatures, this paper reviews the research progress of catalysts for electrochemical ammonia synthesis in the past 20 years. By summarizing and comparing different metal-based and non-metal-based catalysts and catalytic efficiencies for the electrochemical synthesis of ammonia at low temperatures, several gold-based catalysts with high Faradaic efficiency and high ammonia yield are focused. And the importance of electrolyte properties and doping modification for the development of efficient transition metal-based and non-metal-based catalysts. Finally, the advantages, disadvantages and development potential of these three types of catalysts are compared and analyzed.
ammonia synthesis; electrochemistry; low temperature; catalyst
TQ150.1
A
1004-0676(2021)04-0076-11
2020-11-24
国家自然科学基金项目(21862010)
荣杨佳,女,硕士研究生,研究方向:工业催化。E-mail:18078432859@163.com
通信作者:赵云昆,男,研究员,研究方向:贵金属催化剂材料和机动车尾气净化催化剂。E-mail:yk.zhao@spmcatalyst.com
