γ-分泌酶抑制剂DAPT阻断Notch通路并纠正脑卒中后抑郁大鼠Th17/Treg失衡*
2021-04-06刘亚美宋景贵
李 静, 尉 娜, 刘亚美, 苏 静, 宋景贵
(1新乡医学院第三附属医院神经内科,河南新乡453000;2新乡医学院第一附属医院神经内科,河南卫辉453100;3新乡医学院第二附属医院神经内科,河南新乡453002)
脑卒中后抑郁(post stroke depression,PSD)是脑卒中中一种常见神经精神并发症[1],目前发病机制尚未明确,可能包括生物学和心理学等多方面因素[2]。随着抑郁症细胞因子假说的提出,研究认为,抑郁可能与免疫学缺陷有关[3-4]。辅助性T 细胞(help T cell,Th)和调节性T 细胞(regulatory T cell,Treg)均是CD4+T 细胞不同亚群,Th17 细胞可特异性分泌细胞炎症因子,诱导炎症反应及自身免疫性疾病,而Treg 细胞具有免疫抑制作用,可维持自身免疫耐受,Th17/Treg比例失衡与抑郁症、卒中后疲劳等疾病密切相关[5-6]。Notch 信号通路不仅与细胞增殖分化凋亡有关,还具有免疫调节功能。研究证实,γ-分泌酶抑制剂DAPT{N-[N-(3,5-difluorophenylacetyl)-L-alanyl]-S-phenylglycinet-butyl ester}是Notch 信 号通路有效阻断剂,在慢性丙型肝炎和过敏性哮喘等疾病中发挥调节Th17/Treg 平衡的作用[7-8],但DAPT是否亦通过阻断Notch 信号通路调控Th17/Treg 平衡而参与PSD 尚未可知。因此,本研究拟通过建立PSD 大鼠模型,探究DAPT 调控Th17/Treg 平衡参与PSD 的作用机制,以期为阐明PSD 发生机制提供参考资料。
材料和方法
1 实验动物
健康清洁级雄性Sprague-Dawley(SD)大鼠33只,7 周龄,体重220~250 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0007。大鼠于12 h/12 h 光照/黑暗、室温(22±2)℃环境中饲养,自由饮食、饮水。
2 药物和试剂
大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)线栓(型号:403556PK5Re)购自Doccol;DAPT(货号:D5942,HPLC≥98%)购自Sigma-Aldrich;RNA 提取试剂盒(货号:DP419)购自天根生化科技(北京)有限公司;实时荧光定量PCR(realtime quantitative PCR,RT-qPCR)试剂盒(货号:D7268S)购自上海碧云天生物科技有限公司;白细胞介素17(interleukin-17,IL-17)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(货号:ab214028)、IL-10 ELISA 试剂盒(货号:ab214566)、兔源Ⅰ抗[anti-Notch1(货号:ab52627)、anti-Hes1(货号:ab108937)、anti-β-actin(货号:ab179467)、anti-CD4(货号:ab237722)和anti-Foxp3(货号:ab215206)]及Ⅱ抗羊抗兔IgG(货号:ab6721)均购自Abcam。
3 主要仪器
Model 550 型酶标仪购自Bio-Rad;7500 型RTqPCR 仪、Evolution 220 型紫外分光光度计、Forma Steri-Cycle i160 CO2培养箱购自Thermo Fisher;IX73荧光显微镜购自Olymplus;FACSCalibur 流式细胞仪购自Becton Dikinson。
4 方法
4.1 PSD 大鼠模型建立 根据敞箱实验(open-field test,OFT)及蔗糖偏爱实验(sucrose preference test,SPT)测定大鼠基线评分,筛选符合条件的33 只SD大鼠随机分成假手术(sham)组(n=10)和手术组(n=23)。手术组大鼠术前禁食12 h,10%水合氯醛腹腔麻醉,参照文献[9]首先采用线栓法建立局灶性MCAO大鼠模型,术中插入栓线深度为(18±1)mm。术后24 h 参考文献[10]进行慢性不可预知性温和应激(chronic unpredictable mild stress,CUMS)刺激,大鼠在第1~15天分别进行禁食禁饮20 h、持续照明17 h、4℃强迫游泳5 min、45°倾斜笼17 h、禁饮17 h、湿笼21 h、水平震荡鼠笼5 min、夹尾1 min、行为约束2 h、禁食禁饮20 h、持续照明17 h、4℃强迫游泳5 min、45°倾斜笼17 h、禁饮17 h 处理、湿笼21 h;术中死亡3 只,成模大鼠20 只,成功率86.96%,随机分为PSD组和DAPT 组,每组各10 只。DAPT 组于MCAO 术后2 d 进行CUMS 刺激结合孤养,于第15 天皮下注射DAPT(5 mg/kg[11]),干预2 周;sham 组大鼠进行开颅手术但不阻断大脑中动脉,sham 组和PSD 组大鼠皮下注射等量生理盐水进行同等时间干预。模型成功标准:造模24 h 内出现明显神经功能缺陷;CUMS 刺激2 周后出现体重减轻、活动减少、蜷缩少动、兴趣感下降等抑郁样症状。
4.2 体重及行为学检测 各组大鼠于术前(0 d)及术后7、14、21 和28 d 分别进行体重检测、OFT 及SPT。(1)OFT:制备80 cm×80 cm×40 cm敞箱,壁周为黑色,底面用黑线划分为25 块面积相等的小块,记录5 min 内大鼠穿越底面方块数的水平运动评分,及以直立(两前肢离地超过1 cm)次数为评价指标的垂直运动评分;(2)SPT:参考曲淼等[3]的方法进行改进,给予1%蔗糖水饲养48 h,禁水4 h 后暴露于两个外观完全相同的瓶子(1 个盛满1%蔗糖水,另1 个盛满普通饮用水)1 h,测定大鼠糖水消耗体积与总消耗水体积比值。
4.3 海马Notch1 和Hes1 mRNA 表达水平检测 开颅取脑,分离海马组织,置于液氮中保存备用。提取各组5 只大鼠海马组织总RNA,反转录得到cDNA,置于-20℃保存备用。采用RT-qPCR 扩增Notch1 和Hes1 mRNA 片段。20 μL 反应体系:TB Green Premix Ex Taq Ⅱ(2×)10 μL,ROX Reference Dye II(50×)0.4 μL,cDNA(50 mg/L)2 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件:95℃30 s;95℃5 s,60℃34 s,40个循环。Notch1上游引物序列(5′→3′)为GCTGACCTGCGCATGTCTGCCATG,下 游 引 物 序 列(5′→3′)为CATGTTGTCCTGGATGTTGGCATCTG;Hes1 上游引物序列(5′→3′)为GCACAGAAAGTCATCAAAGCCTATT,下游引物序列(5′→3′)为GCTATCTTTCTTCAGAGCATCCAA;内参照GAPDH 上游引物序列(5′→3′)为GTCGATGGCTAGTCGTAGCATCGAT,下游引物序列(5′→3′)为TGCTAGCTGGCATGCCCGATCGATC。采用2-ΔΔCt法定量分析Notch1 和Hes1 mRNA 相对表达水平。
4.4 海马Notch1 和Hes1 蛋白表达水平检测 采用Western blot 检测各组剩余5 只大鼠海马组织Notch1和Hes1 蛋白表达。蛋白提取试剂盒提取总蛋白,BCA 法测定蛋白质浓度,依次进行SDS-PAGE、转膜、封闭,分别添加Ⅰ抗[anti-Notch1(1∶2 000)、anti-Hes1(1∶1 000)和anti-β-actin(1∶2 000)],4℃孵育过夜,添加Ⅰ抗IgG(1∶5 000)室温避光孵育1 h,增强化学法显影,蛋白条带灰度值用ImageJ软件分析。
4.5 外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中Th17和Treg细胞比例检测 上述实验结束后将大鼠麻醉处死,采集4 mL 腹主动脉血于肝素钠采血管中抗凝,添加淋巴细胞分离液分离PBMC,RPMI-1640 培养基洗涤2 次后调整细胞密度为1×107/L。取100 mL,添加0.5 mL 佛波酯及0.5 mL 莫能菌素,混匀后于37℃、5% CO2培养箱中孵育4 h。细胞悬液混匀后转移至1.5 mL EP 管中添加0.5 mL CD4,4℃孵育30 min后,离心弃上清,PBS重悬细胞后分别添加PE-IL-17 抗体0.625 mL 和PEFoxp3 抗体5 mL,对照组分别加入同型PE-IgG2a 0.625 mL 和55 mL,4℃避光孵育30 min 后,上流式细胞仪分别检测Th17和Treg细胞比例。
4.6 血清IL-17 和IL-10 水平测定 外周血常规离心后分离血清,采用ELISA 检测各组大鼠血清IL-17和IL-10 水平,具体操作步骤严格按照试剂盒说明书进行。
5 统计学处理
采用SPSS 25.0 软件进行统计学处理。计量资料以均数±标准差(mean±SD)表示,多组数据比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
结果
1 DAPT对PSD大鼠体重的影响
随着时间从延长,sham 组大鼠体重逐渐增加,而PSD组和DAPT组大鼠体重呈先降低后增加趋势;在0 d,各组大鼠体重差异无统计学意义(P>0.05);在7、14、21 和28 d,与sham 组比较,PSD 组大鼠体重均显著降低(P<0.05);在7 和14 d,PSD 组和DAPT组大鼠体重差异无统计学意义(P>0.05);在21和28 d,与PSD 组比较,DAPT 组大鼠体重显著增加(P<0.05),见图1。

Figure 1. Effect of DAPT on the body weight of PSD rats. Mean±SD. n=10. *P<0.05 vs sham group;#P<0.05 vs PSD group.图1 DAPT对PSD大鼠体重的影响
2 DAPT对PSD大鼠OFT结果的影响
各组大鼠0 d 基线水平运动评分和垂直运动评分差异无统计学意义(P>0.05);在7、14、21 和28 d,与sham 组比较,PSD 组大鼠水平运动评分和垂直运动评分均显著降低(P<0.05);在和14 d,PSD 组与DAPT 组大鼠水平运动评分和垂直运动评分差异无统计学意义(P>0.05);在21 和28 d,与PSD 组比较,DAPT 组大鼠水平运动评分和垂直运动评分显著升高(P<0.05),见图2。

Figure 2. Effect of DAPT on the motor score of PSD rats in open-field test. A:horizontal motor score;B:vertical motor score. Mean±SD. n=10. *P<0.05 vs sham group;#P<0.05 vs PSD group.图2 DAPT对PSD大鼠敞箱实验中运动评分的影响
3 DAPT对PSD大鼠糖水消耗比例的影响
各组大鼠0 d 糖水消耗比例差异无统计学意义(P>0.05);在7、14、21 和28 d,与sham 组比较,PSD组大鼠糖水消耗比例均显著降低(P<0.05);在7 和14 d,PSD 组与DAPT 组大鼠糖水消耗比例差异无统计学意义(P>0.05);在21 和28 d,与PSD 组比较,DAPT 组大鼠糖水消耗比例显著增加(P<0.05),见图3。
4 DAPT 对PSD 大鼠海马组织Notch1 和Hes1 mRNA表达的影响
与sham 组比较,PSD 组大鼠海马组织Notch1 和Hes1 mRNA 表达水平显著升高(P<0.05);与PSD 组比较,DAPT 组大鼠海马组织Notch1 和Hes1 mRNA表达水平显著降低(P<0.05),见图4。
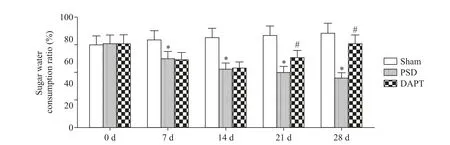
Figure 3. Effect of DAPT on sugar water consumption ratio in PSD rats. Mean±SD. n=10. *P<0.05 vs sham group;#P<0.05 vs PSD group.图3 DAPT对PSD大鼠糖水消耗比例的影响

Figure 4. Effect of DAPT on Notch1 and Hes1 mRNA expression in hippocampal tissues of PSD rats. Mean±SD.n=5. *P<0.05 vs sham group;#P<0.05 vs PSD group.图4 DAPT 对PSD 大鼠海马组织Notch1 和Hes1 mRNA 表达的影响
5 DAPT 对PSD 大鼠海马组织Notch1和Hes1蛋白表达的影响
与sham 组比较,PSD 组大鼠海马组织Notch1 和Hes1 蛋白表达水平显著增加(P<0.05);与PSD 组比较,DAPT 组大鼠海马组织Notch1 和Hes1 蛋白表达水平显著降低(P<0.05),见图5。
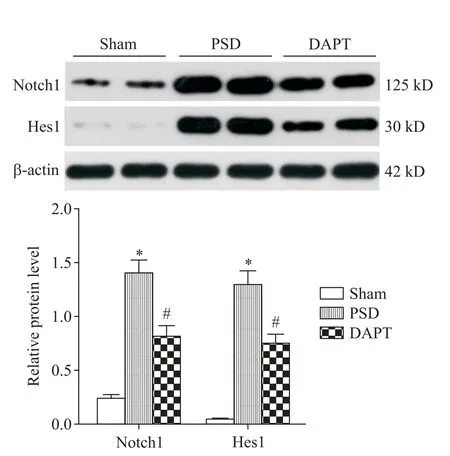
Figure 5. Effect of DAPT on Notch1 and Hes1 protein expression in hippocampal tissues of PSD rats. Mean±SD.n=5. *P<0.05 vs sham group;#P<0.05 vs PSD group.图5 DAPT 对PSD 大鼠海马组织Notch1 和Hes1 蛋白表达的影响
6 DAPT 对PSD 大鼠PBMC 中Th17 和Treg 细 胞比例的影响
与sham 组比较,PSD 组大鼠PBMC 中Th17 细胞比例和Th17/Treg 比值显著升高,Treg 细胞比例显著降低(P<0.05);与PSD 组比较,DAPT 组大鼠PBMC中Th17 细胞比例和Th17/Treg 比值显著降低,Treg细胞比例显著升高(P<0.05),见图6。
7 DAPT 对PSD 大鼠血清IL-17 和IL-10 水平的影响
与sham 组比较,PSD 组大鼠血清IL-17 水平显著升高,IL-10 水平显著降低(P<0.05);与PSD 组比较,DAPT 组大鼠血清IL-17 水平显著降低,IL-10 水平显著升高(P<0.05),见图7。
讨论
PSD 是卒中后脑部特定功能结构损伤,尤其是左侧额叶、颞叶、基底节、丘脑部位病变等,及各种心理和社会应激的共同作用结果[12]。研究显示,啮齿类动物在经历一系列CUMS 应激后可出现活动减少、兴趣下降、快感缺失等抑郁样行为[13],因此本研究首先采用MCAO 术制备缺血性脑卒中SD 大鼠模型,再联合CUMS 及孤养法模拟卒中后负压力环境制备PSD 大鼠模型。结果显示,与sham 组比较,PSD 组大鼠随观察时间延长,体重呈先降低后缓慢增加趋势,可能与大鼠情感抑郁和食欲下降有关,也可能与应激过程禁食禁水等直接刺激有关,提示体重减轻可能直接反映应激对大鼠带来严重负面影响。而且OFT 中水平运动评分和垂直运动评分依次降低。OFT 是一种反映大鼠探索能力及情绪反应的经典实验,大鼠水平运动评分和垂直运动评分降低可反映大鼠存在兴趣下降、探索能力降低等抑郁症状。正常大鼠对甜味有偏好,而本研究结果显示PSD 组大鼠糖水消耗量比例降低,提示PSD 大鼠存在快感缺失症状,与Tao等[14]文献报道一致。综合以上结果提示,PSD模型制备成功,可用于后续实验。

Figure 6. Effect of DAPT on the proportions of Th17 and Treg cells in PBMC of PSD rats. Mean±SD. n=5. *P<0.05 vs sham group;#P<0.05 vs PSD group.图6 DAPT对PSD大鼠PBMC中Th17和Treg细胞比例的影响

Figure 7. Effect of DAPT on serum IL-17 and IL-10 levels in PSD rats. Mean±SD. n=10. *P<0.05 vs sham group;#P<0.05 vs PSD group.图7 DAPT对PSD大鼠血清IL-17和IL-10水平的影响
DAPT 间接影响Notch 活化,进而影响细胞信号通路作用。Notch 通路是由一类在进化过程中高度保守的表面受体基因组成,可通过细胞间信号传递作用参与细胞增殖、分化及凋亡等多种生物学过程。Notch 信号通路中Notch1 及其下游靶分子Hes1 表达上调不仅可促进巨噬细胞活化释放促炎因子,还可通过与不同配体结合调节Th17 细胞分化参与炎症反应[15-16]。Treg 及Th17 不仅在分化上存在联系,而且可相互转化,Th17 细胞主要分泌IL-17 和IL-6 等促炎细胞因子,Treg 细胞可分泌IL-10 和TGF-β 等,而Th17分化依赖TGF-β水平[17-18]。研究显示,Th17/Treg 细胞失衡 与Notch1 表 达 增加有 关[8],而阻 断Notch 信号通路可通过抑制Treg 细胞功能,调节Th17/Treg细胞平衡,减轻大鼠肝纤维化[19],还可通过抑制促炎因子释放改善动脉粥样硬化性缺血性脑卒中[11]。本研究结果显示,与sham 组比较,PSD 组大鼠海马组织Notch1 和Hes1 的mRNA 及蛋白水平,以及PBMC 中Th17 细胞比例和Th17/Treg 比值均显著升高,Treg 细胞比例降低,提示PSD 大鼠存在Th17/Treg 细胞平衡紊乱及Notch 信号通路激活。Notch 信号通路中配体与受体结合后经γ-分泌酶进行组成型酶切,激活相关基因表达,而DAPT 可抑制γ-分泌酶活性,间接阻断Notch 信号通路激活[20]。本研究亦采用DAPT 阻断Notch 信号通路,结果显示,与PSD 组比较,DAPT 组大鼠海马组织Notch1 和Hes1 的mRNA 及蛋白表达水平显著降低,PBMC 中Th17 细胞比例、Th17/Treg 比值及血清IL-17 水平降低,Treg细胞比例和血清IL-10 水平增加,大鼠体重、OFT 实验中水平运动评分、垂直运动评分及糖水消耗比例均显著增加,提示DAPT 阻断Notch 信号通路可能通过调控Th17/Treg 平衡减轻PSD 炎症反应,增强其自身免疫,从而减轻PSD大鼠抑郁样症状。
综上所述,DAPT 可减轻PSD 大鼠抑郁样症状,其机制可能是通过阻断Notch 信号通路进而缓解Th17/Treg失衡及炎症因子分泌。但本研究指标从大鼠行为上反映抑郁行为,主观性较强,使结果有一定偏倚,针对PSD 大鼠抑郁的更多客观性评价指标及具体作用机制有待深入探究。
