微纳米铝粉的氧化动力学研究进展
2021-04-06王敬凯睢贺良杨秀兰索志荣
王敬凯,陈 捷,睢贺良,于 谦,杨秀兰,索志荣,孙 杰,银 颖
(1. 中国工程物理研究院化工材料研究所,四川 绵阳 621999;2. 西南科技大学材料科学与工程学院,四川 绵阳 621010)
1 引言
金属铝粉具有较高的热值,已经被广泛应用于新型高能推进剂及高能炸药体系中[1]。微纳米铝粉添加剂能够有效提高固体推进剂体系的动、静态燃速[2];而对于高能炸药,铝粉不仅可以显著提高炸药体系的爆热和输出能量[3],还能够较大程度地降低含能材料热分解反应的活化能[4],大幅缩短含能材料分解诱导期。然而,由于微纳米铝粉具有较大的比表面积和表面能,暴露的活性中心多,而这些活性中心易于与氧化性物质反应,导致自身活性下降,从而使得推进剂、炸药体系输出的能量降低,影响其最终效能[5-6]。
微纳铝粉在生产、运输、贮存和使用等过程中,可能与环境中某些氧化性物质发生反应,包括氧气、水、二氧化碳等,其中铝-氧和铝-水反应体系是最常见的氧化体系。一方面,微纳米铝粉的这种氧化反应是其放热释能的途径,也是导致其老化失活和能量降低等问题的重要原因;另一方面,在新能源研究领域,许多科学家提出可以利用这一反应作为制取清洁能源氢气的途径之一[7-9],另外铝-空气电池本质上也是借助铝的氧化还原实现能量的转化和存储[10-11]。因此,尽管面向铝氧化问题的相关研究由来已久,但一直都受到不同领域研究者的高度关注。近年来,随着对铝氧化反应体系研究的深入,许多学者开始致力于从两方面来理解铝粉的氧化失活问题,一是以分子动力学为手段,力图从原子尺度上阐明铝粉氧化的微观机制,同时分析影响铝粉氧化机制的关键因素;二是通过建立合理的反应动力学模型,以求实现从定量水平对铝粉氧化的反应进程进行描述。这些研究不仅有助于深化人们对微纳铝粉氧化过程的本质认识,也有利于实现对铝粉氧化过程的预测和评估,对制定更加科学的防失活策略、预测铝粉老化寿命乃至对其氧化反应的有效控制等都具有重要价值。
在国内外研究成果的基础上,按照反应体系的类型,将铝粉的氧化反应分为铝-氧、铝-水以及铝-其他氧化物反应体系,以分子动力学和反应动力学的相关进展为着眼点,详细讨论了在上述反应体系中影响铝粉氧化动力学的关键因素,并对不同氧化反应体系尚待解决的问题进行了分析和展望。
2 概述
2.1 分子动力学(Molecular dynamics, MD)
分子动力学模拟为研究微纳铝粉的氧化过程提供了有效的技术手段,它的主要目的是利用计算机技术对微观粒子间的相互作用和运动进行模拟[12-13]。在模拟过程中,每一个原子核会在其他原子核和电子所构成的经验势场的作用下按照牛顿运动定律进行运动,进而得到体系中粒子的运动轨迹,再根据统计物理的方法得到一系列宏观性质[14]。分子模拟的一般步骤为(图1):
图1 分子动力学模拟的一般步骤Fig.1 Normal steps in molecular dynamics simulation
分子动力学模拟的关键在于原子之间相互作用势函数的选取,体系的势函数可以分解为多种势函数的共同作用[15];而分子动力学模拟存在的问题在于其仅能应用于几百至几千个粒子的系统,很难模拟宏观体系。因此,通过引入周期性边界条件,将基本单元在各个方向上进行扩展,从而扩大模拟体系以提高模拟结果的准确性。
1.2 反应动力学(Reaction kinetics)
反应动力学是建立在化学热力学、动力学及热分析技术基础上的一门学科[16-17]。它的基本思想是通过测定反应过程中的特征量的变化(如质量、温度、热量、放气量等),建立反应速率随温度、时间变化的数学关系,实现对化学反应过程的定量描述,并可在此基础上预测更复杂条件下的反应进程。
反应动力学的快慢取决于反应速率常数k(T)的大小,k(T)对于温度的依赖性遵从Arrhenius方程(1):

式中,α 为反应物在化学反应过程中的转化率;k(T)为反应速率常数,f(α)为反应机理函数。
反应动力学研究的任务就是设法获得公式(2)中表征某个化学反应过程的“动力学三因子(Kinetic Triplet)”:E、A 和f(α),并以此来对反应曲线进行拟合和预测,进而展开反应过程的模拟与控制。
3 铝-氧反应体系
微纳米铝粉具有尺寸较小、颗粒表面键态和电子态与颗粒内部不同、表面原子配位不全等特点,使得颗粒表面活性位点增加,与不同氧化剂发生化学反应的活性增强[18-19]。其中,铝-氧反应作为引起铝粉失活的重要机制,是被研究得最为深入的一类氧化体系,尤其是近些年来,以分子动力学为代表的计算模拟方法被越来越广泛地用于研究铝-氧反应的微观机制和动力学过程,获得了许多有价值的认识和结论。
3.1 铝-氧反应体系的分子动力学研究
3.1.1 氧化壳层的影响
在贮存及应用环境条件下,微纳米铝粉表面总是伴有氧化铝壳层,整体上以“铝核-氧化铝壳”的核-壳结构稳定存在,这是由金属铝的高活性表面在接触氧气后迅速被氧化而形成的。研究表明,氧化铝壳层对铝颗粒的进一步氧化以及燃烧释能过程具有重要影响。Wang W 等[20]采用多原子分子动力学模拟研究了氧化铝壳的晶态(Crystalline alumina shell,CS)和非晶态(Amorphous alumina shell,AS)结构对铝纳米颗粒氧化动力学的影响,发现当氧化铝壳为非晶态时,由于壳的破碎形成了氧化纳米簇碎片,而铝纳米颗粒进一步与氧化物碎片相结合,可催化更快的氧化反应。此外,非晶态壳层较之晶态氧化壳具有更多的孔隙,允许更多的铝原子从内部喷出,导致氧化更加迅速,释放更多热量。图1 给出了在非晶态和晶态氧化壳状态下,反应系统内氧化物各种碎片的产量及其占比随时间的动态演化过程。可以看到,非晶态系统各氧化物碎片量比晶态明显更多,而碎片数量随时间的增长速率也明显更快(图2a);从氧化物的组成上看(图2b),非晶态和晶态的氧化壳层均在极短时间内(低于50 ps)从富铝型变成了富氧型,但是在非晶态系统中这一过程明显更快。因此,相对于结晶性良好的氧化壳层,非晶态的氧化铝壳层更加有利于铝核的快速氧化,这得益于非晶态氧化铝对氧化反应具有一定的催化能力,同时其多孔结构有利于内部铝原子向外进行热扩散。
对于在同一氧化层表面的不同原子位点,其氧化动力学也可能存在差异。Baran J D[21]发现氧分子更倾向于吸附在配位不足的铝原子位点上,如对Al(111)上第五层α-Al2O3(0001)的计算表明,该氧化层表面上共有九个活性吸附位点,其中七个位点对氧分子的吸附能为1.53 eV,而其余两个位点的吸附能仅为1.23 eV 和1.22 eV(图2c),吸附能的差异来自氧化物/金属界面的局部原子结构不同。
进一步地,理论计算表明[21]氧化壳层在Al(111)晶面上的极限厚度约为18 Å,电荷转移到被吸附的氧分子上,当氧分子在氧化膜上吸附达到饱和时,在氧化物上产生一个Mott 电势,足以驱动氧化过程。因此,研究者认为氧化层具有极限厚度的根本原因在于氧分子的吸附能的降低,这将大大减弱氧气的供应;当氧分子不被吸附时,Mott 电势被破坏,进而破坏了有利于离子扩散的势场,导致氧化层停止生长。有趣的是,这与Lan N 等人[22]的结论恰恰相反,后者认为Mott 电势是在反应过程中逐渐达到的,极限厚度来源于Mott 电势的形成过程,而非破坏。此外,Lan N 等[22]还从实验上证明了氧化物在铝颗粒不同晶面上的生长方式不同,在Al(100)晶面上氧化物平行于晶面进行侧向生长,而在Al(111)晶面,氧化物不仅沿晶面侧向生长,还会同时向铝晶格内部进行生长。但是目前还缺乏分子动力学模拟来解释上述氧化物生长差异的内在原因,未来有必要开展铝颗粒的晶体取向对氧化动力学的影响机理研究。

图2 a 和b 分别是CS(虚线)和AS(实线)系统中Al2O(蓝色),AlO(绿色)和AlO2(红色)产物碎片的碎片数目和相对百分比[20];c 是在不同α-Al2O3层数下O2分子在Al2O3/Al(111)上的吸附能[21]Fig.2 Production of Al2O(blue),AlO(green)and AlO2(red)fragments in the CS(dashed line)and AS(solid lines)systems are shown by(a)number of fragments of each species and(b)the relative percentage of each fragment species[20];The adsorption energy per O2 molecule on Al2O3/Al(111)for different numbers of α-Al2O3 layers(c)[21]
3.1.2 粒径的影响
从几何结构上,铝颗粒的粒径很大程度上决定了其比表面积,而表面铝原子的原子占比是影响铝粉氧化动力学的关键因素。因此,铝颗粒的粒径变化将如何影响其氧化过程,成为研究者十分关注的问题。目前,借助分子动力学模拟手段,已经可以较为深入地了解不同粒径铝颗粒内在的微观氧化机理以及动力学过程。
Li Y 等[23]首先建立了直径为26,36,46 nm,且氧化壳层厚度为3 nm 的铝纳米颗粒模型,并研究了粒径对其氧化行为的影响规律。结果表明,对于不同粒径的纳米颗粒,其氧化反应的初始阶段均发生在核壳界面,首先形成富铝氧化物,并进一步演化为富氧氧化物;随着粒径的减小,初始反应的速度明显加快。图3a 为46 nm 铝颗粒的氧化动力学快照,可以看到在反应初期氧化壳并不会发生破裂,纳米颗粒仅出现一定程度的变形,通过比较不同粒径铝颗粒,发现粒径越小变形程度越剧烈;当温度达到2900 K 时壳体熔化,在应力作用下铝纳米颗粒向外喷射铝原子,同时粒径越小,越早开始向外喷射,而喷射出的铝原子逐渐在外部区域被氧化,粒径越小氧化放热越多。
因此,在上述粒径范围内,粒径尺寸改变铝颗粒氧化动力学行为的实质是:在反应初期影响颗粒的变形程度(应力),而这种变形或应力又构成氧化中后期内部铝原子向外喷射的条件;粒径的减小有助于铝颗粒在氧化过程中发生快速变形,同时增加铝原子向外喷射的能力,并缩短铝原子向外喷射的时间。上述过程共同使得更小粒径的铝颗粒具有更高的氧化速率和放热能力,这些认识对于理解铝粉燃烧的微观动态机理及其尺寸效应具有重要价值。
除了制备工艺差异引起铝颗粒存在不同粒径,纳米颗粒之间发生团聚也是引起粒径变化的原因之一。在纳米铝粉的实际应用中,由于纳米尺度的铝颗粒表面能很高,多个颗粒之间可能会发生团聚,形成更大的团聚体。这种团聚体的表面状态将发生较大改变,导致其微观氧化行为也发生相应改变,而借助分子动力学模拟,可以对团聚态纳米颗粒氧化行为进行研究。由三个纳米颗粒团聚形成纳米链可视为团聚体的一种典 型 结 构(图3b)[24],从 分 子 动 力 学 的 结 果 来 看(图3c),纳米链首先在外侧铝纳米颗粒发生氧化,温度迅速升高并发生变形;进一步地,氧化放热将驱动热铝原子通过接触点逐渐渗透到相邻未氧化的纳米颗粒中,从而引发内部纳米颗粒发生氧化;随着热铝原子在接触面处的不断扩散,最终纳米链将融合成一个更大的整体颗粒。因此,纳米团聚体的氧化行为与单个纳米颗粒存在一定差异,主要表现在团聚体中不同颗粒之间的氧化过程并不同步,外部和内部纳米颗粒之间存在明显的初始温差;此外,颗粒之间的界面接触是决定团聚体氧化进程的关键,接触面的热量传递和原子扩散分别引起温度梯度和原子浓度梯度,驱动团聚体不断发生氧化反应。因此,接触面是纳米团聚体氧化行为区别于独立纳米颗粒的重要结构,也是影响其氧化速率和氧化程度的关键因素,在未来的研究中,可考虑通过优化纳米团聚体内部的接触面结构,使之能够实现热量或原子的快速扩散,可能是改善其燃烧释热能力的一个重要途径。
此外,在某些特定粒径的铝团簇结构中,研究者还发现了一种十分有趣的氧化行为。分子动力学研究证明[25],Al147团簇在局部氧化后(Al147O20)形成了一种非常特殊的Janus 结构(Al@Al2O3),即一半为金属铝原子,一半为氧化铝(Al2O3)结构(图3d)。这种Janus 状的颗粒具有比常规“核-壳”结构更低的表面能,而针对Al147O10、Al147O50等团簇开展氧化反应模拟,却并未发现类似的Janus 结构。理论计算表明Janus 结构恰能使得Al147O20在承受共价键和结构变化引起的应力以及氧化壳晶格失配,并保持其表面能最低。
通过上述研究,可以看到不同粒径的铝颗粒可表现出不同的氧化行为,作为铝颗粒的一种本征结构参量,粒径改变引起铝颗粒氧化行为变化的本质在于影响其氧化初期的变形程度,以及反应中后期内部铝原子向外扩散的速率及其氧化程度;而对于团聚状态下的纳米颗粒,其氧化行为改变的原因在于内部颗粒间接触面引起氧化反应不同步,以及在接触界面处发生的纳米颗粒间原子扩散。这些认识对于我们通过粒径控制来调节铝颗粒的氧化行为,设计和优化接触界面以提高团聚体释能效率等都具有一定价值。
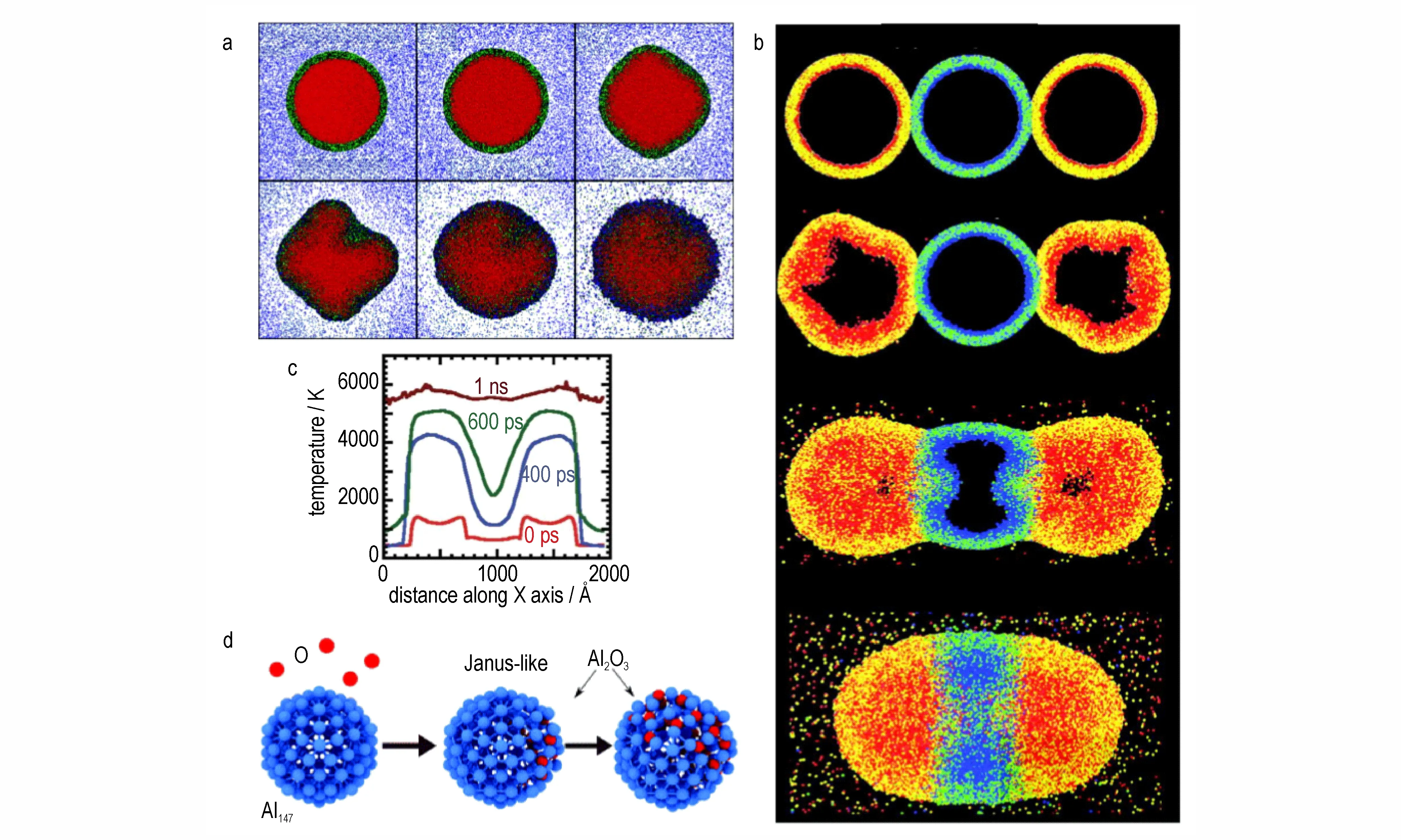
图3 随着时间延长直径为46nm Al-NP 的中央切片的快照(a)[23];模拟铝纳米颗粒链氧化过程的快照(b)[24];氧化过程对应的温度分布(c)[24];Al147氧化产生具有Janus 状的Al@Al2O3(d)[25]Fig.3 Snapshots of the central section of 46 nm Al-NP with time extension(a)[23];Snapshot of simulated aluminum nanoparticle chain oxidation process(b)[24];Temperature distribution corresponding to oxidation process(c)[24];Al147 oxidation produces Al2O3 with Janus shape(d)[25]
3.1.3 原子扩散速率的影响
在铝颗粒的氧化过程中,铝核与氧化壳层之间存在原子扩散,包括铝原子向外扩散和氧原子向内扩散。一般而言,这两种原子扩散的速率并不一致,不仅导致铝颗粒内部结构的改变,更为重要的是这种内部结构变化将影响铝颗粒进一步的氧化动力学过程。
分子动力学研究发现,铝颗粒在氧化过程中,铝核与氧化壳层之间出现了界面间隙,即核-壳之间的物理结构出现不连续,这种界面间隙将显著提高原子扩散的能垒,从而阻碍间隙附近铝核的进一步氧化。Wu B等[26]分析了这种核-壳界面间隙的成因,通过研究具有氧化壳层(2~4 nm)的铝纳米颗粒在有氧环境中的结构演化,发现界面间隙产生来自于核内铝原子向氧化壳层的快速扩散。在反应初期,铝核中铝原子迅速扩散到壳内,并远快于氧原子向核内扩散的速率,从而在界面附近形成空隙。进一步的研究发现,铝原子扩散速率的不同还将导致界面间隙结构的差异。如图4a所示,在C5S2(铝核和氧化壳的粒径分别为5 nm 和2 nm)纳米颗粒中,界面间隙以对称结构的形式出现,并且有多个桥梁将铝核和氧化壳连接起来;而在C5S4(铝核和氧化壳的粒径分别为5 nm 和4 nm)结构中形成的却是不对称的界面间隙。模拟结果表明,这种界面结构对称性的差异源于铝原子扩散速率的不同,当铝原子扩散速度较快并足以形成大空隙时(如C5S4体系),更倾向于形成不对称的空心粒子,而在C5S4体系中铝原子扩散速率相对较慢,因此更倾向于形成对称的界面间隙。
这种核-壳之间的界面间隙结构会显著影响铝颗粒的进一步氧化行为。由于铝核在逐步氧化过程中存在热驱动力与电离势垒之间的竞争机制[27],铝原子进入氧化物层的过程是热激活的,并且很大程度上取决于界面间隙尺寸,在氧化过程中(图4b),随着温度的提高更多铝核内的铝原子渗入氧化物层,界面间隙将扩大,结果电离势垒在氧化期间逐渐增大,当势垒达到一定值时将阻碍氧化反应的进一步进行。
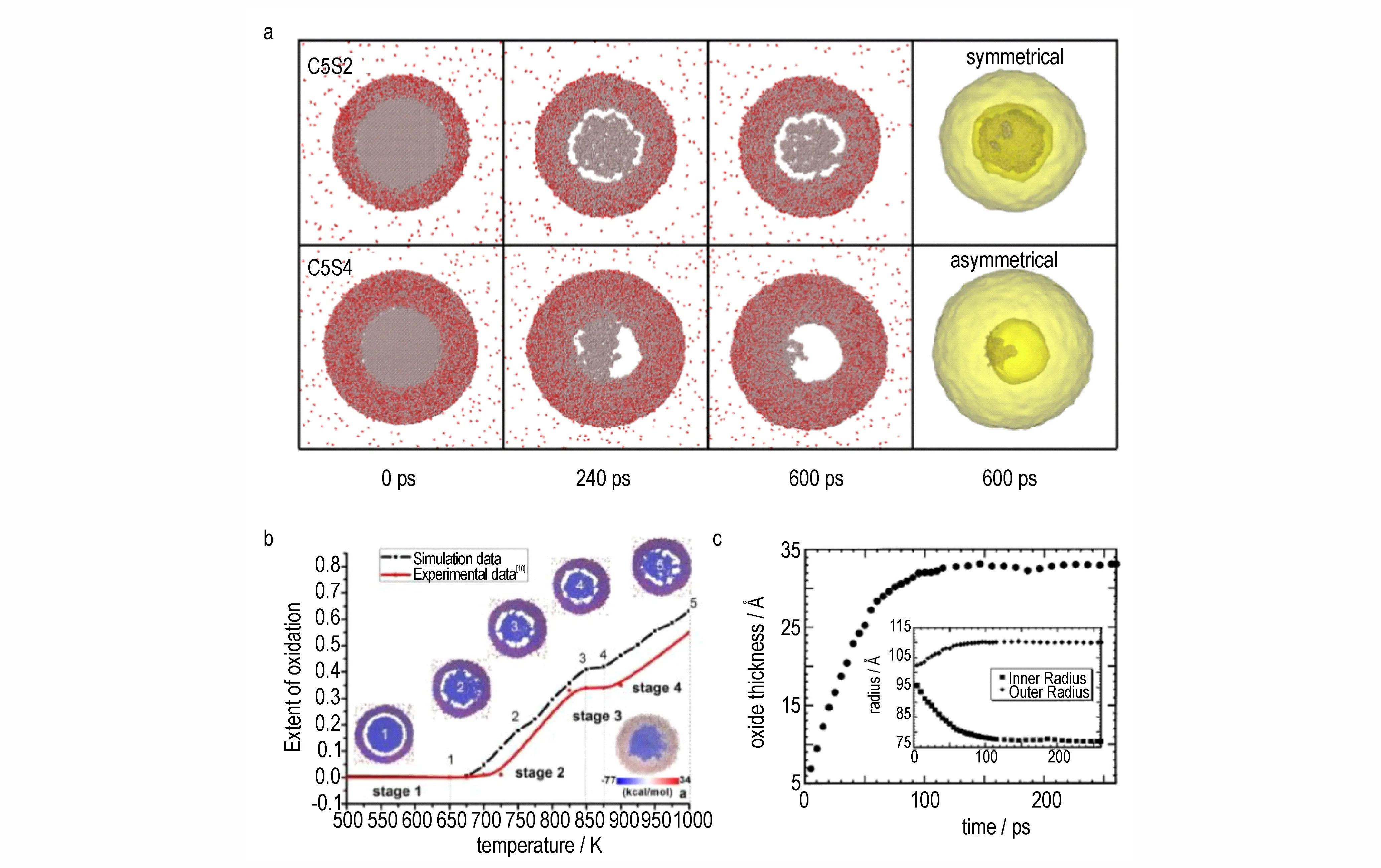
图4 C5S2 和C5S4 纳米颗粒在不同时间下的氧化快照,最后一列是600 ps 时的3D 结构(a)[26];随着温度升高的逐步氧化过程(b)[27];氧化层厚度是模拟时间的函数,在插图中显示了氧化层的内部和外部径向扩展作为模拟时间的函数(c)[28]Fig.4 Oxidation snapshots of C5S2 and C5S4 nanoparticles at different time,The last column is a 3D structure at 600 ps(a)[26];Stepwise oxidation process with the increase of temperature(b)[27];Thickness of the oxide layer as a function of simulation time,the inner and outer radial extents of the oxide layer as a function of simulation time are shown in the inset(c)[28]
可以看出,上述研究认为铝颗粒的氧化过程主要为铝原子向外的扩散过程,即使在出现界面间隙之后,铝原子的扩散仍是进一步氧化的主要驱动力。然而,另一些研究者认为,铝颗粒的氧化过程应同时考虑氧化壳层向内和向外生长两个过程,其中壳层向内生长是由于氧原子向内部扩散,而向外生长则是铝原子向外扩散的结果。Campbell T 等[28]分析了氧化铝壳层的径向扩展问题,发现氧化物的生长既向内又向外(图4c),铝颗粒的局部应力显示氧化铝壳层处于负压下,而铝核则处于正压下,且铝原子的扩散速率比氧原子高30%~60%。实际上,这种铝-氧原子共同扩散的氧化机制与实验结果更为相符[29],基于不同温度下铝纳米颗粒氧化行为的实验研究表明,氧化过程主要通过氧化壳向内扩散氧或通过电场向外扩散铝离子实现,在低温下主要以氧原子的扩散为主导;而在较高的温度下,铝原子的向外扩散控制了反应速率,反应界面位于外表面,从而导致颗粒内部形成空隙。因此,应将氧化壳层生长归因于铝原子和氧原子扩散共同贡献,也更接近铝颗粒氧化的实际情况。同时,由于不同原子的扩散速率存在显著差异,与Wu B 等[26]提出的界面间隙产生机制并不矛盾。
3.1.4 氧浓度的影响
氧气浓度是影响铝粉氧化行为的重要因素之一。在纳米铝粉的实际使用中,通常要预先在较低浓度的氧气环境下对其进行钝化处理,但高浓度的氧气气氛则可能引起纳米铝粉发生燃烧或爆炸。实验研究表明[30],随着氧浓度增大,铝纳米颗粒(~80 nm)出现了从轻度氧化到微爆炸的不同反应模式(图5a)。显然,氧气浓度不仅影响铝颗粒表面氧化物质的生成量,在一定条件下还可能改变铝颗粒的微观氧化机理,而开展分子动力学研究有助于更加深入地理解其内在机制。
Zhang X F 等[31]对上述问题开展了较为详细的研究,通过对5 nm 铝纳米颗粒(约4000 个铝原子)在不同氧浓度下的结构演化进行分子动力学模拟,发现当氧气浓度较低时,铝颗粒的氧化行为主要表现为表面壳式氧化,即生成的氧化物以壳状形式包覆于纳米颗粒表面,形成常见的核-壳状结构的铝纳米颗粒;但随着氧气浓度升高,氧化机制转变为以链式氧化为主,且当进一步提高氧气浓度时,氧化过程表现为经链式反应直接生成氧化物团簇。可见,氧浓度影响铝纳米颗粒氧化行为的本质在于由壳式氧化机制(低浓度氧)向链式反应机制(高浓度氧)的转变。图5b 给出了铝纳米颗粒在较高浓度氧(4500 个O2分子,50.4 nm×50.4 nm×50.4 nm 空间)条件下链式成核和生长的动力学过程,被吸附的O2分子首先在表面解离并形成两个Al4O 四面体,随后另一O2分子在其附近解离并同样生成两个相连的Al4O 凸起结构,这些凸起的Al4O四面体通过彼此相连形成链状结构并从纳米颗粒表面向外延伸。应注意到,最初形成的氧化物链是不稳定的,在未氧化尾部处(位于纳米颗粒表面)的Al 原子因配位数非常低而具有高反应活性,因此氧分子将优先攻击这些未氧化的尾部Al 原子,且氧分子的解离可能导致这些位点处的氧化物链脱离表面,形成氧化物团簇;而纳米颗粒表面上的其余链则会因彼此之间的随机碰撞而连接成环,最后缠绕在纳米颗粒表面。上述分子动力学过程不仅很好地解释了实验中不同氧浓度下铝粉氧化行为差异的现象,而且给出了从宏观上难以观察到的原子微观演化信息。这些认识对于纳米铝表面钝化工艺的有效控制,预防纳米铝粉的氧化反应失控具有很好的理论指导价值。
在分子动力学模拟研究的基础上,一些研究者[32]提出了表面热点理论,用以解释不同氧浓度引起的铝粉氧化层厚度的改变。他们认为,由于氧分子的吸附和解离,使得铝纳米颗粒表面产生了热点和高温区,这些局域的高温热点导致表面铝原子之间产生了空隙,而空隙又大大降低了氧分子扩散的反应势垒,随后通过加速的氧扩散形成氧化层。注意到此处的空隙是由热点导致的表面原子间隙,与前文中的界面间隙[26]不同,后者是由内部铝核原子向氧化层扩散而形成的核-壳间结构间隙。表面热点理论有助于理解氧化膜极限厚度与氧气压力呈现强依赖性的实验现象[33],分子动力学结果表明,氧高压使得铝纳米颗粒表面吸附的氧分子数增加,进而使得热点数量增加,导致纳米颗粒表面空隙数量的提升,从而提高了氧化反应的速率和氧化膜的厚度;而当表面吸附的氧达到饱和时,热点数量也达到极限,最终氧化膜极限厚度也不再增加。
通过比较已有的研究结果,可以发现对于较大尺寸的铝颗粒,氧浓度改变影响的是表面氧化层的膜厚及其生长速率,但在内在氧化机理上并没有发生改变,为壳式氧化机制;而对于更小粒径的铝纳米颗粒,其氧化行为随氧浓度不同表现得十分复杂,随氧浓度的提高颗粒表面逐渐从壳式氧化机制过渡为链式氧化机制,乃至氧化链快速断裂而直接形成氧化团簇[31]。这些分子动力学的研究结论与Overdeep K R 等[34]在实验中所观察到的现象十分吻合,后者发现对于1.8 nm的铝纳米颗粒,在与一定浓度氧气接触后直接汽化消失(无固体残留),而粒径处于4~10 nm 时,生成的是氧化膜覆盖的铝纳米颗粒。

图5 不同温度和氧浓度产生的聚集体的氧化差异(a)[30];铝纳米颗粒的链式氧化过程(蓝色和红色的原子分别代表铝原子和氧原子)(b)[31]Fig.5 Oxidation differences of aggregates produced by different temperatures and oxygen concentrations(a)[30];Chain oxidation process of aluminum nanoparticles(Blue and red atoms represent Al and O atoms)(b)[31]
因此,要充分理解氧浓度对铝颗粒氧化行为的影响,必须考虑铝颗粒本身的尺寸效应,粒径和环境氧浓度共同构成铝颗粒氧化机理的内部和外部条件。
3.1.5 温度的影响
温度是影响铝粉氧化动力学的关键参量,对铝-氧气反应体系而言,环境温度的变化直接影响活性原子的占比,且随着温度的提高,铝颗粒本身还会发生固-液相变乃至汽化等状态改变,此外颗粒表面的氧化壳层也会随温度发生一定程度的结构变化,这些因素都可能显著影响微纳铝粉的氧化动力学过程。
分子动力学模拟为认识铝颗粒在不同温度下的结构演化规律提供了有力手段。研究发现[35],铝纳米颗粒在温度升高的条件下先后经历了预热、熔化、铝核快速氧化和氧化层继续氧化四个过程,这些过程均伴随着颗粒晶体结构和原子分布的剧烈变化。如图6 所示,温度的提高首先激发热铝原子逐渐向外扩散进入氧化壳层,随着温度的提高,铝核开始从核-壳界面熔化;而当熔化结束时,壳层中的氧原子和核铝原子在界面周围发生强烈反应,导致铝核快速氧化;在铝核完全氧化后,氧化物壳中的铝原子还将继续和周围的氧原子反应。Lee D[36]和Tang Y 等[30]曾开展了铝粉氧化特性随温度变化的实验研究,并基于实验结果分别提出了熔体分散机制(Melt vapor dispersion mechanism,MDM)或熔体/蒸汽分散机制(Melt/vapor dispersion mechanism,MVDM)机制。MDM 机制是指铝核随温度的升高发生快速熔化和膨胀,破坏了固体氧化物外壳,从而发生微爆炸行为;而若温度在短时间内提高至铝核沸点,铝蒸汽会冲破氧化膜,从而发生爆炸,此时应力的产生是由于铝核的汽化而非熔化,因此称为MVDM 机制。显然,无论是MDM 机制还是MVDM 机制,其关于氧化阶段随温度改变的基本假设与分子动力学的研究结论是一致的,分子动力模拟为这两类机制的合理性提供了一定的理论证据。
此外,若考虑氧化壳层随温度的结构演化,则温度对铝颗粒整体氧化过程的影响就更为复杂。实验结果表明[37],氧化壳层随温度经历了从非晶态-晶态转变、晶型相变以及破裂等一系列过程,这些结构相变直接影响铝颗粒表现出的氧化行为。但是,目前尚未见针对氧化层复杂的相变问题开展“温度-氧化层结构-铝氧化动力学相关性”的理论研究。因此,以分子动力学为手段,开展氧化层相变对铝颗粒全结构-全过程的氧化行为影响,对于理解更接近真实状态的铝颗粒氧化动力学过程具有重要意义。
应当指出的是,影响微纳米铝粉在氧气中反应的因素是多方面的,既与铝粉本身的颗粒聚集状态、粒径、氧化层结晶性等内在因素有关,又与外部环境的温度、氧浓度等条件密切相关。在机制上,不同研究者提出了热点机制、链式氧化机制、原子扩散机制和Janus氧化机制等,这些机制对于理解微纳米铝与氧气反应的内在机理具有重要意义,有助于解释其在不同条件下表现出的各种反应行为。在未来的研究中,有必要进一步将粒径、氧化壳层、温度、氧浓度等因素纳入综合考虑,通过建立更完善、更合理的分子动力学模型,探究多因素作用下铝粉氧化失活的微观机制及规律。
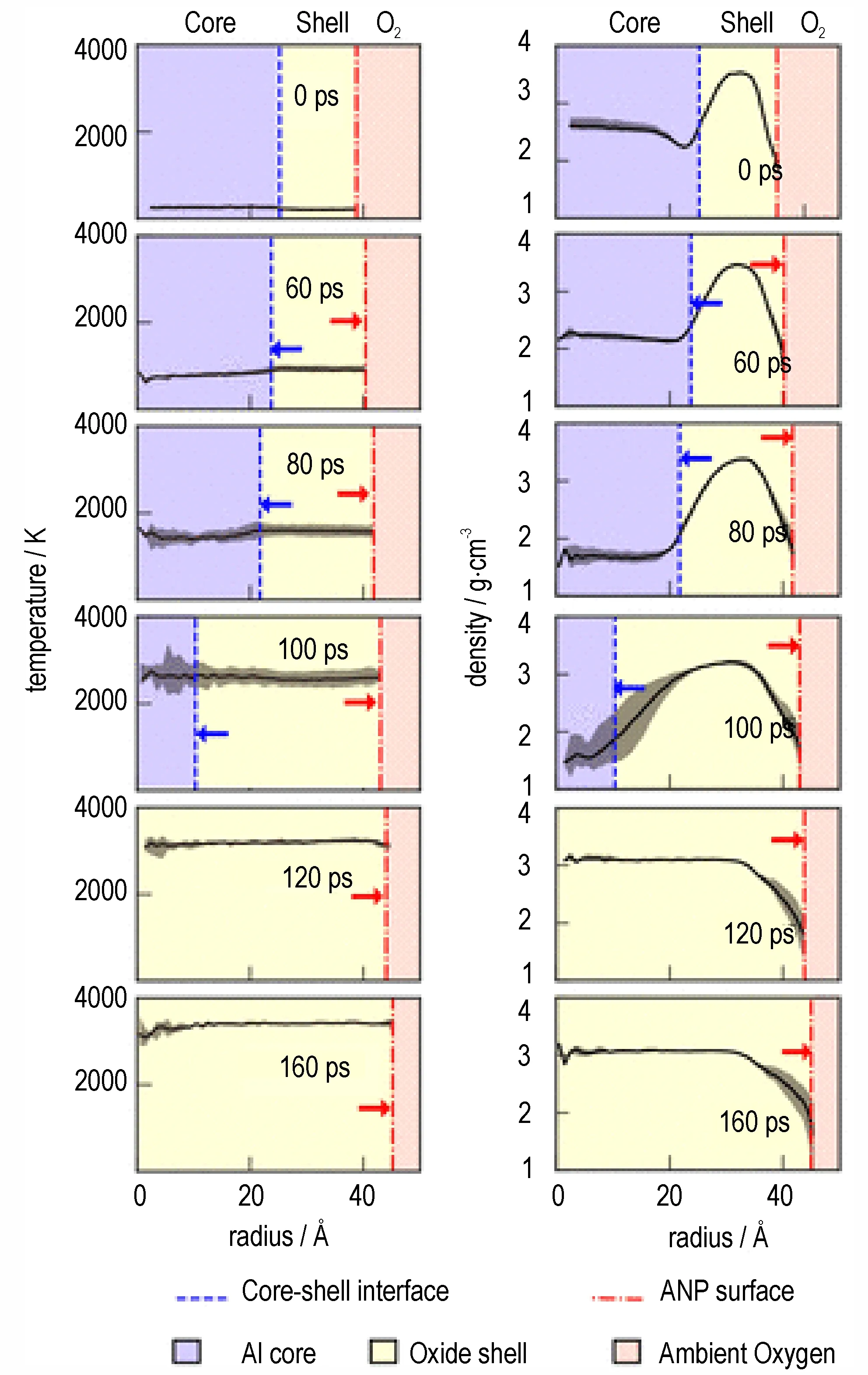
图6 铝纳米颗粒温度的径向分布(左)和密度的径向分布(右)[35](蓝色、黄色和红色分别代表铝核、氧化壳和环境氧区域。蓝色虚线表示核-壳界面的位置,虚线表示ANP(铝纳米粒子,Aluminum nano particle)曲面的位置。箭头表示核-壳界面和ANP 表面的运动方向)Fig.6 Radial distributions of aluminum nano particle temperature(left)and density(right)[35](The blue,yellow and red colors represent the Al core,oxide shell and ambient oxygen regions,respectively. The blue dash lines indicate the positions of core-shell interface,while the dash-dot lines represent the positions of ANP(Aluminum nano particle)surface. The arrows show the moving directions of core-shell interface and ANP surface
3.2 铝-氧反应体系的反应动力学
反应动力学研究的重要目标在于建立特定化学反应的反应速率-温度-时间之间的关系,并基于反应动力学模型开展对整体反应过程的定量研究。一般而言,分子动力学侧重于从分子或原子尺度理解化学反应的微观机理,而反应动力学是面向整个化学反应进程,研究其在不同温度、时间条件下的反应深度和反应速率问题。

反应动力学计算结果表明:1#(1 μm)、2#(13 μm)、3#(25 μm)的 表 观 活 化 能 分 别 为136.54×103,153.40×103,162.0×103J·mol-1。可见,粒径越小的铝粉,在相同的条件下越容易进行氧化反应。
此外,不同粒度的铝粉的表观活化能随氧化层厚度的变化而变化[39],当氧化层厚度由2.5 nm 增加至3.4 nm,活化能由~100 kJ·mol-1快速增加到~150 kJ·mol-1,并稳定在155 kJ·mol-1左右。活化能的变化可以用下面的函数(5)很好地描述:

式中,Eamorph是非晶氧化物生长时的表观活化能,kJ·mol-1;h 为氧化层厚度,nm。
在反应动力学方面,针对铝-氧反应体系的相关研究仍然不多,这可能是因为铝粉表面在氧气中的初始氧化是一个极快速的过程,而当形成致密氧化膜后,铝粉的继续氧化又成为一个非常缓慢的过程,这两个反应过程的信号都很难通过实验技术精确地捕捉或追踪,同时影响氧化失活因素的复杂性,进一步增加了通过反应动力学来量化氧化失活进程的难度。因此,在未来的研究中,应该考虑发展能够精确测定铝-氧反应体系反应进程的实验技术,为建立合理的反应动力学模型提供数据基础,这对铝-氧反应体系的定量化认识以及反应进程(如氧化失活程度)的预测等都具有重要的价值。
4 铝-水反应体系
铝-水反应体系也是一种常见的铝氧化体系,铝-水反应不仅是铝粉失活的重要原因之一,也是制取清洁能源氢气的潜在技术手段[7-9],同时铝粉的受潮积热也是导致其发生火灾、爆炸等意外事故的重要起因[38,40],因此铝-水反应体系也受到了研究者的高度关注。目前,针对铝-水反应体系的研究主要集中于建立铝粉-液态水之间的反应动力学,而揭示其原子或分子尺度微观反应机制的分子动力学研究还相对较少,在研究的系统性上不及铝-氧反应体系。
4.1 铝-水反应体系的分子动力学
与铝-氧反应体系类似,研究者首先关心的是铝粉自身特性是否会对其与水的反应机制产生影响,包括铝颗粒的粒径、表面氧化层厚度等。
Dong R K 等[41]通过建立不同粒径和氧化层厚度的铝纳米颗粒模型,研究了粒径和表面氧化层对铝-水反应机理的影响,发现粒径改变对反应途径的影响不大,仅影响物质扩散和消耗的快慢;而表面氧化层将明显阻碍铝-水反应过程的物质传递过程。图7a 为Al531/H2O 和Al531O226/H2O 系统的分子动力学模拟快照,在反应初期,Al531颗粒相较于Al531O226明显膨胀并在表面形成Al─H 和Al─O 键,这是由于Al531颗粒表面没有氧化层,H 和O 可以很快进入内部进行反应;随着反应的进行,二者内部均形成大量Al─H 和Al─O 键,但至反应结束时仅有氧化铝这一种产物,这意味着Al─H键(主要以AlH3形式存在)是反应中间产物。此外,通过分析Al531/H2O 和Al531O226/H2O 系统反应初期的温度分布,可以发现两者的反应机制有明显差异(图7b),Al531从表面开始升温,说明在反应初期Al531首先是表面Al 原子与H2O 发生反应,而Al531O226是从内部开始升温,同时在Al531O226内部并未发现H 原子,表明在反应初期Al531O226中的反应热量主要来自内部Al 原子与氧化层之间的化学反应。
铝-水反应体系的生成物之一是氢气(H2),由于氢气中的H 原子只能来自水分子(H2O),而水分子在常态下十分稳定,因此氢原子要从水分子中解离形成H2,必须要降低活化能使反应更容易发生。分子动力学模拟揭示了一种低活化能的反应机制[42]:在铝颗粒表面存在路易斯酸性和碱性位点,能够催化水分子的解离反应,同时这一反应过程需借助水分子之间的质子快速运输。具体而言,质子运输可以通过多个相连的水分子之间的氢键链进行,当质子或带有质子的基团靠近水分子氢键链的一端时,将诱导水分子发生旋转,使共价键和氢键交替变化,从而实现质子在氢键链内 部 的 迁 移,这 一 机 制 被 称 为Grotthuss 机 制[43-44]。图7c 展示了Al17与水分子发生反应的典型过程:首先,水分子中的氧原子(O)与具有Lewis 酸性特征的Al 原子键合形成氢氧根离子(OH-),这增强了周围Al原子的Lewis 碱性特征;同时,解离出的H 离子(H+,即质子)可通过Grotthuss 机制在水分子形成的氢键链中发生快速迁移,并在Lewis 碱性的Al 位点形成氢原子。在这个过程中,Grotthuss 机制大大降低了水分子解离的活化能,最终Lewis 碱性Al 位点的氢原子结合形成氢分子,而生成的氢氧根离子具有很强的路易斯碱性,可通过Grotthuss 机制再次形成吸附水分子,并作为继续产生氢气的催化活性位点。
除通过Grotthuss 机制降低反应活化能外,相邻非吸附(游离态)水分子的辅助解离同样能使活化能降低[45]。如图7d 所示,首先游离的水分子通过Al─O键吸附于Al 颗粒表面,形成吸附水分子;然后另一游离态水分子通过氢键与吸附水分子结合,在夺取吸附水分子的H 后形成游离的H3O+并在Al 表面的留下OH-(A 和B),OH-将从铝表面顶部位置移动到桥连位置(C);此后,由于H3O+不稳定,氢原子将从H3O+中转移到铝表面空位的供氢过渡态(D),形成吸附态氢原子(E)和一个恢复游离态的水分子;吸附态氢原子可从顶部位置移动到桥连位置,经两两结合后形成氢分子,而游离水分子可以吸附到Al 颗粒表面或者重新协助另一吸附水分子发生解离(F 和G)。可以发现,这一机制与Grotthuss 机制存在一定差异,主要区别在于前者认为可借助游离态水分子实现对吸附水分子的辅助解离,而不需要连续的氢键链(Grotthuss 机制)对质子进行传递。
相对于铝-氧反应体系,面向铝-水反应体系的分子动力学模拟研究仍不多,且不同研究工作所得出的结论也有所差异,即使在最简化模型的基础上所提出的动力学机制也各不相同,这说明铝-水反应的微观机制仍值得继续深入探讨。此外,目前尚未见从分子动力学角度讨论不同因素对铝-水反应机制或过程的影响,如铝颗粒的晶面取向、氧化层结晶性等参量,实验研究也表明[46],氧化层在水分子作用下的水化反应对铝粉氧化过程的诱导期具有重要影响。从铝-氧反应体系的研究来看,环境温度、水分子浓度、水的状态(液态或气态)等都可能显著改变铝颗粒的氧化动力学机理。因此,有必要持续推进铝粉在水作用下的氧化反应机理研究,在阐明其内在机制的基础上,进一步考虑不同结构参量及环境因素的影响规律,建立多影响因素的分子动力学模型,以期实现对复杂条件下铝-水反应机制的深入理解。
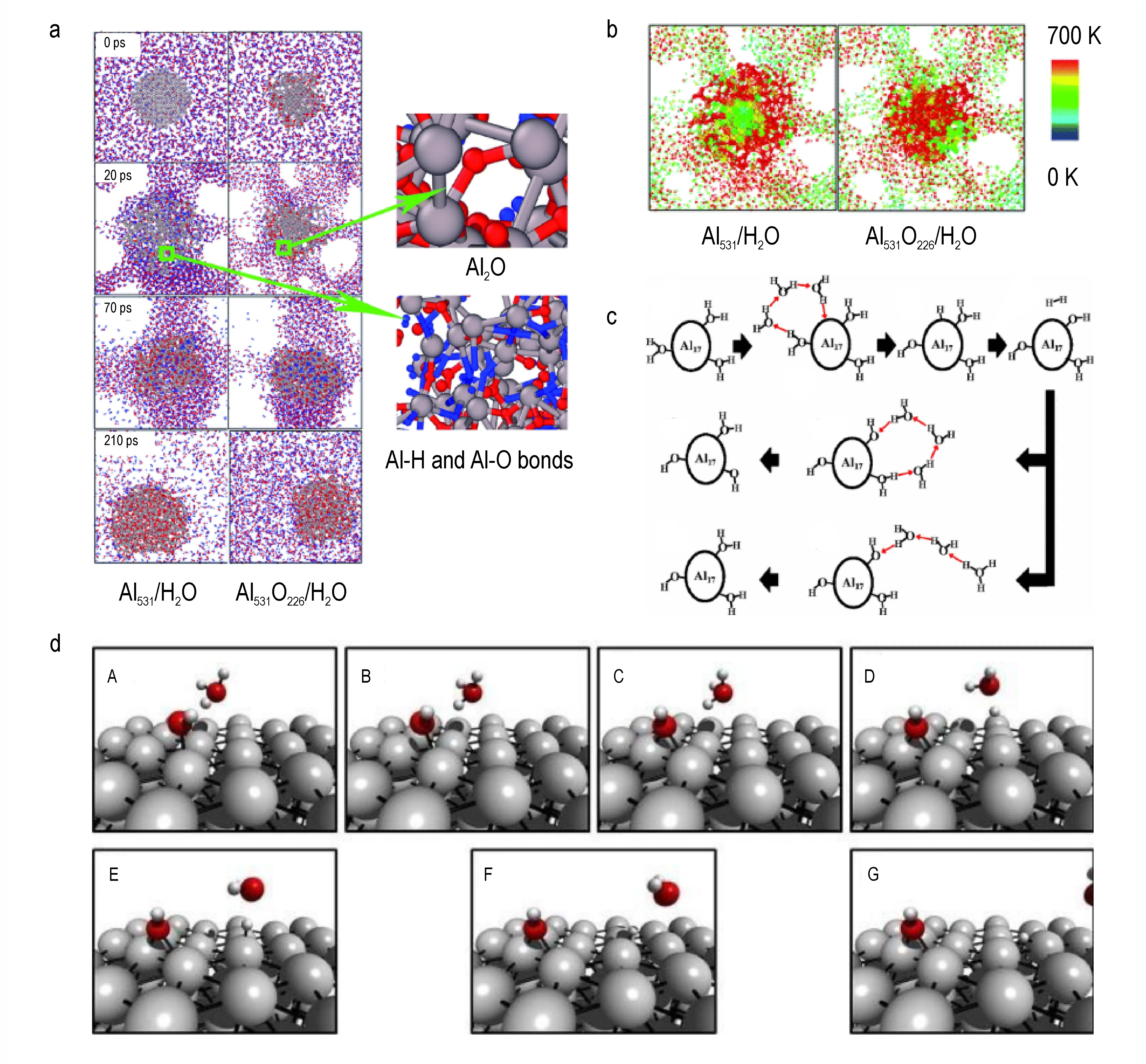
图7 Al531 /H2O 和Al531O226 /H2O 随时间的快照(Al 灰色,O 红色,H 蓝色(a)[41];Al531 /H2O 和Al531O226 /H2O 系统在20 ps 时的温度分布(b)[41];铝团簇上反应过程的示意图(c)[42];快照说明了在Al(111)表面观察到的辅助解离机制(d)[45])Fig. 7 The snapshots of Al531 /H2O and Al531O226 /H2O over time.(Al in gray,O in red and H in blue(a)[41];Temperature distributions of Al531 /H2O and Al531O226 /H2O systems at 20 ps(b)[41];Schematic diagram of reaction processes on an Al cluster(c)[42];Snapshots illustrating the assisted dissociation mechanism observed on an Al(111)surface(d)[45])
4.2 铝-水反应体系的反应动力学
铝-水反应产生的氢气是一种重要的清洁能源,有研究者认为这是一种有潜力的制氢工艺路径[7-9],从而提出通过优化反应体系和控制反应条件,实现高效的铝-水反应产氢。为此,有必要通过建立其反应动力学模型,实现对铝-水反应进程的定量化和模型化认识,从而对该反应进行合理设计和有效控制。
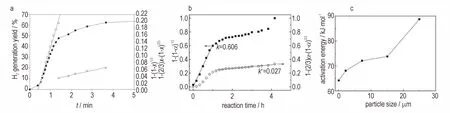
目前,针对铝-水体系反应动力学的研究主要以微纳米铝粉-液态水为对象,以量气法或量热法为实验手段,通过获取气体产物(氢气)的体积及生成速率、反应放热速率等数据,建立反应动力学模型,并结合动力学模型的形式和参数对反应机制进行推断。Saceleanu F 等[47]采用等温和非等温量热法确定了反应机理的决速步及相应的活化能,发现了微/纳米铝粉-液态水反应均存在两个连续的反应阶段,并且可以用两个模型来分别描述反应的两个阶段,即JMAK 成核-生长模型和恒定核生长power law 模型。其中,JMAK 模型可表达为式(6):

式中,g(α)为机理函数;α 为反应进程,由实验数据确定;m 是在界面受到限制时描述成核与生长的参数,其数值定义了新相生长的几何约束。
而power law 模型可以表示为式(7):

表1 为40 nm Al 和1 μm Al 与水反应的成核和生长两个反应阶段所对应的表观活化能Ea和参数m。可以看到,反应之初m>3,意味着氢氧化铝的无规则成核和三维方向上的生长同时发生;随着反应的进行,由于固态产物量的增多和聚集状态改变,会对后续成核和生长产生一定的空间阻碍,将其限制为一维和二维过程(1 表1 40 nm Al 和1 μm Al 的Al/水反应机理的速率控制步骤和活化能以及成核和生长参数[47]Table 1 Rate-controlling steps,the activation energies and the nucleation and growth parameter of the Al/water reaction mechanism for 40 nm Al and 1 μm Al[47] 除了上述JMAK 模型和power law 模型外,有研究者根据非均相反应的经典模型对铝-水反应动力学进行描述[48],分别用式(8)和式(9)表示化学反应控制和传质控制步骤: 式中,x 是反应程度;kex是速率常数。 通过拟合发现前一阶段符合化学反应控制假设,而后一阶段符合传质扩散控制假设(见图8a),Gai W Z 等[50]在研究铝水反应在常温下制氢过程也发现了这样的两个阶段(见图8b)。 可见,无论使用何种动力学模型来描述铝-水反应,目前的研究均将反应过程分为了两个相对独立的阶段,分别是由表面化学反应控制的第一阶段和由物质扩散控制的第二阶段。在第一阶段,由于铝和水直接接触,反应能顺利进行;随着反应的进行,铝表面逐渐生成了氢氧化铝等产物,水分子等物质必须经副产物层向内进行扩散以实现进一步反应,即为第二阶段。需要指出的是,尽管将铝-水反应拆分成为上述两个独立阶段有助于理解反应进程的差异性,但笔者认为仍有不合理之处,这是由于只有当铝粉表面与水发生初始反应且副产物还未成核时,才属于由化学反应机制单独控制的阶段,而一旦氢氧化铝等产物形成并生长,则物质扩散机制就开始起作用,此时反应过程应同时包括化学反应机制和物质扩散机制,只是随着反应的进行不同机制所占的比重不同。因此,一个合理的反应动力学模型应该是两个机制的动态叠加,而不是从时间尺度上人为地进行拆分。 针对铝-水反应体系的其他研究表明,影响铝-水反应动力学的因素较多,如反应诱导时间与铝粉颗粒的直径成正比[51],反应活化能随粒径增加而增大(见图8c)[50];而催化剂[43,52-53]和铝的合金化[54]均能明显降低反应活化能。常见的催化剂有酸、碱和盐类物质,通 过 比 较 盐 酸(HCl)、硫 酸(H2SO4)和 氢 氧 化 钠(NaOH)溶液为反应环境的动力学参数[52],证明铝粉在H2SO4溶液中的反应活化能最低,而在NaOH 溶液中的反应活化能最高,且NaOH 溶液的反应活化能要高于KOH 溶液[43]。另外,纳米铝粉与NaCl 溶液和水的反应动力学也有明显差异[53],NaCl增大了铝-水反应的接触面积,提高反应速率并缩短诱导期,Al/NaCl/H2O的反应活化能为21.0 kJ·mol-1,而Al/H2O 反应活化能为54.7 kJ·mol-1。值得注意的是,研究表明Al(OH)3也具有一定的催化活性[55],表2 列出了铝/水在有催化剂和无催化剂条件下的反应活化能,可以看到Al(OH)3使活化能较大幅度降低,有效提高铝-水反应速率。 图8 通过由化学步骤(−□−)控制的异相动力学模型和产物层(−△−)中受控的质量转移,拟合使用0.05 M Na2SnO3获得的实验数据(−●−)(a)[54];通过表面化学反应(−−)和H2O通过副产物层(−○−)扩散控制的收缩核模型拟合实验数据,以在40 ℃下反应98.38 nm Al粉与水,反应器中的初始压力为1 bar(b)[57];不同粒度的铝粉与水反应的活化能,其中反应器的初始压力为1 bar(c)[57]Fig.8 Fitting of the experimental data(−●−)obtained using 0.05 M Na2SnO3 by heterogeneous kinetic models controlled by a chemical step(−□−)and controlled mass transfer in the product layer(−△−)(a)[54];Fitting of the experimental data by the shrinking core model controlled by the surface chemical reaction(−−)and the H2O diffusion through byproduct layer(−○−)for the reaction of 98.38 nm Al powder with water at 40 ℃,where the initial pressure in the reactor is 1 bar(b)[57];Activation energy for the reaction of different particle-sized Al powders with water,where the initial pressure in the reactor is 1 bar(c)[57] 表2 铝/水在有催化剂和无催化剂条件下的反应活化能[55]Table 2 The activation energy of Al/water reaction with and without the catalyst[55] 综上所述,针对铝-水反应的研究主要集中在如何控制产氢速率并实现高效制氢,因此反应动力学研究面向的是微纳米铝粉-液态水反应体系。但从铝粉老化失活的角度,铝粉除可以被空气中的氧气氧化之外,与空气中水分之间的反应也是其失活的重要原因之一[56],而微纳米铝粉-气态水的反应动力学研究仍未见报道,在气态水(湿度)条件下铝粉氧化失活的定量描述乃至预测依然缺失。从研究手段上看,开展铝粉-气态水反应体系研究的困难可能包括有以下方面:首先,气态水与铝粉之间反应过程较为缓慢,反应速率变化的特征信号比较微弱,不容易实现实时捕获;此外,由于气态水本身参与反应,导致在铝-液态水反应研究中常用的量气法难以作为有效的表征手段。为此,应考虑从其他信号入手,如反应热、生成物的质量等,借助高精度的原位量热、量重等手段,从热量、重量等角度获取铝-气态水反应进程的实时信息,进而为建立铝-气态水的反应动力学模型提供支撑。 除了上述两种最常见的体系,在一些条件下,铝粉还可以和其他氧化剂发生反应,如二氧化碳(CO2)、氮气(N2)等。目前,这类反应体系的相关研究还较少,仅开展了一些初步的机理和反应动力学研究工作。 在Al-CO2反应体系中,Al 与CO2反应首先生成Al3C3、Al2OC、Al4O4C 等中间体,随着温度的升高,这些中间体继续与CO2反应生成稳定的α-Al2O3和CO等物质[57]。Zhu X Y 等[58]采用热重法(TG),对微米级铝粉在CO2和CO2/O2混合氧化剂中的氧化动力学进行了研究,发现在CO2中的氧化过程与在O2大体上一致,但CO2能更好保持中间产物θ-Al2O3的稳定性。铝粉质量随温度的变化速率可写为式(12): 其中,CA*是氧化常数;rAl和rox分别是铝核和氧化壳的半径,μm。根据式(12)获得反应活化能E,表3 比较了铝粉在O2和CO2两种不同氧化剂中各个阶段的反应活化能,可以看出θ-Al2O3在CO2中明显更加稳定。 表3 铝在不同氧化剂中氧化的活化能[58]Table 3 Activation energy of aluminum oxidation in different oxidants[58] kJ·mol-1 此外,Zhu B Z 等[59]研究了纳米铝粉在CO2中的氧化动力学,得出纳米铝粉两个氧化阶段的活化能,第一 阶 段 为147.48~286.53 kJ·mol-1,平 均 活 化 能 为206.38 kJ·mol-1;第二阶段为275.75~346.16 kJ·mol-1,平均活化能为305.76 kJ·mol-1。通过Coats-Redfern法进行线性拟合,最终确定了两个阶段的机理函数,第一个阶段的机理函数为式(13): 针对纳米铝粉在氮气中的反应动力学,张丁成等[60]通过5 种积分法和一种微分法对数据进行处理,获得了纳米铝粉非等温氮化反应的表观活化能和指前因子分别为111.7 kJ·mol-1和103.46 s-1。 固体推进剂在燃烧时的主要气体产物为水蒸气和CO2,并伴随着空气中N2的氧化作用,因此研究者越来越重视铝粉在CO2、N2等气氛下的反应动力学行为研究,以了解铝粉在真实反应环境中的燃烧释能特性。未来,可借鉴在铝-氧、铝-水反应体系中应用的技术手段、研究方法和氧化机制,开展铝-其他氧化物反应体系的分子动力学及反应动力学研究,而这些认识将有助于对CO2、N2等气氛对微纳铝粉氧化行为的理解和控制。 分子动力学和反应动力学的发展为深入理解微纳铝粉的氧化行为提供了重要的方法和手段,目前已获得许多重要的结论和认识,如针对铝-氧气反应体系提出了Mott 电势机制、表面热点理论、壳式-链式氧化转变理论和原子扩散机制等,讨论了不同因素对铝颗粒氧化动力学的影响规律,对实现微纳铝粉的优化设计、高效燃烧及预防氧化失活等具有重要价值;针对铝-水反应体系提出了路易斯酸碱位点、游离水分子辅助解离等催化反应机制,并解决了铝-液态水反应进程的模型化问题,对该反应的合理设计和高效制氢等具有指导意义。而对于铝-二氧化碳、铝-氮气等反应体系,目前的研究工作主要为初步的反应动力学研究,目的在于获取反应的基本动力学参数。 然而,面向微纳铝粉的氧化动力学行为,笔者认为仍有许多尚待解决的问题,需要通过进一步地深化和完善分子动力学和反应动力学研究予以回答,主要包括以下几个方面: (1)针对铝-氧反应体系,由于影响微纳铝粉氧化动力学的因素是多方面的,既与微纳铝粉本身的结构参量有关,又与外部环境密切相关。因此,有必要将不同影响因素纳入综合考虑,探究多因素作用下铝粉氧化失活的微观机制及规律。此外,针对铝-氧体系的反应动力学研究相对较少,阻碍了对铝粉失活过程的定量认识。为此,应发展可准确测定铝-氧反应体系反应信号的实验技术,为建立合理的反应动力学模型提供数据基础,进而推动对铝-氧反应体系的定量化认识和反应进程(如氧化失活程度)的预测。 (2)针对铝-水反应体系,不同研究者对于水分子在铝颗粒表面发生解离的微观机理还存在争议,相关研究仍值得持续深入。在反应动力学方面,现有工作主要以铝粉-液态水反应为对象,以高效制氢为目的,但从铝粉老化失活的角度,铝粉与气态水之间的反应是其失活乃至受潮积热的重要原因,而其反应动力学研究仍未见报道。因此,开展在气态水(湿度)中铝粉的氧化反应动力学研究,将为铝粉在湿度条件下的氧化失活预测、防止积热失控等提供重要支撑。此外,目前的研究将铝-水反应过程分为了两个相对独立的阶段,即化学反应控制的第一阶段和物质扩散控制的第二阶段,与实际过程不符,而建立包含两种机制动态叠加的反应动力学模型,将是准确描述该反应进程的必然要求。同时,反应动力学模型的价值不仅在于对已有反应的定量描述,更为重要的是基于反应速率-温度-时间关系,结合环境边界和约束条件,可以预测更复杂条件下的反应进程,这也将是铝-水反应体系未来研究的重要方面。 (3)铝粉与其他氧化剂(如二氧化碳、氮气等)反应体系的相关研究还较少,目前仅开展了初步的反应动力学研究工作,随着铝粉应用场景的复杂化和氧化条件的多样性,研究者应更加重视相关的分子动力学和反应动力学研究,以期实现对铝粉氧化动力学机制的正确理解与有效预测。 总之,微纳米铝粉在不同氧化剂条件下的氧化是一个长期存在并亟待解决的问题,微纳米铝粉在不同氧化剂中的微观反应机制以及对反应进程的定量描述,一直是金属防护领域关注的核心问题,也是含能材料乃至新能源领域重点关注的问题。基于分子动力学和反应动力学对铝粉氧化反应进行研究,有利于人们从微观机制和量化评估两方面深刻把握铝粉在多因素作用下的氧化动力学规律,对于铝粉在生产、储存、运输和使用过程中减少能量损耗具有指导意义。


5 铝-其他氧化物反应体系



6 总结与展望
