环境、茎段状态与无糖培养基对葡萄试管苗生根的影响
2021-04-06董媛媛柴慈江夏瑞黄洁萍岑芬
董媛媛,柴慈江,夏瑞,黄洁萍,岑芬
环境、茎段状态与无糖培养基对葡萄试管苗生根的影响
董媛媛,柴慈江通信作者,夏瑞,黄洁萍,岑芬
(天津农学院 园艺园林学院,天津 300392)
本项研究旨在完善葡萄试管苗土壤支撑生根培养技术。分别对使用含糖与否的培养基、接种两种状态的试管苗茎段及两种培养环境进行了试验。结果表明:在不含糖的培养基中试管苗根长与茎长显著高于含糖培养基,茎段枯死率和叶片变色率显著低于含糖培养基;接种新壮茎段试管苗的生根率、根长、茎长及叶数均显著高于老弱茎段;6月份露地环境中培养的试管苗生根率及茎长与培养室环境无显著差异,且生根率达到92.5%。在‘玫瑰香’葡萄试管苗的土壤支撑生根培养中,以使用不含糖培养基和接种新壮茎段为宜,6月份可在露地环境中培养。
葡萄;蔗糖;茎段;露地;瓶内生根
生根是葡萄组织培养快繁技术的关键环节之一。试管苗的生根方法一般可分为试管内生根和试管外生根两种方式。葡萄试管苗的试管内生根通常使用琼脂固化的培养基[1-8]。在琼脂培养基中生根的葡萄试管苗一般根系吸收功能较差、移栽不容易成活,而且由于琼脂价格昂贵而导致试管苗培养成本增加。柴慈江等以巨峰葡萄试管苗为试材,研究提出了葡萄试管苗的土壤支撑生根培养与带坨移栽技术,该项研究为降低葡萄试管苗培养成本及简化试管苗移栽程序提供了一条新途径[9]。本研究在土壤支撑培养基条件下,探讨无糖培养基、茎段状态及露地环境对葡萄试管苗生根培养的影响,以完善葡萄试管苗土壤支撑生根培养技术,进一步降低试管苗成本,促进组培快繁技术在葡萄良种快繁和无病毒苗木生产中的应用。
1 材料与方法
1.1 试验材料
以不含植物激素的GS培养基中继代培养的‘玫瑰香’葡萄(‘Muscat Hamburg’)试管苗为试材。生根培养基配制用土取自天津农学院校内地被植物园,为黏壤土,风干后过1 mm筛备用,所用蛭石购自花卉市场,同样过1 mm筛备用。
1.2 试验方法
1.2.1 培养基中糖含量影响葡萄试管苗生长的研究
本试验设含糖培养基和不含糖培养基两个处理,以探讨培养基中糖含量对葡萄试管苗生根的影响。
含糖培养基配制:将黏壤土与蛭石按照1︰1的体积比混和均匀,用作培养基的土壤支撑物。在200 mL方形PC瓶中加入土壤支撑物100 mL,再加入60 mL含糖培养液,含糖培养液为含有15 g/L蔗糖和0.2 mg/L IBA的蒸馏水。培养瓶封口后在121 ℃下灭菌20 min。
不含糖培养基配制:除了在培养瓶中加入不含糖培养液60 mL外,其余的配制及灭菌方法均与含糖培养基相同。不含糖培养液的成分为含有0.2 mg/L IBA的蒸馏水。
将‘玫瑰香’葡萄试管苗剪成单节茎段,分别接种到上述两种培养基中,每处理接种5瓶,每瓶接种8个茎段,每处理共接种40个茎段。接种后将培养瓶置于培养室中培养。培养室温度保持在22~27 ℃,光照强度为1 800~2 000 lx,光照时间为14 h/d。
培养30 d后,调查两个处理试管苗的生根率、根长及茎长等指标,对生根率用卡平方法进行独立性测验,其他各项指标均按照完全随机试验单向分组资料进行方差分析。
1.2.2 接种茎段状态影响葡萄试管苗生长的研究
本试验将接种茎段分为新壮茎段和老弱茎段的两个处理。
新壮茎段:继代培养25~40 d,茎叶颜色翠绿,茎较粗,节间较长。
老弱茎段:继代培养50 d以上,茎叶颜色浅绿,茎段节上有红晕,茎较细,节间较短。
选用不含糖培养基,不含糖培养基的配制及灭菌与上述试验1.2.1相同。将新壮茎段和老弱茎段分别接种在不含糖培养基中,每个处理5瓶,共接种40个茎段,接种的茎段均为双节。接种完毕后置于培养室培养,培养条件同上述试验1.2.1,培养30 d后,统计两个处理试管苗的生根率、根长、新生茎长、茎段枯死率和变色叶片数等指标,生根率用卡平方法做独立性测验,其他各项指标均按照完全随机试验单向分组资料进行方差分析。
1.2.3 培养环境影响葡萄试管苗生长的研究
本试验主要探讨露地环境对葡萄试管苗瓶内生根培养的影响。将葡萄试管苗新壮茎段接种于不含糖培养基中,茎段选择标准同上述试验1.2.2,不含糖培养基配制同试验1.2.1。每瓶接种8个双节茎段。然后将培养瓶放在露地环境中培养,地点在天津农学院地被植物试验园的树冠阴影下,并在东西方向各竖立一层遮阳网,以防培养瓶受到阳光直射引起烧苗。放置之前在实验室将培养瓶顶部的透气孔用胶膜粘住,防止雨水进入污染茎段。培养期间,使用最高温度计记录培养瓶中的最高温度,每5 d一次,并在晴天的中午用照度计测定培养瓶上方的光照强度。培养30 d后调查试管苗生根率、根长、茎长和叶片数等指标,生根率及其他各项指标的分析方法同前。以接种新壮茎段于不含糖培养基中并且在培养室环境中培养的处理做对照。培养室环境的温度及光照条件同试验1.2.1。
2 结果与分析
2.1 培养基中糖含量对葡萄试管苗生根培养的影响
从表1可以看出,不含糖培养基处理的试管苗的生根率略高于含糖培养基处理,但两者差异不显著。不含糖培养基处理试管苗的根长则显著高于含糖培养基处理,这表明去除培养基蔗糖后,可明显促进葡萄试管苗根系的生长。
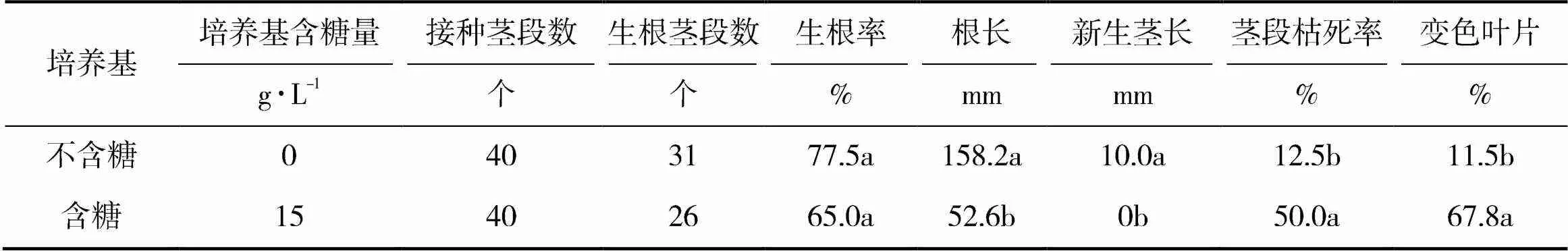
表1 葡萄土支撑培养基含糖量对葡萄试管苗生根培养的影响
注:表内数据后字母不同表示0.05水平差异显著。下同
从试管苗的地上部来看,不含糖培养基处理的新生茎长显著高于含糖培养基处理,含糖培养基处理接种的茎段枯死率高达50.0%,显著高于不含糖培养基处理,含糖培养基处理试管苗的叶片大部分变成黄色或红色,变色率达67.8%,显著高于不含糖处理。结果表明,去除培养基中蔗糖对葡萄试管苗地上部的生长更为有利。
综合上述,不含糖培养基处理可明显促进葡萄试管苗根系和茎的生长,并且有利于维持茎段存活和保持叶片活力。因此,在葡萄试管苗土壤支撑生根培养中,以去掉培养基中的蔗糖为宜,不仅有利于葡萄试管苗生长,而且可降低培养成本。图1为两种培养基中试管苗生长状况。
2.2 接种茎段状态对葡萄试管苗生长的影响
从表2可以看出,接种新壮茎段的葡萄试管苗的生根率、根长、新生茎长及叶数等指标均显著高于老弱茎段,茎段枯死率则显著低于老弱茎段处理,这一结果表明接种新壮茎段可明显促进葡萄试管苗根系发生、根系及茎叶的生长。因此,在葡萄试管苗土壤支撑生根培养中,应选择新壮茎段进行接种。
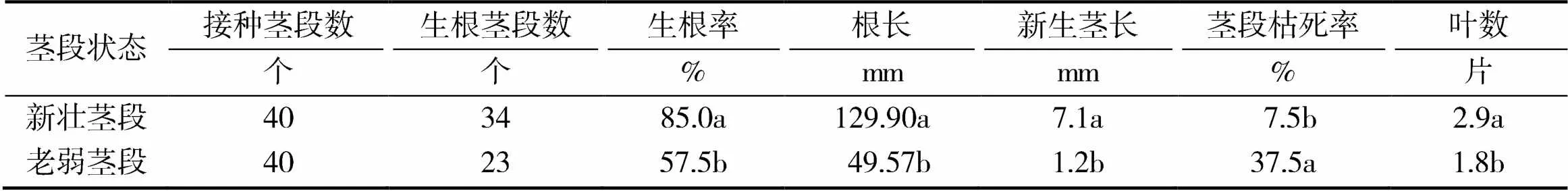
表2 接种茎段状态对葡萄试管苗生根培养的影响
接种两种茎段培养的葡萄试管苗生长状况见图2。
2.3 培养环境对葡萄试管苗生根培养的影响
由表3可知,露地培养环境下葡萄试管苗生根率为92.5%,略高于培养室环境,但两者差异不显著。露地环境下葡萄试管苗的新生茎长、总茎长等与培养室环境也无显著差异,而根长、叶数显著低于培养室环境。
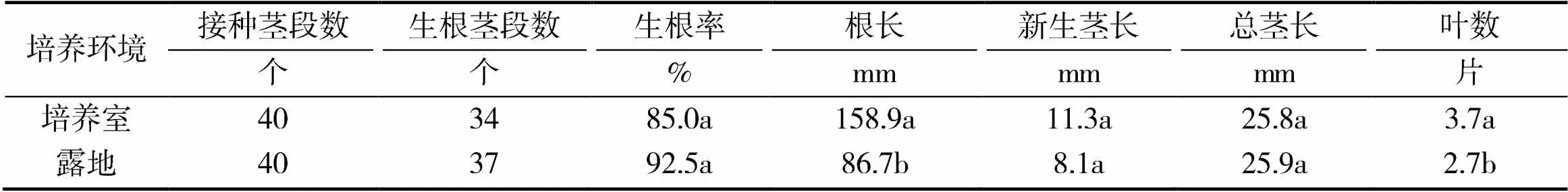
表3 培养环境对葡萄试管苗生根培养的影响
通过在培养期间对温度的测定结果可知(图3),露地环境中最低温度在18~23 ℃变化,与培养室比较接近。露地环境中的最高温度在32~35 ℃,个别日最高温度达到37 ℃,明显高于培养室环境。较高温度可能抑制了葡萄试管苗根系和地上部的生长,使得露地环境中培养的葡萄试管苗的根长和叶数显著低于培养室环境。
综上分析,露地环境中培养的葡萄试管苗虽然根长、叶数等指标明显低于培养室环境,但其生根率可达90.0%以上,与培养室环境无显著差异,茎长也与培养室环境无显著差异,因此,在6月份将葡萄试管苗的瓶内生根培养放在露地环境中进行,可进一步降低试管苗成本。
两种环境中培养的葡萄试管苗生长状况见 图4。
3 讨论与结论
葡萄试管苗在琼脂培养基生根培养时一般需要加入适当浓度的蔗糖[1-8]。蔗糖和琼脂的使用都会增大试管苗培养成本。同时,蔗糖的使用也是加剧污染发生的一个因素[10]。柴慈江等在矮溲疏试管苗的生根培养中,采用土壤支撑的培养基,并且去除培养基中的蔗糖,结果显示去除蔗糖后试管苗的生根率、根长及地上部生长指标与含有蔗糖的培养基无显著差异[11]。本项结果中,‘玫瑰香’葡萄试管苗在不含糖的土壤培养基中的生根培养效果明显优于含糖培养基。这与柴慈江等的研究结果基本一致。在含有15 g/L的土壤培养基中‘玫瑰香’葡萄试管苗茎段枯死率、叶片变色率显著高于不含蔗糖培养基,根长显著低于不含糖培养基,可能是在含糖培养基中,蔗糖增加了培养液的渗透压,与土壤黏粒引起的基质势共同作用,使培养基水势过度降低,造成茎段枯死、叶片变色,并抑制了根系生长。对此有待进一步研究。
葡萄试管苗的瓶内生根培养一般是在培养室进行,需要消耗大量电力以保证培养试管苗所需的光照和温度条件。黄立华对葡萄组培工厂化育苗成本进行了核算后认为,按照30 d为一个培养周期,每株试管苗在培养期间因为光照和空调降温所消耗的电费为0.166元,约为试管苗单株总成本的17%[12]。因此,减少培养期间的电力消耗,可明显降低试管苗的培养成本。柴慈江等将栒子试管苗的瓶内生根培养放在温室中进行,试管苗生根率达到98.1%,且移栽成活率显著高于培养室培养的试管苗[13]。韩会会等对无花果的研究取得了类似的结果[14]。这两项研究为降低试管苗培养期间的电力消耗提供了新方法。杨广艳等研究表明珠美海棠试管苗在露地环境中的瓶内生根培养效果与培养室及温室环境无显著差异[15],宋秋月等也认为露地环境中栒子试管苗的瓶内生根培养效果与培养室无明显区别,并认为4月下旬至7月初是栒子试管苗在露地环境中进行瓶内生根培养的适宜时期[16]。本项结果中,6月份将‘玫瑰香’葡萄试管苗在露地进行瓶内生根培养,生根率达92.5%,茎长与培养室无显著差异,与杨广艳和宋秋月等的研究基本一致。将试管苗的瓶内生根培养放在露地中进行,不仅可节省培养室的电力消耗,还可减少温室设施的使用,能够进一步降低试管苗成本。对此值得深入研究。
综合上述,在‘玫瑰香’葡萄试管苗的土壤支撑生根培养中,以使用不含糖培养基和接种新壮茎段为宜,并且在6月份可在露地环境中进行培养。本项结果可改进葡萄试管苗土壤支撑生根培养技术、降低成本,促进组培快繁技术在葡萄良种快繁及无病毒苗木生产中的应用。
[1] 齐向丽,师校欣,杜国强. ‘红国王’葡萄组织培养快速繁殖[J/OL]. 分子植物育种,http://kns.cnki.net/kcms/ detail/46.1068.S.20190327.1017.004.html.
[2] 蔡文博,段虹,王军,等. 4个鲜食葡萄品种组培快繁体系的建立[J]. 核农学报,2019,33(2):248-254.
[3] 徐美隆,刘静,王巧珍,等. 酿酒葡萄“赤霞珠”组织培养快繁技术优化[J]. 北方园艺,2016(2):117-120.
[4] 戴彩虹. 山葡萄组织培养与离体嫁接亲和性研究[D]. 兰州:甘肃农业大学,2014.
[5] 韩旭,武丽娟. 美国“红地球”葡萄无毒苗速繁技术研究[J]. 内蒙古林业科技,2012,38(3):25-28.
[6] 闵首军,李爱玲. 葡萄组织快繁技术研究[J]. 农学学报,2012,2(10):55-57.
[7] 冯发文,田群芳. 巨峰葡萄组织培养快繁技术研究[J]. 落叶果树,2011(2):6-8.
[8] 沈传进,王利民,张平,等. 鲜食葡萄组织培养快速繁育系统的建立[J]. 河北农业科学,2011,15(7):16-21.
[9] 柴慈江,严任玲,王震星,等. 葡萄试管苗土支撑培养带坨移栽研究[J]. 华北农学报,1995,10(1):116-119.
[10] 黄烈健,王鸿.林木植物组织培养及存在问题的研究进展[J]. 林业科学研究,2016,29(3):464-470.
[11] 柴慈江,汪强强,骆建霞,等. 矮溲疏试管苗的土壤支撑生根培养和带坨移栽[J]. 天津农学院学报,2014,21(4):22-25.
[12] 黄立华. 葡萄组培工厂化育苗成本核算[J]. 陕西林业科技,2014(3):65-69.
[13] 柴慈江,曹海鹏,王琼,等. 不同温室培养条件对栒子微枝试管内生根和成活的影响[J]. 天津农学院学报,2015,22(2):11-15.
[14] 韩会会,符玲巧,柴慈江,等. 温室培养条件对无花果微枝试管内生根与成活的影响[J]. 天津农学院学报,2016,23(1):23-27.
[15] 杨广艳,王坤英,柴慈江,等. 环境条件对珠美海棠微枝试管内生根与成活的影响[J]. 天津农学院学报2017,24(4):15-18.
[16] 宋秋月,韦绕培,柴慈江,等. 露地与培养室环境对栒子微枝试管内生根与成活的影响[J]. 天津农学院学报,2018,25(2):1-4.
Effects of environment, stem section state and sugar-free medium on rooting of grape plantletcultured in soil supporting medium
Dong Yuanyuan, Chai CijiangCorresponding Author, Xia Rui, Huang Jieping, Cen Fen
(College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300392, China)
This paper aimed at perfecting the technique of grape micro-shut rootingcultured in medium supported by soil. The experiments of using medium containing sucrose or not, inoculating stem section in two states and culturing in two environments have been done respectively. The results showed that the root length and the stem length of the plantlet cultured in medium without sucrose were obviously higher than that in medium containing sucrose, but the stem withered rate and the leaf color changing rate were obviously lower than that in medium containing sucrose. Rooting rate, the root length, the stem length and the leaf number of the younger stem section inoculated were obviously higher than that of the older stem section. With the rooting rate of 92.5%, the rooting rate and the stem length of the plantlet cultured in field environment in June were of no obvious difference compared with that of the plantlet cultured in incubation chamber. In rooting culture in soil supporting medium of ‘Muscat Hamburg’ grape plantlet in vitro, the medium without sucrose should be used and the younger stem section should be inoculated, and the rooting culture can be in progress in field environment in June.
grape; sucrose; stem section; field; rooting
S604.3;S723.123.6
A
1008-5394(2021)01-0017-04
10.19640/j.cnki.jtau.2021.01.004
2020-04-02
天津市林果现代农业产业技术体系创新团队项目(ITTFPRS2018002)
董媛媛(1998—),女,本科在读,主要从事园艺植物组织培养方面的研究。E-mail:18722323765@163.com。
柴慈江(1960—),男,教授,硕士,主要从事园艺植物组织培养方面的研究。E-mail:cijiang666@163.com。
责任编辑:杨霞
