基于质谱的蛋白质绝对定量研究策略和建议
2021-04-02沈枫林熊悦婷刘晓慧杨芃原
沈枫林,熊悦婷,刘晓慧,杨芃原
(复旦大学生物医学研究院,上海 200032)
准确检测与疾病发生发展相关的分子将有助于理解疾病的发病机制,找到与诊断、预后和治疗相关的生物标志物。蛋白质是基因表达产物,是生物体生命功能的执行者,是机体生理和病理状态的重要标志物,其表达变化可以直接反映机体的不同状态,有助于对疾病进行及时诊断和干预。Cohen等[1-2]研究表明,较之传统的基因检测,将蛋白质含量检测与基因检测相结合可以大大提高癌症(卵巢、肝、胃、胰腺、食道、结直肠、肺和乳腺)诊断的准确性。癌抗原125(cancer antigen 125,CA125)、转铁蛋白(transferrin)、载脂蛋白A-1(apolipoprotein A-1,APOA1)、促卵泡激素(follicle-stimulating hormone)、人附睾蛋白4(human epididymis protein 4)的组合(OVA1)在卵巢癌方面的诊断准确性达91.4%,优于临床使用的CA-125(65.7%),已被FDA批准作为卵巢癌诊断标志物[3]。近年来,随着基于质谱法的蛋白质组学的发展,已发现大量与疾病相关的潜在生物标志物[4-6],这些潜在生物标志物需要经过多中心的临床病例验证和确证才有可能转化到临床应用[7]。
传统蛋白质定量方法主要基于放射性或荧光发光的免疫化学技术/免疫印迹技术[8-9],其中酶联免疫吸附试验(ELISA)技术[10]可以定量分析血清中ng/L水平的蛋白质,是目前蛋白质定量研究的常用方法之一。但是,ELISA技术存在诸多限制,比如蛋白质抗体难以获得、不同抗体批次之间存在差异、基于抗体的检测存在交叉反应等问题[11-12]。因此,发展不依赖于抗体的蛋白质/多肽定量技术,将有助于提高生物标志物验证工作的效率。
近年来,随着仪器性能的提升,质谱法以其高效快速、成本低、检测灵敏度高、特异性强和通量大等特点,广泛应用于蛋白质等生物大分子以及代谢物等小分子的定量研究。在代谢物小分子分析方面,如维生素、类固醇及新生儿筛查等定量研究已经实现了临床应用[13-18]。在蛋白质/多肽定量检测方面,质谱技术已成为基于抗体检测法(如ELISA)的有效补充,针对某些分析物,甚至呈现出优于ELISA的表现[19]。因而,利用高重现性的样品前处理方法,结合高灵敏度、高通量的质谱技术,辅以对整个流程的严格控制,有助于建立高效的蛋白质/多肽定量检测方法,开展对诊断标志物大规模的验证,并及时将标志物的定量验证方法转化为临床应用。
1 与质谱联用用于蛋白质/多肽绝对定量的液相色谱分离技术
为了在复杂生物体系中对目标蛋白质/多肽的准确定量,需要在质谱分析前配置合适的液相色谱仪,并根据被检测肽段的性质选择合适的色谱分离方法,实现对目标物的准确检测。在蛋白质和多肽领域,与质谱联用的色谱仪按照流速主要分为常规流速液相色谱、微升液相色谱和纳升液相色谱。其中,纳升液相色谱可以配备内径小于0.1 mm的色谱柱和nL/min的低流速,低流速可以改善肽段在电喷雾中的离子化效率,排除色谱峰的干扰,提高检测灵敏度。因此,纳升液相色谱-质谱是有限量蛋白质样品研究的首选,常用于生物标志物早期的发现和确证[20-24]。然而,纳升液相色谱在低流速进样过程中需要配备能够长时间保持较好重复性的色谱柱,以保持系统的稳定性,同时实际操作过程中容易出现色谱过载、质谱饱和等情况[25-27],这些因素影响了肽段鉴定和定量的重复性,在分析一些浓度范围跨度较大的蛋白质样品(如临床组织和体液样本)时尤为明显。常规流速液相色谱已经广泛应用于临床肽段定量,但由于流速大,共流出肽段较多,易产生信号干扰,影响目标肽段的检测灵敏度。为了平衡系统稳定性和检测灵敏度,Bian等[28]提出微升流速液相色谱与质谱联用的策略,配备1 mm×150 mm的色谱柱分析超过2 000个来源于人类的组织、细胞、体液样本,数据显示了色谱保留时间(偏差CV<0.3%)、蛋白定量结果(CV<7.5%)极高的重现性,并且在16 h内完成了11个蛋白质组的高通量分析,同一根色谱柱可分析超过7 500个样品,且无明显的性能改变。由于微升液相色谱的稳定性好,近年应用于蛋白标志物向临床转化的研究中[19,29-30]。
2 质谱绝对定量技术
选择反应监测(selected reaction monitoring, SRM)是目前广泛应用于蛋白质/多肽大分子以及代谢物小分子定量的质谱绝对定量技术。SRM技术基于三重四极杆质谱对目标肽段进行靶向分析:通过第一级四极杆选择目标质荷比母离子,在第二级四极杆中发生碎裂,再经由第三级四极杆选择特征离子碎片进行靶向检测,最后通过比对标准品和测试品的子离子峰面积信息进行绝对定量。在SRM基础上,利用三重四极杆质谱仪可以循序选择多重反应特征,一次监测多个母离子,实现对多个目标分析物(比如多肽)的多反应监测(MRM)。
针对更高灵敏度和更高分辨率的组合型质谱仪,如四极杆离子阱质谱仪和四极杆飞行时间质谱仪,开发了相应的数据分析提取软件进行靶向离子监测。即在质谱的第一级四极杆中选择目标母离子,进入第二级碎裂池进行碎裂,然后利用高分辨、高质量精度的检测器(如离子阱或飞行时间检测器)对所有碎片离子进行检测,通过采集后的软件分析(post-acquisition)对目标碎片离子信息进行提取,实现与MRM相似(MRM-Like)的平行反应监测(parallel reaction monitoring,PRM,Thermo Scientific,USA)和MRMHR(Sciex,USA)技术靶向离子的定量研究。相比传统的MRM技术,MRMHR和PRM采用高分辨检测器进行全扫描,可同时收集目标肽段的全部碎片离子信息,更好地排除背景干扰和假阳性结果,实现对肽段的定性和定量研究[31]。
与同位素稀释技术相结合的 MRM 技术(stable isotope dilution MRM, SID-MRM),以及MRM-like 的MRMHR和PRM技术在多肽的定量检测方面具有以下优点:分析方法建立快速且经济,标准品运输保存较方便;高通量,一次分析可以监测到50~100个分析物;高灵敏度(低至Attomole);较大的动态范围(4~5个数量级);可分辨同分异构体;重现性好等[32-34]。Carr等[35]领导了全球多个实验室进行MRM 方法评估,分析实验室内和实验室间的结果重现性,绝大部分结果偏差在25%以内。通过先富集、后检测的方法对目标蛋白质复合物进行定量研究,同一实验室内的MRM方法重复性达98%,实验室间的重复性为81%[36]。因而,MRM 和MRM-like质谱技术是最具潜力、不依赖抗体的大规模蛋白质/多肽定量技术。
由于液相色谱存在相似性质肽段共流出的问题,导致复杂的实际样品中易存在质荷比接近的母离子同时碎裂,产生了混合多个母离子二级碎片离子的二级质谱图,由此进行分析会影响目标蛋白质的定量准确性[37-38]。三级质谱(MS3)是将串联质谱(MS2)中信号最强的二级碎片离子引入线性离子阱中进行高能碰撞(HCD)-MS3分析。基于MS3的相对定量方法可以有效改善目标分析物在复杂样品中被共流出肽段干扰的问题,提高相对定量的准确度[39]。随着MS3技术的产生与发展,相对应的MRM3技术应运而生,其是在最新的QTRAQ系统中应用MS3技术,在MRM3模式下,原本的Q3由线性离子阱替代,初级碎片离子在离子阱中进一步碎裂为次级碎片离子,选取归属为目标肽段的次级碎片离子进行检测,实现精准定量。MRM3在蛋白质和小分子绝对定量领域均有应用[40-43],但是其循环时间较长、灵敏度较低,因此蛋白质/多肽绝对定量的常用技术是MRM和PRM。
目前,与MRM和PRM等结合的定量蛋白质技术,根据其使用的标准品类型,可分为基于合成肽段、基于合成完整蛋白、基于标记试剂等3种定量方法。
2.1 基于合成肽段的定量方法
基于合成肽段的定量方法有内标法和外标法。内标法使用的标准品绝大多数为合成的稳定同位素标记的标准肽段,这种基于稳定同位素标记标肽的方法被称为绝对定量(absolute quantification, AQUA)[44]策略,流程示于图1。通过合成与待测肽段序列相同的肽段作为标准品,其中特定氨基酸用重标同位素标记。重标肽和待测肽段具有相同的理化性质和不同的质荷比,因此可以被质谱区分。通过比对重标肽和轻标肽的质谱峰面积,结合重标肽的含量信息,可以确定待测肽段的含量[20-21,45]。AQUA方法还被用来检测某些肽段翻译后修饰的水平[20,44]。
用于定量的肽段需要符合以下要求[46]:1) 待定量蛋白的特有肽段;2) 能够有效电离,易被质谱检测;3) 避免含有样品处理过程中容易带上修饰的氨基酸残基(如甲硫氨酸);4) 避免含有如KK、KR、RR、RK末端的序列,以防止蛋白酶漏切造成定量不准确;5) 除了定量翻译后修饰的蛋白,肽段的选择应避免含有翻译后修饰位点或靠近翻译后修饰位点的序列。除此之外,为了获得更好的质谱信号,肽段长度应尽量控制在7~20个氨基酸;考虑到色谱保留时间的稳定性,最好选择SSRC评分在10~45之间的肽段(http:∥hs2.proteome.ca/SSRCalc/SSRCalcX.html)。当待测蛋白质具有多条特有肽段时,优先选择信号强度较高的肽段用于定量分析[29]。通常参考已有的质谱实验数据,或通过PeptideAtlas[47]、SRMAtlas[48]、PRIDE[49]等公共数据库,以及生物信息学的预测工具辅助特有肽段的选择[50]。杨奕等[51]针对特定的质谱仪器开发了基于机器学习的方法,对目标蛋白的可检测性、质谱信号强度和保留时间进行预测,以辅助MRM技术定量特有肽段的选择。
近年来,通过蛋白质组学的高通量筛选,结合基于AQUA与MRM/PRM/SRM技术在大规模样品中进行验证,发现蛋白质疾病诊断标志物较之传统的甲胎蛋白(AFP)、糖蛋白标志物组合(APOH、ORM2、C3和AFP)在肝癌诊断方面的准确性更高[20];一组5个蛋白的标志物组合(IGHG2、LGALS3BP、DSG2、L1CAM、THBS1),诊断敏感度可提高到94%[22]。APOC3+HRG+TF+KLKB1组成的P4评分,以及4个蛋白(GC+HRG+HPR+SERPINA6)与4个临床指标(INR+Age+NEU+TotalProtein)组成的P8评分,使乙型肝炎病毒相关的慢加急性肝衰竭(HBV-ACLF)的精准诊断和预后成为可能[23]。近期,在关于目前最大的阿兹海默症相关蛋白质组的研究中,研究人员采用非标定量,共表达网络分析,结合PRM绝对定量手段对人脑组织和脑脊液样本进行分析,揭示了胶质细胞和星形胶质细胞蛋白相关的能量代谢在疾病进展中的重要作用,为阿兹海默症的诊断与治疗提供了新思路[52]。基于质谱的AQUA策略还被用于蛋白质复合物的亚基研究中[53-54],以检测不同亚基在血清中的含量。
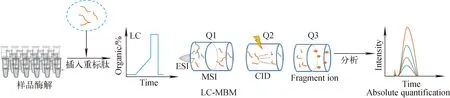
图1 绝对定量策略流程图Fig.1 Scheme of absolute quantification strategy
AUQA方法除了可以进行内标法定量目标肽段外,也同样适用于外标曲线法。外标曲线法[55]相较于传统的单点定量法,可以兼顾多个数量级变化的蛋白浓度差异,适用于大规模样品中蛋白质定量含量动态范围较大的检测。
为了兼得内部单点定量和外标曲线定量方法的优点,Chiva等[45]针对目标肽段合成了5条不同同位素标记的重标肽——同位素标记多点标准策略(isotopologue multipoint calibration, ImCal),每条肽段对应1个已知浓度,示于图2。将5条序列相同、浓度不同的重标肽混入样品中,一次质谱检测就能得到一条标准曲线和内源肽段的浓度信息,大大提高了检测效率和准确性。该方法适用于对不同样品中含量变化较大的目标肽段的准确定量。
对于低丰度肽段的定量,Anderson等[56]将基于抗体的多肽选择性富集纯化技术与MRM相结合,提出了基于稳定的同位素标准品及抗体捕获(stable isotope standards and capture by antipeptide antibody, SISCAPA)策略,示于图3。研究表明,运用该方法,血浆中目标肽段浓度经富集后可以提升1 000倍[57]。Whiteaker等[58]将SISCAPA与基于磁珠的自动化装置耦合,进一步提高了分析通量。运用该方法可定量分析血浆中浓度低至μg/L的蛋白,且CV小于20%[59]。在复杂生物体系中,针对体内有底物的酶类,或者生物体内有天然抗体的蛋白,如血清中脂蛋白相关磷酸化脂酶A2[60]和甲状腺球蛋白[61],基于抗体的免疫方法无法实现对这两种蛋白的捕获和测定,而SISCAPA-MRM法则避免了该类问题,可实现对目标蛋白的准确定量。SISCAPA-MRM方法中获得肽段抗体成本与获得对应蛋白质抗体成本接近,但成功率较高[62]。通过系统评估、评测,该方法的实验室内和实验室间变异系数分别高于定量限11%和小于定量限14%[63]。SISCAPA策略的另一个优势在于经过抗目的肽段的抗体富集后,待测样品中的肽段成分简单、浓度高,可以直接结合MALDI-TOF MS分析,大大加快了样品检测的速度和通量[64]。结合自动化样品前处理流程,SISCAPA策略定量分析血液中不同含量蛋白的CV值均小于5%[65]。有研究利用亮氨酸脉冲标记结合SISCAPA测定血浆中一些重要蛋白标志物的量随时间的动态变化,这对建立个性化的用药方案具有重要意义[66-67]。

图2 同位素标记多点标准策略流程图Fig.2 Scheme of isotopologue multipoint calibration strategy
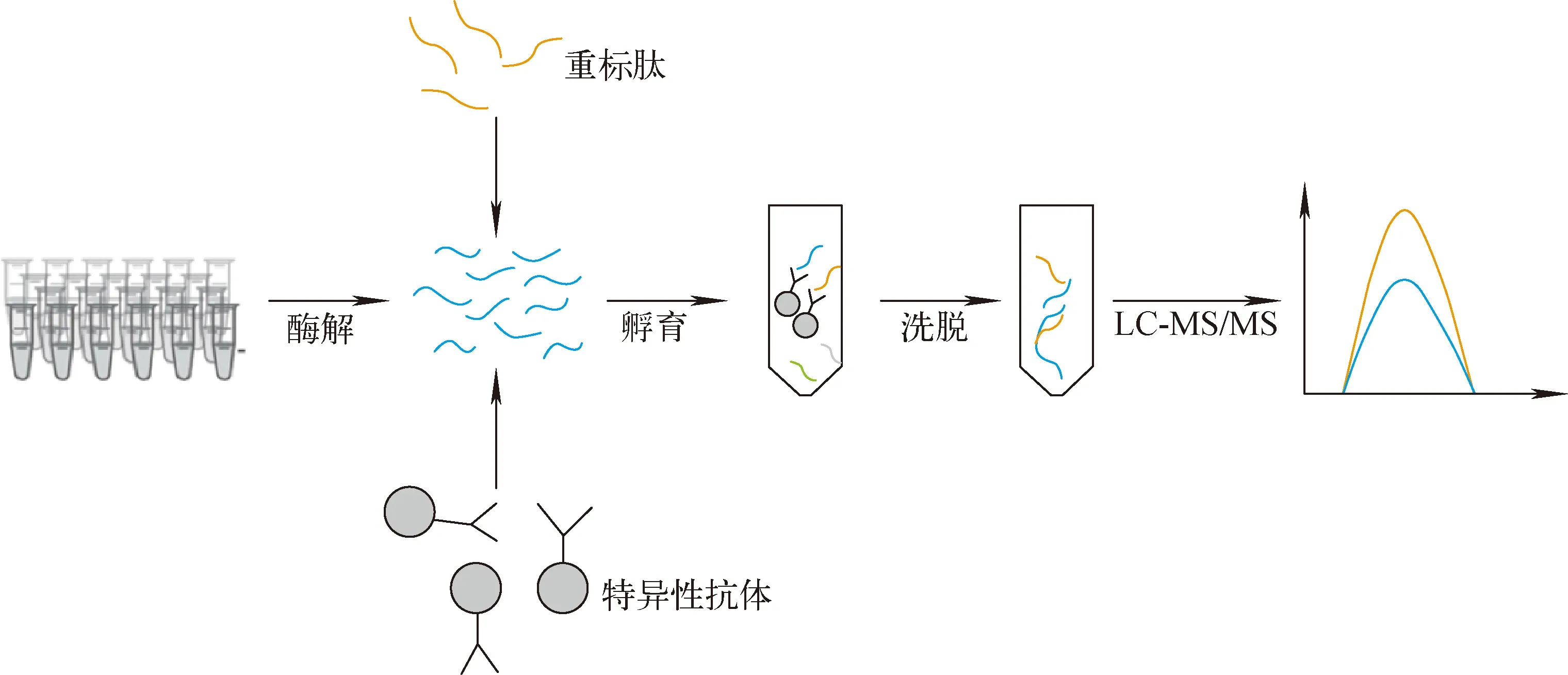
图3 稳定的同位素标准品及抗体捕获策略流程图Fig.3 Scheme of stable isotope standards and capture by antipeptide antibody strategy
AQUA方法需要对每条合成的重标(或轻标)肽段进行精确质量的确定,通常使用氨基酸含量测定法(amino acid analyze, AAA)对合成的肽段进行精准定量,一次定量多个蛋白的工作量较大。Beynon等[68]提出了基于定量肽段聚合物(concatemer of quantification peptides, QconCat)技术,可以实现一次同时准确定量多条标准肽段,示于图4。即将待测蛋白的目标肽段编码基因通过首尾相接的方法拼接到一起,构建质粒,转入含有重标氨基酸培养基的酵母或者大肠杆菌体系中进行表达,融合蛋白中的肽段都含有重同位素标记,且蛋白和肽段的计量关系都是严格的1∶1[69]。有些QconCat蛋白无法在细菌中表达,而利用小麦胚芽无细胞蛋白合成系统则可以实现无细胞高效率的QconCat蛋白表达,同时能够降低QconCat蛋白被蛋白酶水解的概率[70]。另外一种相似的多聚蛋白(polyprotein SIS, PolySIS)策略,在体外利用化学连接的方法合成蛋白质[71]。QconCat和PolySIS可以实现一次合成多条重标肽,提高了分析效率,但弊端在于融合蛋白序列与实际待测蛋白序列不同,导致酶解效率不一致,对目标蛋白产生定量误差。为了避免这一问题,基于肽段重组连接的标准品(peptide-concatenated standard, PCS)的策略被提出[72],即将多个目标蛋白的待测肽段及其天然侧翼氨基酸序列的编码基因连接,构建融合蛋白。该融合蛋白中待测肽段及其两侧氨基酸序列与天然蛋白相同,因此认为这两者的酶切效率相似,避免了上述酶解效率不均一等问题。运用这一策略,可成功地测定蛋白复合物的亚基数目。QconCat策略结合冷冻电镜的使用,确定了鼠伤寒沙门氏菌中一种特殊的细胞器(丙二醇利用微室,Pdu MCPs)外壳蛋白和内部酶的计量数及其外部结构,精准的计量有利于对Pdu MCPs及其他细菌微室结构的深入认识[73]。该策略被运用于斑马鱼组蛋白[74]、人突变蛋白[75],以及血吸虫[76]和番茄[77]中一些重要蛋白的定量,利用基于SRM的QconCat技术对酿酒酵母中超过1 800个蛋白进行了绝对定量[78]。
2.2 基于合成完整蛋白的定量方法
为了更好地消除系统误差,Brun等[79]提出了合成重标完整蛋白的策略——蛋白标准品绝对定量(protein standard absolute quantification, PSAQ),示于图5。该方法将构建全长的同位素标记重组蛋白作为标准品,重标重组蛋白加入未经处理的生物学样品,同步进行样品的还原、烷基化和酶解等前处理过程,通过质谱分析达到对目标肽段准确定量的目的。PSAQ蛋白与待测蛋白具有类似的理化性质和酶切效率,可实现更加准确的定量,类似的还有“基于氨基酸的稳定同位素标记的细胞培养法进行绝对定量”[80]和“表达的可用于定量的稳定同位素标记的全长蛋白(full-length expressed stable isotope-labeled proteins for quantification, FLEXIQuant)”[81]方法。为了获得更准确的定量结果,研究者提出了用基于氨基酸的稳定同位素标记的细胞培养法(stable isotope labeling by amino acids in cell culture,SILAC)得到的内标蛋白和未标记的全长蛋白质校准进行靶向绝对定量蛋白质组学方法(targeted absolute quantitative proteomicswith SILAC internal standards and unlabeled full-length protein calibrators, TAQSI)[82]。该策略将相同量的重标全长蛋白加入轻标蛋白标准溶液和实际样品中,数据分析过程中,以轻标量与重标量之比为横坐标,二者色谱峰面积之比为纵坐标绘制校准曲线。将实测样品中的待测肽段与重标肽的峰面积之比代入曲线中,即得到样品中待测肽段的含量。TAQSI进行了2次校准定量,其结果更加精确。Oeckl等[83]对比了PSAQ和AQUA策略定量分析脑脊液中α-突触核蛋白,结果显示,PSAQ的定量更准确。另外,基于PSAQ的方法还应用于肾损伤相关标志物的验证[84]、公共安全领域的食物毒素检测和定量分析[85]。

图4 定量肽段重组蛋白策略流程图Fig.4 Scheme of concatemer of quantification peptides strategy
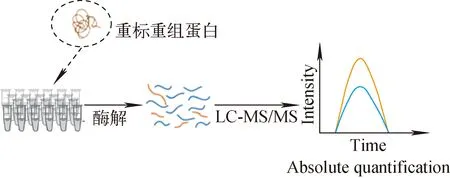
图5 蛋白标准品绝对定量策略流程图Fig.5 Scheme of protein standard absolute quantification strategy
针对低丰度蛋白质,研究者提出基于抗体的富集技术与PSAQ技术相结合,即用抗体富集目标蛋白和加入的全长内标重组蛋白进行定量[86-87]。由于核酸适配体(aptamer)能够与目标蛋白质高特异性、高选择性地结合,Zhou等[88]筛选出了能与HER2蛋白高亲和力结合的核酸适配体,并将含有胰蛋白酶解位点的肽段用作报告肽段与适配体相连,连接了报告肽段的适配体可以捕获乳腺癌细胞中的HER2蛋白,经过胰蛋白酶解后,可以直接通过LC-MS/MS检测报告肽段间接定量HER2蛋白。核酸适配体也可结合磁珠,通过富集样品中的目标蛋白进行定量[89]。
2.3 基于标记试剂的定量方法
用于相对和绝对定量的胺修饰标记试剂(amine-modifying labeling reagents for relative and absolute quantitation, mTRAQ)是一种由美国AB Sciex公司开发的非等重化学标记试剂,3个标签的分子质量分别相差0、4、8 u,可以实现一次分析3组样品。mTRAQ标记试剂结合MRM技术和已知含量标准品,可以针对肽段进行多重样品绝对含量测定[90],示于图6。进一步将类似mTRAQ的三重二甲基标记试剂和8-Plex iTRAQ试剂联用,得到高通量样品多反应监测质谱法(high-sample-throughput multiple reaction monitoring mass spectrometric method, HST-MRM-MS),最多一次能定量24个样品[91],示于图6。在磷酸化蛋白[92]以及用脑脊液中蛋白[93]的定量方面,也有基于不同标记试剂但是原理类似的应用。Hochleitner等[94]利用同位素编码的蛋白标签(isotope-coded protein label, ICPL)试剂标记标肽用于定量研究。在代谢标记方面,开发了Neucode代谢标记方法,将不同同位素标记的赖氨酸加入不同组的细胞培养基中,使不同组的细胞表达含有不同同位素标记的赖氨酸的目的蛋白,结合五重二甲基化标记试剂,一次可定量30个样品,该研究结合PRM技术可分析前列腺癌(PC-3)细胞株感染水泡性口炎病毒蛋白含量的变化[95]。基于标记/标签定量方法的准确性会受到标记/效率的影响。
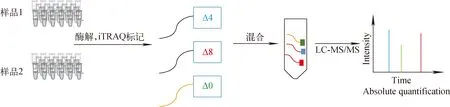
图6 用于相对和绝对定量的胺修饰标记试剂策略流程图Fig.6 Scheme of amine-modifying labeling reagents for relative and absolute quantitation strategy
各种策略的优势和限制列于表1。上述所有绝对定量方法的本质是通过对肽段的定量来间接得到蛋白的绝对量。

表1 各种基于质谱的定量策略对比Table 1 Comparison of quantification strategies based on LC-MS/MS
3 提高基于质谱对蛋白质/多肽绝对含量测定的精度
3.1 标准肽段的选择
为了获得对蛋白质的准确定量,除在1.1节中所提到的肽段选择原则外,还需要对标准品含量进行准确测定,选择合适的保存条件,确保在测定时间范围内标准品没有被降解或者被吸附。目前用于定量的肽段标准品通常通过购买商业化标准品获得,通过氨基酸分析确定标准品含量,或者使用具有溯源性的物质作为配制标准品的参考物质[19]。在储藏过程中,溶液蒸发、肽段吸附、微生物降解、形成新的二级结构和化学修饰等是导致标准品溶解度损失或浓度变化的主要原因。为了保证标准品的储存稳定性,Hoofnagle等[46]提出在1~100 μmol/L浓度范围内,肽段标准品可在4 ℃冷藏或在-20~-80 ℃冷冻3个月;3个月到一年内的保存需要将标准品肽段冻存在-20~-80 ℃;一年以上肽段标准品需要冻干保存在-20~-80 ℃。标准品重溶之后仍然需要用氨基酸对肽段重新定量。为了减少肽段的降解,应尽可能避免反复冻融。
肽段储存过程中,有可能在容器壁、移液管尖端、自动进样瓶和高效液相色谱仪中产生非特异性吸附[46]。Weber等[96]提出对实验耗材进行预处理以避免待测物吸附性损失,比如用不影响待测物的大肠杆菌蛋白对实验耗材进行钝化处理。研究表明,在经过处理的塑料制品中对目标蛋白的两种标准品进行检测,检测值均接近实际量的100%,另外,也可以通过重复进样来评估损失[46],计入定量。
3.2 样品前处理的质量控制
在蛋白质组学自下而上的研究策略中,样品前处理包括蛋白质提取、溶解、还原、烷基化和酶解等多个步骤,这些步骤的系统误差将在一定程度上影响定量准确性。Shuford等[97]对血清中甲状腺球蛋白定量结果的误差来源进行详细评估,结果表明,不完全酶解和样品间的酶解差异是定量误差的重要来源,对人源性和重组的甲状腺球蛋白进行详细比较,在各种消化条件下,这两种蛋白的定量结果都存在一定差异,所以应尽量选择与分析物类似的标准品作为校准品,以提高定量精确度。有报道指出,对研究的生物标志物的生物学性质有足够的了解,蛋白质生物标记物分析方法中非常重要,包括对正常或疾病状态下目标蛋白生理学的了解,以选择具有代表性的校准品[98]。为了获得蛋白质的准确定量结果,有研究者将与目的蛋白理化性质最为接近的全长重标重组蛋白插入实际样品中作为内部校准样品[96,99]。这种样品前处理过程中的质控方法可以同其他的定量策略结合,得到更精确的蛋白/肽段定量结果。
3.3 质谱检测过程中的质量控制
在质谱分析流程中,加入严格的质控和评估将大大提高定量的准确性。Weber等[96]在阿尔兹海默症(AD)的β-淀粉样蛋白40、42定量研究中,考察了质谱检测的相关问题,如对标准品不断稀释、测定,确定定量限(LOQ);对人工的脑脊液检测确定空白检测限(LOB);评估样品残留量(carryover);通过多次实验确定批内和批间精密度;对多个浓度标准品多次测定以评估定量的重现性;对样品进行反复冻融检测以确定样品的稳定性等。结果显示,辅以对整个流程严格控制,基于质谱的肽段绝对定量方法可以替代免疫学方法区分AD和非AD患者,每条肽段的批内和批间CV均小于15%,回收率在93%~111%之间。
4 基于质谱法对蛋白质/多肽绝对含量的测定
为了实现在大规模样品中对蛋白质/肽段进行准确定量,并将定量结果转化到临床试剂盒的开发和评测过程中,通过参考生物分析方法验证指南[100]、《中国人民共和国国家标准》-质谱分析方法通则、以及广泛应用于临床质谱小分子定量检测的经验[101-103],提出了能够提高基于肽段间接定量蛋白精确度的建议:1) 标准品的选择。无论是用基于肽段的方法还是基于完整蛋白的方法,首选含量信息准确、保存稳定的标准品,标准品和基质要尽量同实际样本相似,如选择全长重标的目标蛋白标准品,并准确监控酶解效率等样品前处理过程中的各种损失。2) 确定保存条件。确保样品和标准品的稳定性。3) 充分考虑实验过程中耗材对待测样品和标准品的吸附,推荐使用不影响待测物质的蛋白对所用的实验耗材进行预处理。4) 选择合适的标准曲线。至少选择5个浓度的样本,每个样本重复2~4 次,以确定标准曲线的线性;定量限浓度点的测量偏差控制在±20%以内,其余浓度点控制在±15%以内,CV<20%。5) 定量曲线质控。使用标准品或质控品,选择低、中、高3个浓度的样本进行精密度评估,要求浓度覆盖定量范围;每个浓度标准至少测定5次,评价批间精密度,并至少测定3个批次;定量限浓度附近低值CV<20%,其余浓度CV<15%。 6) 待测样品质控。确定待测物的检测限、定量限以及空白检测限,检测限信噪比大于3∶1,使用3~5个接近检测限的样品浓度,重复测定,定量限和理论值偏差在±15%以内,CV<20%。7) 方法重复性的确定。对标准品跨越5个数量级的浓度进行5天内重复测定,以评估定量的重现性。8) 考虑样品或标准品的残留,在检测高浓度样品或标准品后插入空白样品分析,以避免对后续样品造成影响。
本文总结了基于质谱的蛋白质定量技术,并提出能够提高蛋白质/肽段定量精确度的建议,希望在促进生物标志物的临床转换研究方面能够给研究者们一些启发。
