液相色谱-同位素稀释质谱法测定血清生长激素
2021-04-02余利星楚占营金有训武利庆龚晓云戴新华俞晓平
余利星,翟 睿,楚占营,3,金有训,武利庆,米 薇,龚晓云,谢 洁,江 游,戴新华,方 向,俞晓平
(1.中国计量大学生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018;2.中国计量科学研究院,质谱仪器工程技术研究中心,前沿计量科学中心,北京 100029;3.华东理工大学化学与分子工程学院,上海 200237)
临床体外诊断生物标志物中,蛋白质类标志物约占10%~15%[1]。目前,针对蛋白质的检测方法有时间分辨荧光免疫分析法[2-3]、酶联免疫吸附法[4]、LC-MS/MS法[5-6]、免疫散射比浊法[7]和毛细管电泳结合紫外、质谱技术[8]等,其中基于抗原-抗体反应的免疫分析法是临床蛋白质定量分析应用最广泛的方法[9-11]。然而,由于存在抗体特异性差异、蛋白质结合位点差异、基质干扰、假阳性结果等问题,很难得到准确可靠的蛋白质定量分析数据,造成不同国家、不同实验室蛋白质定量分析结果不可比对,临床诊断准确性无法保证[12-13]。因此,建立高准确度的蛋白质定量分析方法是必要的。
同位素稀释质谱法(isotope dilution mass spectrometry,IDMS)具有准确性高、重现性好等特点,已成为蛋白质质谱定量分析的首选方法[14-16]。该方法将已知质量的同位素标记肽段或蛋白质作为内标加入待测样本中,通过质谱仪测定同位素丰度比例,从而计算目标蛋白质含量。然而,以同位素标记肽段为内标的方法,由于标记肽段添加时间较晚,且理化性质与目标蛋白质相差较大,由蛋白质降解、酶切不完全以及蛋白样品损失带来的定量误差无法避免[17]。因此,以同位素标记蛋白质作为内标的方法是更可靠的。
内分泌疾病是内分泌腺或内分泌组织本身的分泌功能和(或)结构异常时发生的症候群,目前已成为严重威胁人类健康的慢性疾病。临床上,内分泌疾病的预防、诊断和治疗主要依赖相应诊断标志物的准确测量[18]。人生长激素(human growth hormone,hGH)是由人体脑垂体前叶嗜酸性细胞分泌的一种蛋白质类激素,由191个氨基酸构成,其主要生理功能是促进组织生长、全身蛋白质合成、脂肪分解等,是肢端肥大症、巨人症、侏儒症等疾病临床诊断的重要指标[19-22]。人血清中生长激素正常值为:成年男性<2 μg/L、成年女性<10 μg/L,儿童<20 μg/L[23]。目前,hGH的检测方法主要是基于抗原-抗体反应原理的免疫分析方法[24-25],然而由于受到抗体特异性、测量准确性和重复性的限制,该方法的重复性不理想,易出现假阳性结果,无法满足人们对蛋白质高准确度测量的需求。
由于血清中成分复杂,hGH含量极低,并且存在大量高丰度蛋白质的信号干扰[26-28],使得血清中hGH的直接分析存在困难。在质谱分析前,发展有效的分离纯化方法是血清中生长激素准确定量分析的关键。本研究拟以同位素标记的人生长激素为内标,建立一种基于离线二维高效液相色谱分离蛋白质酶切样品的方法。该方法通过应用高低pH流动相实现不同性质血清酶切肽段的有效分离,从而降低血清样品的复杂程度,提高hGH定量肽段的质谱响应。最后,结合高效液相色谱-同位素稀释质谱法(HPLC-IDMS)准确定量分析血清中hGH含量,其流程图示于图1,并应用建立的方法参加国际比对(CCQM-P164)。
1 实验部分
1.1 仪器与材料
Agilent 1260高效液相色谱仪:美国Agilent公司产品,配有G1311C四元泵、G1314F紫外检测器和液相色谱系统化学工作站;Agilent 1200/API 5500液相色谱-质谱联用仪:美国Agilent公司/美国AB Sciex公司产品,配有电喷雾离子源(ESI)及Analyst数据处理软件;ME235S分析天平:德国赛多利斯集团产品;VORTEX GENIE2混匀仪:美国 Scientific Industries公司产品;Milli-Q超纯水系统:美国 Millipore公司产品;真空离心浓缩仪:美国Thermo公司产品。
人生长激素标准品(WHO国际标准品):英国NIBSC公司产品;二硫苏糖醇(DTT,纯度≥99%)、胰蛋白酶(纯度≥99%)、乙腈(色谱纯):美国Sigma公司产品;空白血清:美国NIST公司产品;国际比对人生长激素标准品(6.57 μg/g)、国际比对同位素标记人生长激素标准品(8.30 μg/g)、国际比对空白血清、国际比对样品:由德国联邦物理技术研究院提供;Tris-碱(Tris-Base,纯度≥99%):福州Phygene公司产品;Tris-酸(Tris-HCl,纯度>99.5%):上海索宝生物科技有限公司产品;甲酸(FA)、三氟乙酸(TFA)、乙酸:均为LC-MS级,美国Thermo Fisher科技有限公司产品;氨水(NH3·H2O,浓度25%):东莞泰鑫化工有限公司产品;hGH定量特异性肽段(T2、T11和T12)及其标记肽段:吉尔生化有限公司产品;模拟样品(理论含量12.00 ng/g):空白血清添加已知质量生长激素标准物质。
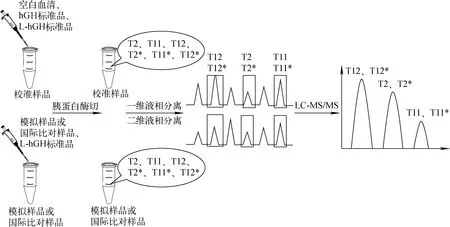
图1 血清中hGH的测定流程Fig.1 Chart of method flow of hGH in serum
1.2 实验方法
1.2.1标准品制备 使用空白血清稀释生长激素(hGH)标准品和同位素标记生长激素(L-hGH)标准品,轻轻混匀1 h,分装后保存于-80 ℃冰箱,备用。
1.2.2校准样品和血清样品的制备 将500 μL空白血清与1.2.1节配制的hGH和L-hGH标准品混合,制成校准样品。其中,校准样品1为含有11.95 ng/g hGH标准品和11.60 ng/g L-hGH的血清溶液,用于模拟样品的分析;校准样品2为含有17.29 ng/g hGH标准品和17.32 ng/g L-hGH的血清溶液,用于国际比对样品的分析。
将500 μL血清样品(模拟样品或国际比对样品)与上述配制的L-hGH标准品混合制备待分析的血清样品,待分析的血清模拟样品中L-hGH的添加质量与hGH的理论质量相等。
1.2.3胰蛋白酶酶切 称取302.5 mg Tris-Base和395 mg Tris-HCl溶于1 mL纯水中,配制Tris溶液;称取12 mg胰蛋白酶溶于1.8 mL 50 mmol/L HAc中,配制胰蛋白酶溶液。取65 μL Tris溶液至校准品和样品中,混匀后逐滴加入50 μL胰蛋白酶溶液(pH值为8.2±0.2),然后每隔30 min逐滴加入100 μL乙腈溶液,共11次,从30 min起,每隔60 min滴加50 μL胰蛋白酶溶液,共5次[16]。将校准品和样品在37 ℃环境中孵育16 h。
在校准品与样品中加入3.2 mg DTT,于37 ℃轻摇1 h,以17 860 r/min离心10 min,吸取上清液。加1 mL水-乙腈溶液(50∶50,V/V)于沉淀中使其溶解,以17 860 r/min离心10 min后,合并上清液,然后将上清液置于真空离心浓缩仪中浓缩干燥。加入400 μL去离子水至浓缩干燥的校准品与样品中,涡旋,加入100 μL 16% TFA溶液,涡旋。以3 960 r/min离心10 min,吸取上清液,加入300 μL去离子水洗涤沉淀,以3 960 r/min离心10 min后,合并上清液,备用。
1.3 实验条件
1.3.1离线二维高效液相色谱条件 一维液相色谱条件:Jupiter Proteo色谱柱(RP-C12,9 nm,4 μm,250 mm×10 mm);流动相:A为含0.1%TFA的水溶液,B为含0.1%TFA的乙腈,流速2 mL/min;洗脱梯度:0~1 min(0~1%B),1~5 min(1%B),5~80 min(1%~80%B),80~90 min(80%B),90~90.5 min(80%~1%B),90.5~120.5 min(1%B)。
二维液相色谱条件:Jupiter C4色谱柱(30 nm,5 μm,250 mm×10 mm);流动相:A为含0.05% FA的水溶液,使用NH3·H2O溶液(浓度25%)调至pH 8.0±0.1,B为含0.05%FA的乙腈,使用NH3·H2O溶液(浓度25%)调至pH 8.0±0.1。使用500 μL流动相A复溶一维液相分离得到的干燥馏分。复溶后上样,流速2 mL/min,洗脱梯度为0~5 min(0%B),5~80 min(0%~60%B),80~85 min(60%B),85~85.5 min(60%~0%B),85.5~115.5 min(0%B)。
1.3.2高效液相色谱条件 色谱柱:Aeris Peptide XB-C18色谱柱(250 mm×2.1 mm×3.6 μm,Phenomenex);进样体积20 μL;流速200 μL/min;流动相:A为含0.1%FA的水溶液, B为含0.1%FA的乙腈;洗脱梯度:0~6 min(100%~98%A),6~15 min(98%~91%A),15~60 min(91%~70%A)。
1.3.3质谱条件 电喷雾离子源,喷雾电压4.2 kV,多反应监测模式(MRM)。T11和T11*、T12和T12*的碰撞能量为20 eV,去簇电压为50 V;T2和T2*的碰撞能量为22 eV,去簇电压为50 V。监测离子:T2为m/z490.4→719.4,T2*为m/z496.23→729.32;T11为m/z681.5→875.5,T11*为m/z689.3→887.4;T12为m/z387.4→531.4,T12*为m/z392.19→539.23。
2 结果与讨论
2.1 一维色谱分离(C12色谱柱)
血清样品经酶切处理后产生大量肽段,样品成分极其复杂,质谱分析中高丰度蛋白质的酶切肽段将严重抑制hGH定量肽段的质谱信号。为了降低血清酶切样品复杂程度,提高低丰度蛋白质的定量准确性,需建立新的有效分离纯化方法,以实现hGH定量肽段的收集和分析。首先,化学合成用于生长激素准确定量分析的特征肽段T2(LFDNAMLR, Mr=979.15)、T11(DLEEGIQTLMGR, Mr=1361.52)、T12(LEDGSPR, Mr=772.8)及相应的同位素标记肽段T2*、T11*和T12* [16]。然后,在低pH值流动相条件下,进样合成肽段纯品(100 μg/L)。经高效液相色谱分离检测后,T2和T2*、T11和T11*、T12和T12*的保留时间分别为38~39、41.5~42.5、25~26 min,示于图2。因此,在低pH值流动相条件下,血清样品酶切后经第一次高效液相色谱分离时(图3),馏分收集器收集38~39 min时的馏分(含有肽段T2和T2*),41.5~42.5 min时的馏分(含有肽段T11和T11*)和25~26 min时的馏分(含有肽段T12和T12*),将收集的馏分浓缩干燥,加入200 μL乙腈-水溶液(80∶20,V/V),复溶后浓缩干燥,用于第二次高效液相色谱分离(高pH值流动相)。
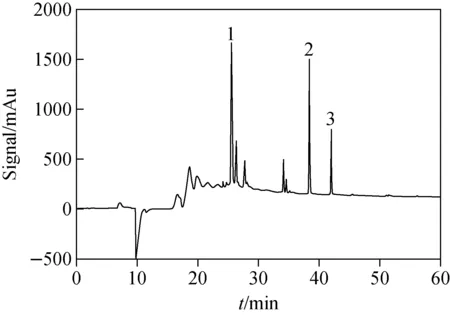
注:1.肽段T12,25.547 min;2.肽段T2,38.315 min;3.肽段T11,41.943 min图2 T2、T11和T12肽段经高效液相色谱(低pH值流动相)分离的色谱图Fig.2 Chromatogram of peptide T2, T11 and T12 separated by high performance liquid chromatography (low pH mobile phase)
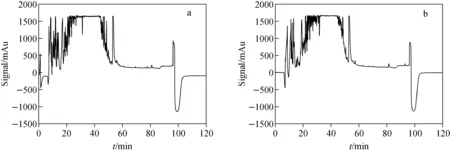
注:a.模拟样品;b.国际比对样品图3 血清样品酶切后经高效液相色谱(低pH值流动相)分离的色谱图Fig.3 Chromatograms of a digested serum sample separated by high performance liquid chromatography (low pH mobile phase)
2.2 二维色谱分离(C4色谱柱)
为进一步分离纯化血清酶切样品,降低定量分析时杂质肽段的质谱信号干扰,目标馏分需再次经过高效液相色谱分离(高pH值流动相)。使用C4色谱柱在高pH值流动相分离后收集含有肽段T2、T11和T12的馏分。首先,在高pH值流动相条件下,将浓度为100 μg/L的T2、T11和T12肽段及相应的同位素标记肽段进样到色谱系统。在C4色谱柱上,T2和T2*、T11和T11*、T12和T12*的保留时间分别为55.3~56.3、51~52、20.5~21.5 min,示于图4。在高pH值流动相条件下,血清酶切样品经高效液相分离,其色谱图示于图5。馏分收集器收集55.3~56.3 min时的馏分(含有肽段T2和T2*),51~52 min时的馏分(含有肽段T11和T11*)和20.5~21.5 min时的馏分(含有肽段T12和T12*),分别加入100 μL FA-H2O溶液(5∶95,V/V),真空浓缩干燥后用于后续质谱定量分析。血清酶切样品经不同pH值流动相的色谱纯化后,有效分离了不同性质的肽段,同时去除了大量杂质肽段,降低了样品的复杂程度,显著提高了hGH定量肽段的质谱信号强度。建立的基于离线二维高效液相色谱分离纯化新方法是血清中生长激素准确定量分析的前提。
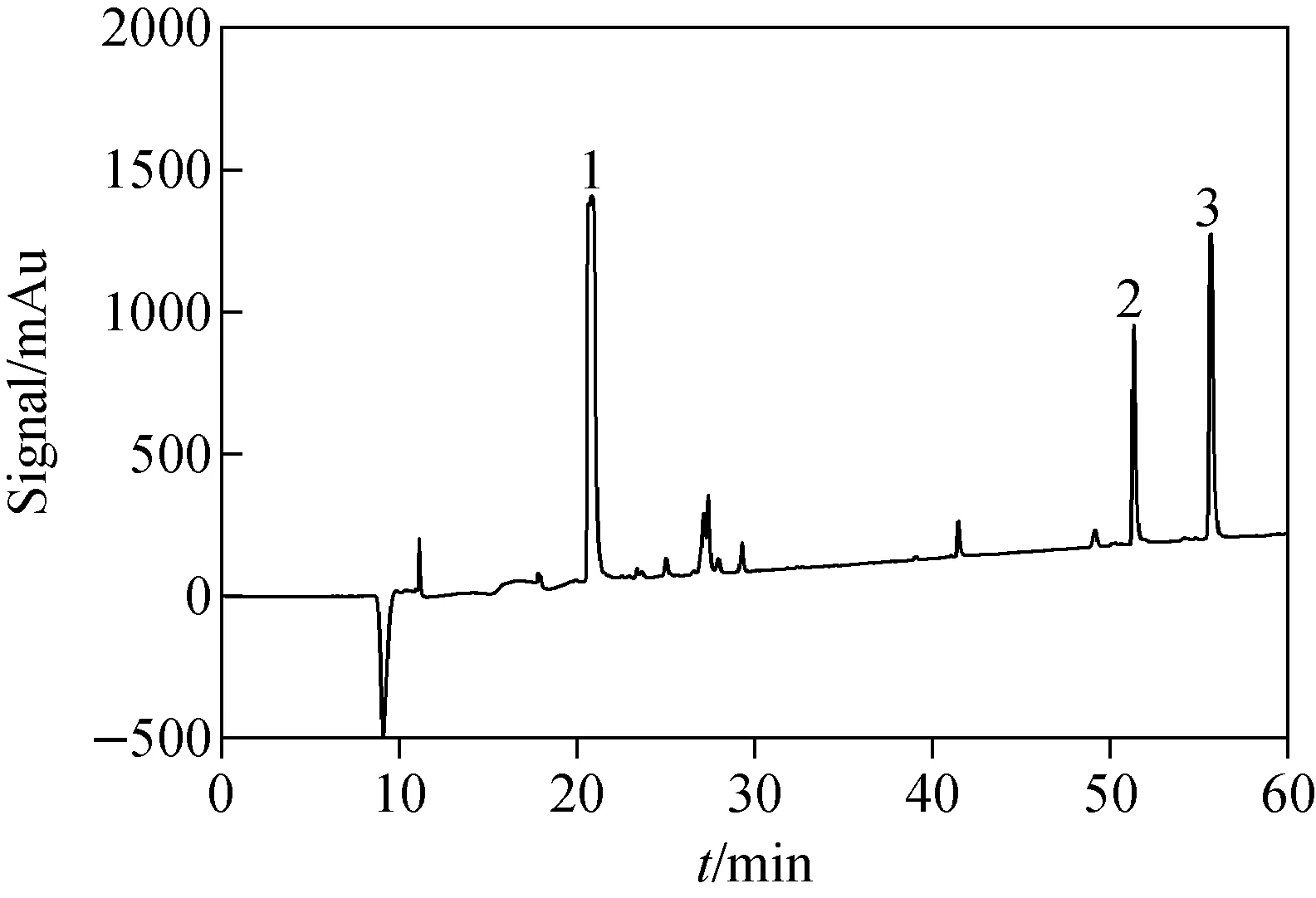
注:1.肽段T12,20.722 min;2.肽段T11,51.367 min;3.肽段T2,55.700 min图4 T2、T11和T12肽段经高效液相色谱(高pH流动相)分离的色谱图Fig.4 Chromatogram of peptide T2, T11 and T12 separated by high performance liquid chromatography (high pH mobile phase)
2.3 液相色谱-质谱联用定量分析
为提高质谱数据分析的准确度,使用液相色谱-质谱联用系统流动相A分别溶解T2、T11和T12肽段,混合后将浓度为10 ng/L的肽段溶液进样液相色谱-质谱联用系统。经分析,T2和T2*、T11和T11*、T12和T12*的保留时间分别为35.7~36.2、49.75~50.25、13.4~13.9 min,示于图6。
理论上,蛋白质与其定量肽段的物质的量之比为1∶1,采用不同特异性肽段定量蛋白质应得到一致的分析结果。预实验中,选用T2、T11和T12肽段定量分析血清中生长激素含量,结果分别为7.57、7.67、7.43 ng/g。因此,无论在理论上还是实际测量中,3条肽段的定量结果是一致的。
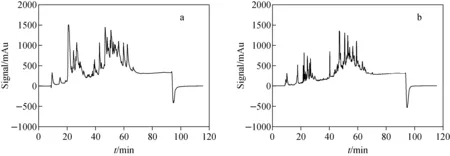
注:a.模拟样品;b.国际比对样品图5 血清样品酶切后经高效液相色谱(高pH值流动相)分离的色谱图Fig.5 Chromatogram of a digested serum sample separated by high performance liquid chromatography (high pH mobile phase)
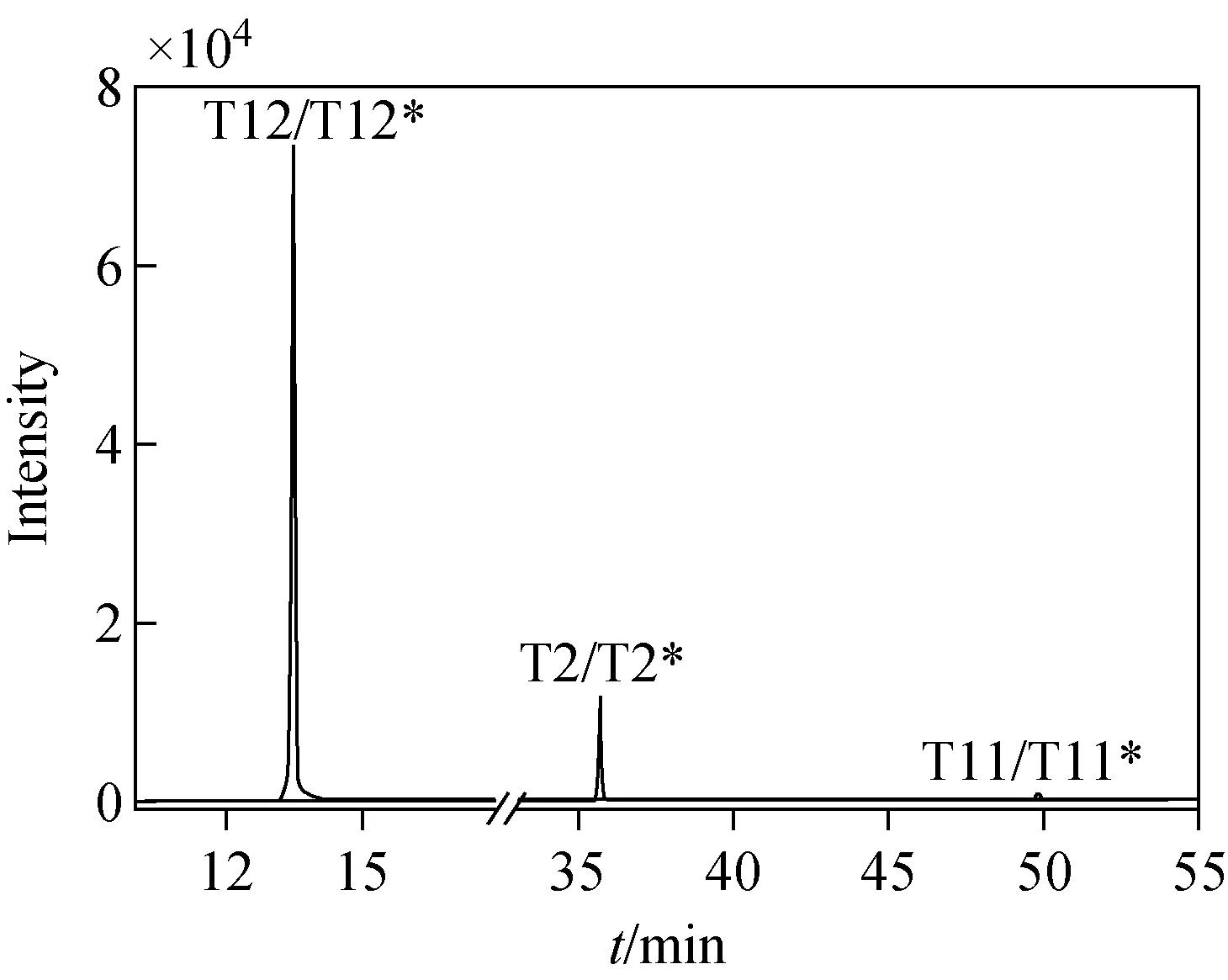
图6 T2,T11和T12肽段经高效液相色谱-质谱联用分析的色谱图Fig.6 Chromatogram of peptide T2, T11, and T12 analyzed by HPLC-MS
使用液相色谱-质谱联用系统流动相A复溶模拟样品(12.00 ng/L)分离后肽段,相同条件下进样液相色谱-质谱联用系统定量分析,实验重复测试3次,结果示于图7。血清中hGH含量根据式(1)计算:
(1)
其中,m1:hGH标准物质原液的质量;m2:配制hGH储存液时,添加空白血清的质量;m5:配制校准品时,添加hGH工作液的质量;m6:配制校准品时,添加同位素标记hGH工作液的质量;m7:配制校准品时,添加空白血清的质量;m8:待测样品的质量;m9:待测样品中添加同位素标记hGH的质量;c1:hGH标准物质原液的浓度;c8:待测样品的浓度;A1:校准样品中,定量肽段与同位素标记定量肽段的峰面积比;A2:待测样品中,定量肽段与同位素标记定量肽段的峰面积比。
定量分析模拟样品时,分别根据T2和T12肽段定量hGH含量得到分析结果,列于表1。在该方法建立过程中,虽然T12肽段定量分析结果(平均值11.84 ng/g)更接近理论值12.00 ng/g,但由于质谱分析中T12肽段附近有与其保留时间相似的杂质肽段干扰定量准确度,因此在国际比对样品定量分析时(图8),选择T2肽段和T11肽段的定量分析结果,列于表2。
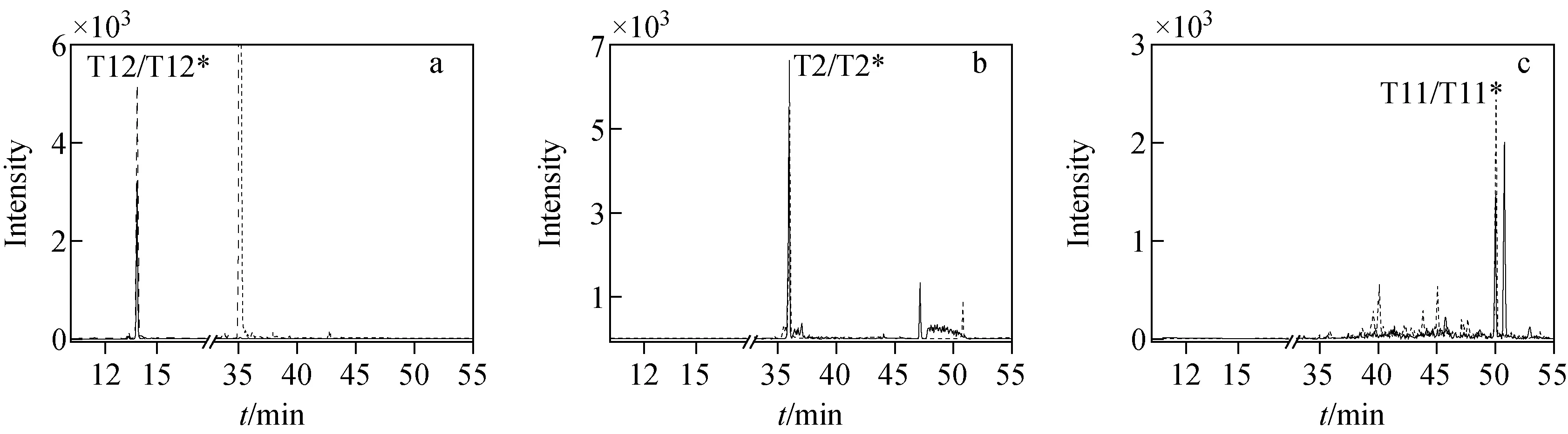
注:a.肽段T12和T12*;b.肽段T2和T2*;c.肽段T11和T11*;实线表示标记肽段,虚线表示非标记肽段图7 经高效液相色谱-质谱联用分析的模拟样品色谱图Fig.7 Chromatograms of simulated samples analyzed by HPLC-MS

表1 HPLC-IDMS法定量分析血清模拟样品中hGH含量Table 1 Quantitative analysis of hGH content in simulated serum samples by HPLC-IDMS
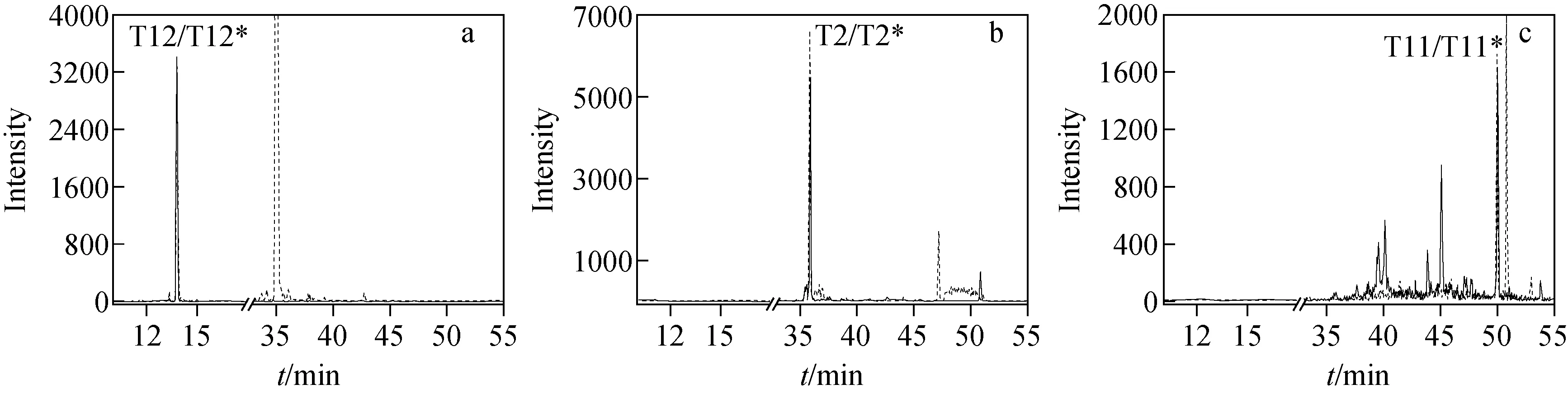
注:a.肽段T12和T12*;b.肽段T2和T2*;c.肽段T11和T11* ;实线表示标记肽段,虚线表示非标记肽段图8 经高效液相色谱-质谱联用分析的国际比对样品色谱图Fig.8 Chromatograms of international comparative samples analyzed by HPLC-MS

表2 HPLC-IDMS法定量分析国际比对样品中hGH含量Table 2 Quantitative analysis of hGH in serum from international comparison by HPLC-IDMS
2.4 不确定度计算
2.4.1A类不确定度评估 A类不确定度评估应用同一样品重复测量3次,量值的标准不确定度表示。对于同一特征肽段,通过极差法对标准偏差的计算示于式(2):
(2)
其中,xmax和xmin分别表示最大和最小测量值,dn为自由度。平均值不确定度的计算示于式(3):
(3)
因此,合成标准不确定度的计算示于式(4):
(4)
同样,用于定量分析的另一条特异性肽段的合成标准不确定度uc2参照上述公式计算。
因此,合成标准不确定度的平均值计算示于式(5),合成相对不确定度计算示于式(6):
(5)
(6)
其中,uc,aver代表蛋白质浓度量值的合成标准不确定度;uc1和uc2分别代表2条肽段各自定值的合成标准不确定度;uc(aver,rel)代表合成相对不确定度。最后,扩展不确定度的计算示于式(7):
Uexp(rel)=k·uc(aver,rel)(k= 2)
(7)
按照上述公式计算,模拟样品和国际比对样品中hGH含量分别为(11.45±2.33) ng/g和(12.84±1.46 ) ng/g。
2.4.2B类不确定度评估 B类不确定度是由称量和hGH标准品引起的不确定度。使用ME235S型天平称量样品,天平的不精确度(0.01 mg)用于计算每次称量不确定度。样品不确定度估算列于表3。因此,每次称量不确定度的计算示于式(8):
(8)
hGH标准品的相对不确定度为2.1%,包含因子为2(由德国联邦物理技术研究院提供)。
基于以上计算模型,每次称量和hGH标准品的灵敏度系数计算示于式(9):
(9)
所有不确定度分量整合为B类不确定度,计算示于式(10):
(10)
因此,B类合成不确定的计算示于式(11)。式中:cmi表示δf/δxi,灵敏系数;umi表示称量的不确定度。
按照以上公式计算,国际比对样品中称量引起的不确定度为0.001 803。
(11)
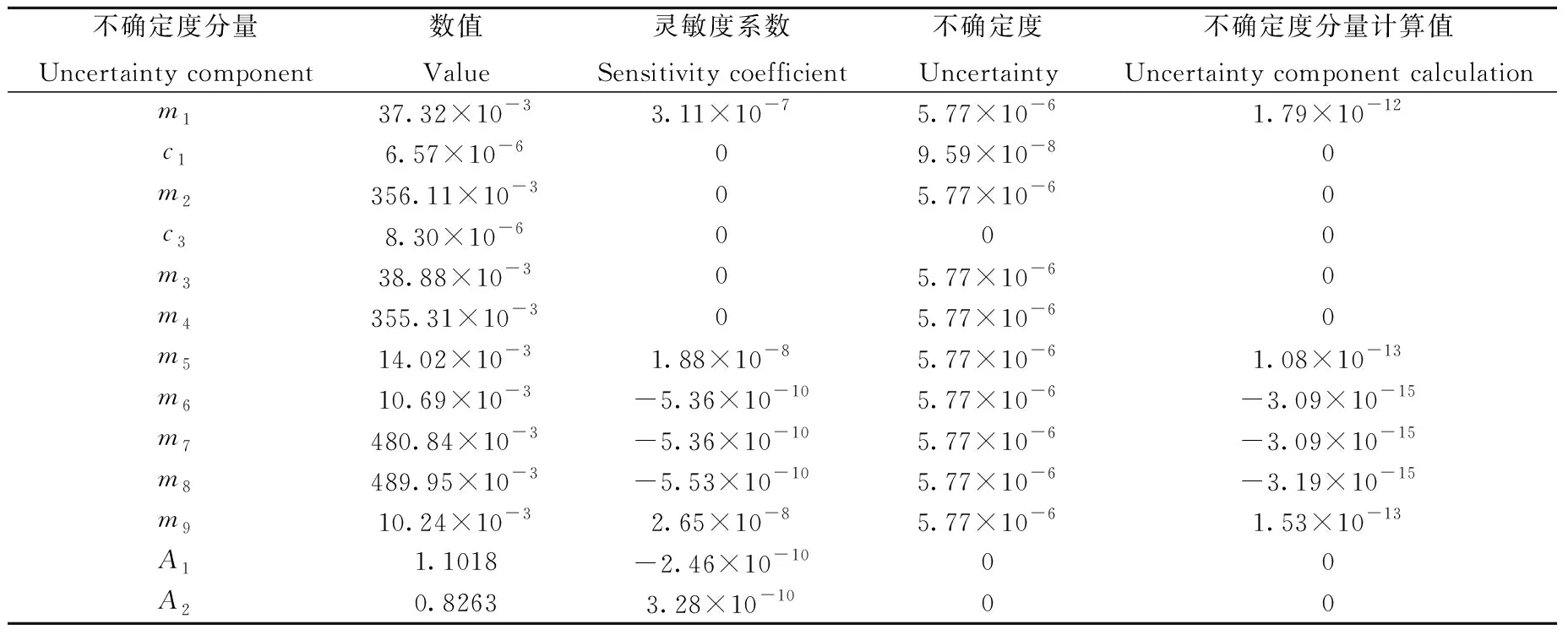
表3 样品不确定度估算Table 3 Uncertainty budget of sample (Type B)
3 结论
本研究以同位素标记蛋白质为内标,建立了离线二维高效液相色谱分离新策略,有效分离纯化了生长激素的特异性肽段,提高质谱检测信号强度,结合HPLC-IDMS法准确测量血清中生长激素含量。本研究提交的国际比对样品的定值结果(12.84±1.46 ) ng/g已覆盖了比对样品中生长激素理论值的划线结果(尚未公布定值结果)。该方法避免了免疫法中抗体特异性差异、结合效率差异、假阳性结果等问题,也避免了同位素标记肽段添加方法中蛋白质酶切引起的定量误差问题,提高了复杂基质中低丰度蛋白质定量分析的准确性和重复性,为推动蛋白质准确定量分析积累了经验,也为蛋白质类生物大分子标准物质研制奠定了基础。
