衣康酸衍生物通过调控肺上皮细胞趋化因子减轻急性肺损伤的研究
2021-04-02章晓辰李盈科
章晓辰 李盈科
急性肺损伤(acute lung injury, ALI)是以肺部炎症和肺泡毛细血管屏障破坏为特征的临床综合征,常继发于重症肺炎、脓毒症、严重创伤等疾病[1]。多种炎症细胞参与了ALI肺部炎症的发生、发展过程。中性粒细胞在清除肺部病原体的同时破坏了肺泡毛细血管屏障,甚至促使疾病进展为呼吸窘迫综合征。趋化因子在中性粒细胞、巨噬细胞的定向聚集过程中发挥重要作用。趋化因子CXCL15在小鼠黏膜上皮细胞中特异性表达[2],其与人类IL-8基因同源,在肺部发生炎症时对炎症细胞的聚集和浸润起到重要作用[3-4]。
衣康酸由免疫应答基因1(immune-responsive gene 1,IRG1)编码的顺乌头酸脱羧酶与三羧酸循环中的顺乌头酸发生脱羧反应而来,在活化状态的巨噬细胞中大量产生并分泌[5-6]。衣康酸可在巨噬细胞中发挥杀菌活性[7-8],还可以通过影响细胞因子的表达和炎症细胞的分化发挥重要的抗炎作用[9-11],但其是否对上皮细胞发挥作用尚不明确。二甲基衣康酸(DMI)和四辛基衣康酸(OI)是两种膜浸润性较强的衣康酸衍生物,在细胞培养过程中可以自由透过细胞膜,在细胞内发挥作用。 本研究利用小鼠肺上皮细胞系脓毒症模型,探索衣康酸对肺上皮细胞趋化因子的表达影响,对趋化因子介导的炎症细胞浸润的调节作用,以及其在脓毒症条件下的器官保护作用。
1 材料与方法
1.1 动物和细胞株来源与主要试剂 6~8周C57BL/6小鼠,购自海军军医大学实验动物中心[动物生产许可证号SCXK(沪)2012-0003,使用许可证号SYXK(沪)2012-0003]。小鼠Ⅱ型肺上皮细胞系MLE-12(CRL-2110)和人非小细胞肺癌细胞系A549(CCL-185)均购自美国模式菌种收集中心(ATCC)。脂多糖(LPS)购自美国Sigma公司;DMI购自阿拉丁试剂(上海)有限公司;OI购自美国Cayman Chemical公司;实时定量PCR引物购自上海生工生物科技有限公司;紫草素叶绿素(PerCP)标记的抗小鼠CD45抗体、藻红蛋白(PE)标记的抗小鼠CD11b抗体购自BioLegend公司。多聚甲醛、PBS等常用试剂均由海军军医大学医学免疫学研究所提供。
1.2 小鼠脓毒症模型的建立 采用数字表法将8只C57BL/6小鼠随机分为PBS组和LPS组,每组4只。LPS组小鼠予腹腔内注射5 mg/kg LPS,PBS组注射等量PBS。24 h后处死小鼠,收集其肺组织进行后续实验。
1.3 衣康酸衍生物干预LPS处理的肺上皮细胞 将MLE-12细胞培养于含2%的胎牛血清(FBS,购自美国Gibco公司)和1%的青霉素、链霉素、两性霉素溶液(购自美国Thermo Fisher公司)的DMEM/F12培养基中,置于37 ℃恒温箱培养24 h后换液,将细胞悬液接种于24孔板中,随机分为二甲基亚砜(DMSO)组、低浓度DMI组、高浓度DMI组、低浓度OI组、高浓度OI组,每组4孔。低浓度和高浓度衣康酸组分别加入终浓度为62.5 μmol/L和125 μmol/L的DMI或OI溶液,DMSO组加入等体积DMSO;3 h后,加入LPS(终质量浓度为10 mg/L),刺激6 h后收集细胞,提取细胞总RNA,继续后续实验。将A549细胞培养于含10%FBS(购自美国Gibco公司)和1%的青霉素、链霉素、两性霉素溶液的DMEM培养基, 置于37 ℃恒温箱培养24 h后换液,将细胞悬液接种于24孔板中,随机分为DMSO组、低浓度DMI组、高浓度DMI组,每组4孔,分别加入DMSO和终浓度为62.5 μmol/L、125 μmol/L DMI预处理3 h后,加入LPS(终质量浓度为10 mg/L);刺激6 h后收集细胞,提取细胞总mRNA,进行后续实验。
1.4 应用衣康酸衍生物干预小鼠肺损伤模型 采用数字表法将18只C57BL/6小鼠随机分为PBS组、DMI组、OI组,每组6只。 按照50 mg/kg分别计算DMI和OI的用量,用PBS配置成悬液。DMI组、OI组小鼠气管内滴注相应的药物悬液15 μL,PBS组气管内滴注等体积PBS。6 h后,所有小鼠予腹腔内注射LPS(5 mg/kg),饲养24 h。每组随机选取3只小鼠提取其支气管肺泡灌洗液,之后取所有小鼠肺组织,继续后续实验。
1.5 肺组织病理学检查 右下叶肺组织以4%多聚甲醛固定24 h。制备石蜡切片(厚度为4 μm),经H-E染色后置于光学显微镜下观察。以镜下肺泡壁宽度评估肺组织水肿情况,通过肺泡壁周围有核细胞密度评估炎症细胞浸润情况。
1.6 支气管肺泡灌洗液的获取和流式细胞术检测 各组小鼠经PBS或衣康酸衍生物预处理,腹腔内注射LPS 24 h后,用戊巴比妥钠麻醉小鼠,手术暴露气管,并插管。用2 mL PBS反复冲洗后吸出,置于eppendort管中;立即于4 ℃ 200×g离心5 min, 获取的细胞用1∶50加入荧光抗体的PBS重悬,并避光孵育10 min,再次离心(200 ×g,5 min, 4 ℃),并以100 μL PBS重悬后,使用流式细胞仪检测。
1.7 实时定量聚合酶链反应(PCR)检测 利用总RNA极速抽提试剂盒(上海飞捷生物技术有限公司)按照实验步骤提取各组MLE-12和A549细胞总RNA,置于-80 ℃保存至使用。对于每个样本,在20 μL反转录体系中,使用反转录酶M-MLV反转录1 000 ng RNA。实时定量PCR反应按照TB Green(日本TaKaRa公司)说明书混合转录模版、引物和试剂,进行定量PCR。以GAPDH作为内参对照,对比TNF-α、IL-6、CXCL15(或IL-8)mRNA相对表达量,引物序列见表1。

表1 引物序列
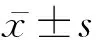
2 结 果
2.1 LPS诱导的脓毒症小鼠模型和肺上皮细胞模型特征 在LPS诱导的小鼠脓毒症模型中发现,LPS组小鼠肺部中性粒细胞浸润较PBS组明显,见图1。与未处理的MLE-12细胞(0 h)相比,LPS诱导小鼠MLE-12细胞3、6 h后,TNF-α、IL-6和CXCL15的mRNA相对表达量均显著升高(P值分别<0.01, 0.05)。见表2。

A PBS组 B LPS组图1 腹腔内注射LPS诱导脓毒症模型小鼠肺部炎症细胞浸润情况(H-E染色,×100)

表2 LPS诱导的各时间点MLE-12细胞各炎症因子mRNA相对表达量的比较
2.2 衣康酸衍生物降低LPS诱导的MLE-12细胞炎症因子mRNA表达量 低浓度和高浓度DMI组各细胞炎症因子mRNA相对表达量均显著低于DMSO组(P值均<0.01)。高浓度OI组各细胞炎症因子mRNA相对表达量均显著低于低浓度OI组和DMSO组(P值分别<0.01,0.05);低浓度OI组仅IL-6 mRNA相对表达量显著低于DMSO组(P<0.01)。见表3。

表3 两种衣康酸衍生物预处理后MLE-12细胞各炎症因子mRNA相对表达量的比较
2.3 DMI降低LPS诱导的A549细胞炎症因子mRNA表达量 低浓度DMI预处理后,A549细胞的TNF-α、IL-6、IL-8 mRNA相对表达量与DMSO组的差异无统计学意义(P值均>0.05)。高浓度DMI预处理的A549细胞的TNF-α、IL-6、IL-8 mRNA相对表达量均显著低于低浓度DMI组和DMSO组(P值分别<0.01、0.05)。见表4。

表4 DMI预处理后A549细胞各炎症因子mRNA相对表达量的比较
2.4 衣康酸衍生物经气管内给药减轻脓毒症模型小鼠肺损伤 观察小鼠肺脏大体标本发现,DMI组和OI组小鼠肺泡内出血面积均小于PBS组,见图2。H-E染色示:DMI和OI组小鼠肺组织肺泡内炎症细胞浸润水平均低于PBS组,见图3。
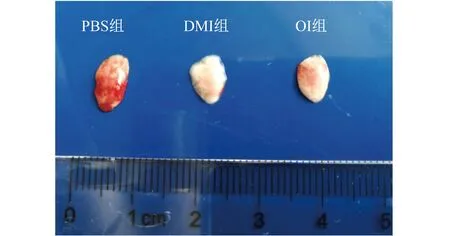
图2 不同预处理的脓毒症模型小鼠肺部损伤情况
各组小鼠的肺泡灌洗液流式细胞术检测示:DMI组和OI组小鼠肺泡灌洗液中CD11b阳性细胞(中性粒细胞)分别占总细胞数的(41.467±6.850)%和(39.767±9.393)%,均较PBS组的(65.433±5.179)%显著降低(P值均<0.05),见图4。

A PBS组 B DMI组 C OI组图4 不同预处理的脓毒症模型小鼠肺泡灌洗液中CD11b阳性细胞比例
3 讨 论
中性粒细胞参与肺部炎症的发生与发展,而过度的中性粒细胞浸润,可能引起上皮细胞和内皮细胞的死亡[12],加重局部组织损伤。趋化因子对炎症条件下中性粒细胞的局部定向性聚集有重要影响,尤其是IL-8(小鼠体内表达为CXCL15)在肺黏膜等部位表达水平较高[2],在局部炎症趋化反应中发挥重要的作用。 所以,限制中性粒细胞的过度聚集,维持适当的组织炎症反应程度,在控制ALI的发展中可能发挥重要的作用。
经组织病理学检查发现,LPS诱导的脓毒症模型小鼠肺脏出现了明显的炎症细胞浸润。在小鼠MLE-12细胞系中也观察到,细胞系经LPS诱导3、6 h后,TNF-α、IL-6和CXCL15 mRNA相对表达量即明显升高,说明在脓毒症的早期,上皮细胞即可对炎症细胞有直接的趋化作用,诱导中性粒细胞聚集,从而使ALI的发生成为可能。
衣康酸除可在小鼠巨噬细胞内发挥免疫调控的作用外,在整个免疫调节过程中也发挥着重要的作用。作为线粒体能量代谢和细胞免疫功能之间的桥梁[10],衣康酸可作用于包括Kelch样环氧氯丙烷相关蛋白-1(Keap1)-核因子E2相关因子2(Nrf2)[6]、IκBζ-ATF3[7]等通路,调节巨噬细胞免疫功能[8],发挥抗炎作用。同时,衣康酸被发现对体内组织有一定的抗氧化作用,衣康酸预注射可以缩小心肌缺血小鼠模型心肌梗死的面积[8],提示衣康酸存在潜在的器官保护作用。IRG1不仅仅在活化状态下的巨噬细胞、小胶质细胞等免疫细胞中表达;在病毒感染的肺组织、神经元,甚至妊娠期的子宫内膜细胞中,IRG1的表达水平也有提高[13-18];这些都提示了IRG1和衣康酸不仅表达于免疫细胞,同时也在实质细胞的病理生理过程中表达,并可能发挥作用。
本研究使用DMI和OI预处理MLE-12和A549细胞系,小鼠气管内滴注衣康酸衍生物,以探索衣康酸在ALI中的作用。结果发现,虽然LPS可诱导肺上皮细胞炎症细胞因子和趋化因子mRNA相对表达量增加,但两种衣康酸衍生物均对LPS诱导的炎症有抑制作用;并且,OI在较高浓度下(125 μmol/L)可以降低CXCL15 mRNA的表达,而DMI在较低浓度下(62.5 μmol/L)即可发挥炎症抑制作用。在后续的小鼠体内实验中,经气管内给予DMI或OI的小鼠在LPS诱导后肺出血面积较小、肺上皮毛细血管屏障破坏较少,肺泡内炎症细胞浸润程度较低。经肺泡灌洗液细胞组成比例分析验证,经DMI或OI处理的小鼠肺泡灌洗液中,中性粒细胞的比例均较对照组显著下降。
综上所述,在肺泡内局部应用衣康酸衍生物可以减少脓毒症小鼠肺泡内炎症细胞的聚集和浸润,其机制可能与衣康酸衍生物可以减少肺上皮细胞在脓毒症条件下细胞因子和趋化因子的表达相关。说明了衣康酸在脓毒症或全身炎症反应的发生和发展过程中具有潜在的器官保护作用。
