1.5T及3.0T MR T2 mapping技术定量鉴别子宫良恶性肿瘤
2021-04-01朱柳红路伟宏成启华周建军
朱柳红,路伟宏,刘 豪,成启华,周建军*
(1.复旦大学附属中山医院厦门医院放射科,2.妇科,福建 厦门 361015;3.厦门医学院附属第二医院放射科,福建 厦门 361021)
子宫平滑肌瘤及腺肌症是女性妇科肿瘤中最常见的良性肿瘤。子宫恶性肿瘤中,宫颈癌及子宫内膜癌发病率较高[1],严重影响女性生活,甚至威胁其生命[2]。诊断性刮宫和子宫内膜细胞学检查为早期筛查肿瘤方法,但对于评估肿瘤价值受限[3]。MR具有无辐射、软组织分辨率高且可多序列成像等优点,是诊断及评估子宫肿瘤的最优影像学方法之一,但通常依据病灶形态、信号及增强方式进行诊断,具有主观性[4]。T2 mapping成像技术为定量成像技术,且无需注射对比剂,逐渐用于子宫肿瘤相关研究[5]。本研究对比1.5T与3.0T场强下T2 mapping技术量化鉴别子宫良恶性肿瘤的效能。
1 资料与方法
1.1 研究对象 纳入2019年8月—2020年2月73例复旦大学附属中山医院厦门医院子宫肿瘤患者,年龄26~76岁,平均(46.3±11.4)岁;共82个子宫病灶,包括56个良性及26个恶性病灶。纳入标准:首次经病理学诊断为子宫肿瘤,且未经任何临床治疗。排除标准:①伪影导致图像质量差;②子宫肌瘤变性;③病灶<1.0 cm。同期招募34名健康育龄期妇女,年龄28~43岁,平均(34.5±7.6)岁,经超声检查子宫及附件无明显异常。本研究经院伦理委员会批准(伦理编号:Y2020-003),检查前受试者均签署知情同意书。
1.2 仪器与方法 采用Siemens Amira 1.5T及GE Discovery 750w 3.0T MR扫描仪,于经期结束后第2~3天对患者行1.5T及3.0T腹部仰卧位 T2 mapping、平扫及增强扫描;对健康受试者仅行T2 mapping扫描。
1.2.1 1.5T MR 采用13通道腹部相控阵线圈,采集轴位T2WI、脂肪抑制T2WI及矢状位脂肪抑制T2WI,TR 4 300 ms,TE 86 ms,层厚4.0 mm,层间距0.8 mm,视野240 mm×240 mm,矩阵320×224;行轴位弥散加权成像,TR 3 600 ms,TE 67 ms,层厚4.0 mm,层间距0.8 mm,视野240 mm×240 mm,矩阵112×112,b值0, 50, 800 s/mm2。轴位自旋回波(spin echo, SE)T2 mapping序列,层厚4.0 mm,层间距0.8 mm,视野250 mm×250 mm,TR 2 000 ms,TE(n=9):11.1,22.2…11.1×n,FA 180°,矩阵256×192,平均采集次数1,层数15,采集时间为4 min 22 s;再行轴位三维容积内插屏气检查(three-dimensional volumetric interpolated breath-hold examination, 3D-VIBE)。之后行动态增强扫描,经静脉注射钆喷酸葡胺注射液,剂量0.2 ml/kg体质量,流率2 ml/s,分别于对比剂注射后30、60、90、120及150 s行动脉期轴位、静脉期轴位、静脉期矢状位、静脉期冠状位及延迟期轴位扫描,TR 5.12 ms,TE 2.38 ms,层厚3.0 mm,层间距0.6 mm,视野350 mm×350 mm,矩阵320×240。
1.2.2 3.0T MR 采用16通道腹部相控阵线圈,常规序列及扫描顺序同上。轴位SE T2 mapping:TR 1 500 ms,TE(n=9):11.1、22.2…88.8、99.9 ms,层厚4.0 mm,层间距0.8 mm,视野250 mm×250 mm,矩阵288×192,平均采集次数1,层数18,采集时间为5 min 15 s。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示符合正态分布的计量资料,采用独立样本t检验进行比较;以中位数(上下四分位数)表示不符合正态分布的计量资料,采用Mann-WhitneyU检验比较。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,比较曲线下面积(area under the curve, AUC),评价不同场强下T2值鉴别良恶性肿瘤的效能。P<0.05为差异具有统计学意义;P<0.01为差异具有显著统计学意义。
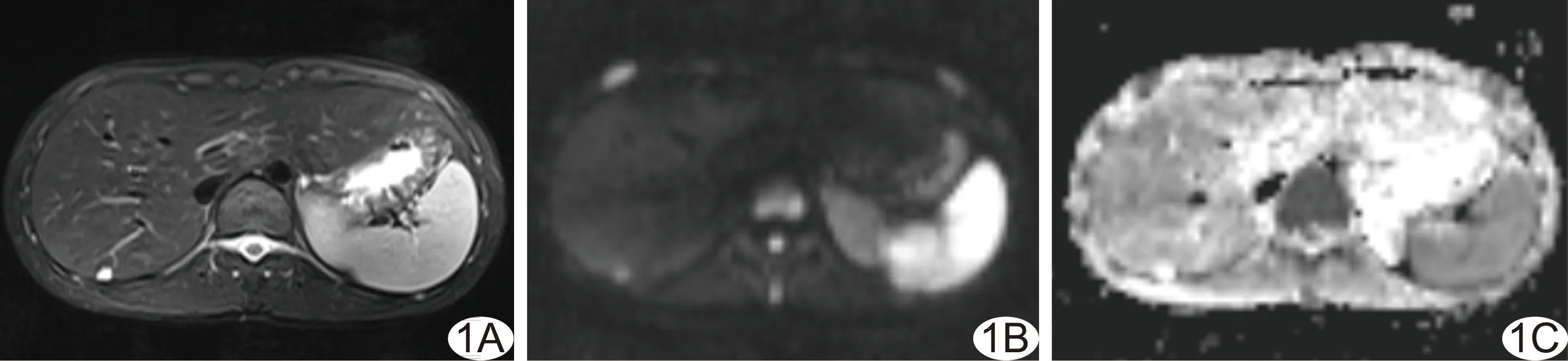
图1 健康受检者,女,42岁,子宫结合带ROI不同场强下信号拟合曲线图 A.1.5T MRI信号拟合曲线计算T2值为51.95 ms; B.3.0T MRI信号拟合曲线计算T2值为48.60 ms (圆点为不同TE下的SI)
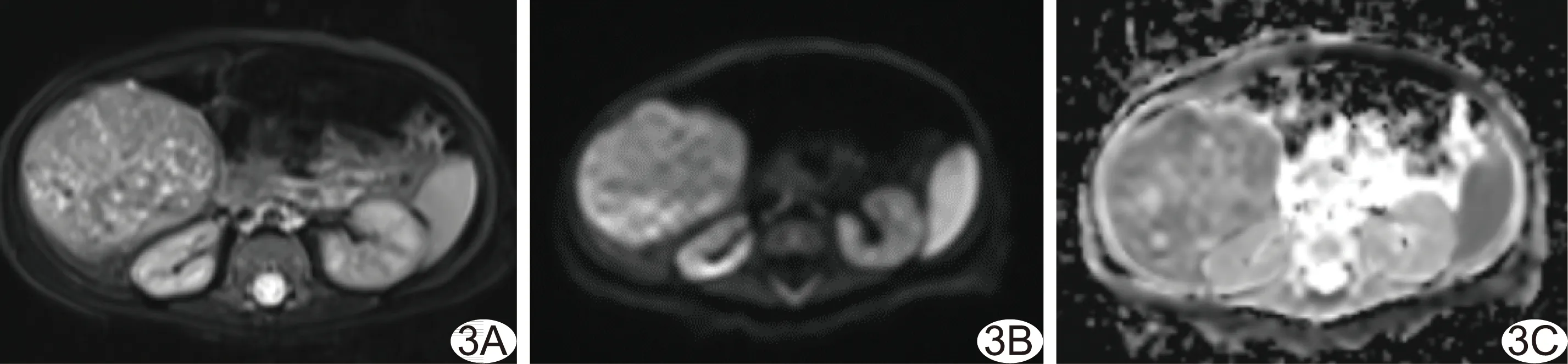
图2 不同场强下正常子宫结构及周边肌肉脂肪T2值对比图 注:*:P<0.05;#:P<0.01 图3 不同场强下子宫良恶性肿瘤T2值对比图 注:#:P<0.01
2 结果
82个子宫肿瘤中,16个腺肌症病变,28个肌瘤,12个黏膜下息肉,15个宫颈癌及11个子宫内膜癌。对健康受试者共采集子宫内膜、外肌层、臀大肌和皮下脂肪ROI各34个,结合带33个。
2.1 不同场强下子宫正常结构及周边肌肉脂肪T2值 1.5T MRI所示子宫正常结构及周边肌肉脂肪T2值均高于3.0T(P均<0.05)。于1.5T MRI测得皮下脂肪的T2值最高,为(134.45±4.38)ms,其次为子宫内膜[(110.41±6.40)ms]和外肌层[(78.96±6.82)ms],臀大肌[(51.46±4.98)ms]和结合带[(50.46±5.81)ms]T2值较为接近。于3.0T MRI测得的组织T2值变化趋势与1.5T一致,由高到低依次为皮下脂肪[(100.48±2.33)ms]、子宫内膜[(95.20±2.30)ms]、外肌层[(75.26±3.17)ms]、臀大肌[(43.47±1.89)ms]及结合带[(47.67±2.45)ms],见图2。
2.2 不同场强下子宫肿瘤T2值 1.5T MRI子宫肿瘤T2值均高于3.0T(P均<0.01)。于1.5T MRI测得子宫内膜癌T2值[(103.79±3.78)ms]最高,其次为宫颈癌[(97.91±2.71)ms]、黏膜下息肉[85.70(83.50,92.60)ms)]和腺肌症[(72.20±4.79)ms],肌瘤[(47.92±4.86)ms]T2值最小。3.0T MRI所示子宫病变T2值变化趋势与1.5T一致,自高至低依次为子宫内膜癌[(97.04±3.48)ms]、宫颈癌[(89.37±5.48)ms]、黏膜下息肉[(72.06±4.74)ms]、腺肌症[(65.21±4.41)ms]及肌瘤[(42.92±3.91)ms],见图3。
2.3 良恶性肿瘤T2值对比 1.5T及3.0T MRI测得子宫良性肿瘤T2值均显著低于恶性肿瘤(P均<0.01),见表1及图4、5。1.5T及3.0T MRI鉴别良恶性肿瘤的AUC分别为0.967和0.999,差异无统计学意义(P=0.16);截断值为93.24 ms和79.28 ms时,敏感度均为100%,特异度分别为96.36%和98.18%,见图6。

表1 不同场强下子宫良恶性肿瘤T2值对比(ms)
3 讨论
随着MR技术及大数据的快速发展,如何定量评价病灶逐渐成为MR研究热点[6]。横向、纵向弛豫时间及质子密度均是反映组织固有特性的参数值,对相关研究的意义较大[7]。作为横向弛豫时间的定量成像技术,既往T2 mapping技术较多用于骨关节炎[8]及软骨损伤[9]等研究,近年逐渐用于定量评价恶性肿瘤,如前列腺癌[10]及乳腺癌[11]等。
本研究T2 mapping成像采用SE序列,在1个TR时间内采集2个及2个以上回波,信噪比高,采集时间短,是T2 mapping成像的首选方法[12]。本研究中,1.5T下子宫正常结构及周边肌肉脂肪T2值均高于3.0T(P均<0.05),与组织T2值随场强升高而降低的规律相符,提示这2种场强下采用T2 mapping技术可量化并区分正常组织。
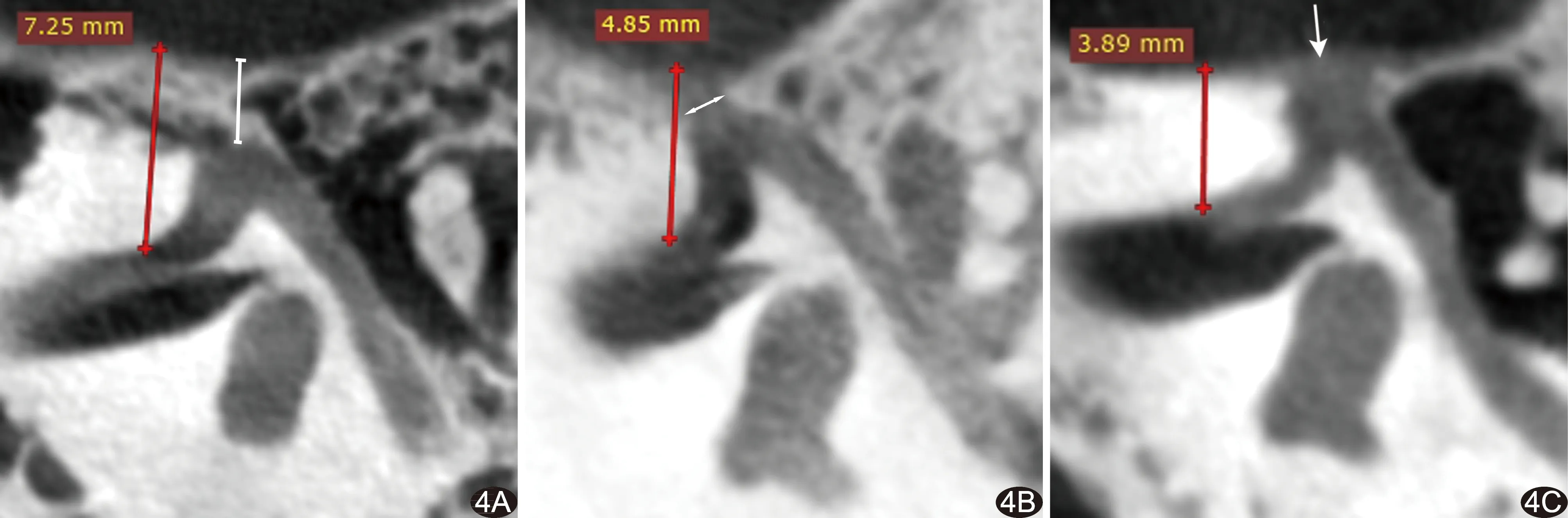
图4 患者女,42岁,子宫肌瘤 A.轴位脂肪抑制MR T2WI; B.轴位T2 mapping伪彩图,T2值为47.68 ms (箭示病灶) 图5 患者女,65岁,宫颈癌 A.轴位脂肪抑制MR T2WI; B.轴位T2 mapping伪彩图,T2值为96.97 ms (箭示病灶)
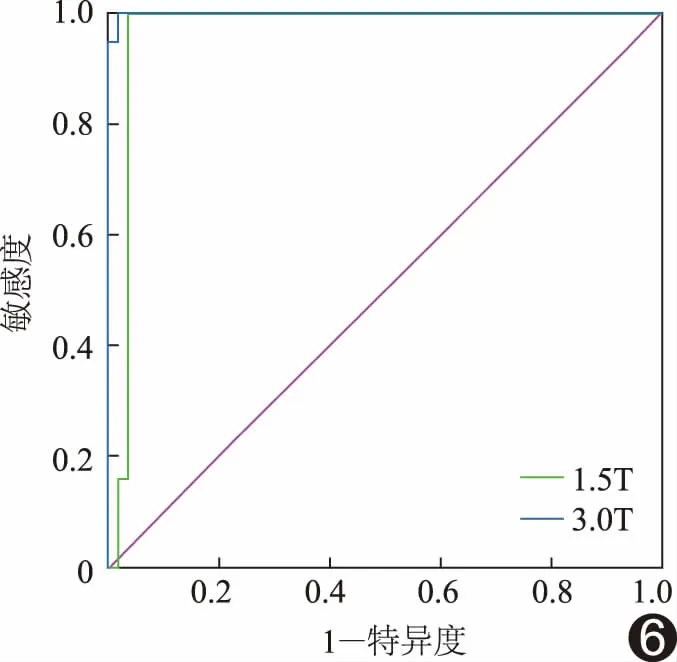
图6 不同场强下良恶性肿瘤T2值的ROC曲线图
本研究中1.5T及3.0T场强下子宫内膜癌T2值均最高,其次为宫颈癌、黏膜下息肉及腺肌症,肌瘤的T2值最小。子宫内膜癌是来源于内膜的上皮性恶性肿瘤,由类似正常子宫内膜的腺体组成,腺上皮出芽增生缠结成簇状;本研究中子宫内膜癌T2值稍低于正常内膜。宫颈癌细胞是宫颈不成熟细胞在分化过程中异常增生或分化不良产生,本研究中宫颈癌T2值为(89.37±5.48)ms(3.0T),与李淑健等[5]的结果相似。子宫内膜息肉由内膜局部过度增生所致,由间质、管壁较厚的血管及内膜腺体组成,其T2值来自以上三者的共同作用。 本组子宫内膜息肉T2值低于子宫内膜癌及宫颈癌。腺肌症病变是子宫内膜腺体和间质侵入肌层形成的弥漫或局限性病变,常伴有陈旧性出血点,其T2值综合反映内膜腺体、间质、肌层及含铁血黄素,稍低于外肌层。子宫肌瘤主要由增生的子宫平滑肌细胞及少量纤维结缔组织组成,其T2值稍低于正常臀大肌,与其成分较为吻合。
本研究中,1.5T及3.0T MR下良性肿瘤T2值均显著低于恶性肿瘤(P均<0.01),T2值鉴别子宫良恶性肿瘤的AUC分别为0.967和0.999,差异无统计学意义(P>0.05),表明T2值在不同场强下鉴别子宫良恶性肿瘤的效能较为稳定。
本研究的局限性:①恶性肿瘤病例数较少,且未能按病理分型进一步分类分析;②健康受检者结果仅供育龄期妇女参考;③未与其他定量技术对照分析。
综上,根据1.5T及3.0T下T2 mapping技术所测T2值可量化鉴别子宫良恶性肿瘤,并作为常规T2WI的重要补充。
