胰腺实体-假乳头状肿瘤32例临床病理分析及TFE3表达的诊断价值
2021-04-01魏建国岑红兵秦灵芝敖启林
曹 钟,魏建国,岑红兵,秦灵芝,廖 伟,敖启林
实性-假乳头状肿瘤(solid-pseudopapillary neoplasms, SPN)是一种罕见的组织学发生不明,具有低度恶性潜能的胰腺肿瘤。SPN占胰腺外分泌肿瘤的1%~2%,患者多为年轻女性,可发生于胰腺的任何部位。SPN形态学与其他类型的胰腺实体肿瘤形态极为相似,免疫表型与胰腺神经内分泌肿瘤(neuroendocrine tumor, NET)发生重叠,两者均表达神经内分泌标记;胰腺腺泡细胞癌(acinar cell carcinoma, ACC)也与SPN有相似的形态学特征及免疫表型,诊断与鉴别诊断较为困难。由于胰腺SPN与NET、ACC的治疗方式和预后均有较大差异,因此准确诊断SPN显得尤为重要。近年有学者发现转录因子E3(transcription factor E3, TFE3)在SPN中呈高表达,具有一定的诊断价值,且SPN由上皮向间质及神经内分泌分化。本文采用免疫组化法检测32例胰腺SPN和40例胰腺非SPN中TFE3、β-catenin、CD10、CK、vimentin、Syn、CD56、AR、PR的表达,比较上述标志物在诊断胰腺SPN中的应用价值,以提高诊断准确率。
1 材料与方法
1.1 材料收集2010年8月~2018年6月湖北省黄冈市中心医院、浙江省绍兴市人民医院和华中科技大学同济医学院附属同济医院手术切除32例胰腺SPN和40例非SPN,其中胰腺非SPN包含17例NET、15例导管腺癌(duct adenocarcinoma, DACC)、3例ACC、3例神经内分泌癌(neuroendocrine carcinoma, NEC)和2例胰母细胞瘤,将胰腺非SPN作为对照组。诊断标准参考WHO(2010)消化系统肿瘤分类[1],由两名高年资病理医师复核。
1.2 方法所有标本均经10%中性福尔马林固定,包埋,连续3~4 μm厚切片,HE染色。采用免疫组化EnVision两步法检测,一抗TFE3(EPR11591,稀释度1 ∶250)兔单克隆抗体购自美国Abcam公司;β-catenin、CD10、CK、vimentin、Syn、CD56、AR、PR,均购自北京中杉金桥公司。二抗和DAB试剂盒购自Dako公司。抗体均经10 mmol/L枸橼酸缓冲液(pH 6.0)高压抗原修复,具体操作步骤按试剂盒说明书进行。TFE3用已知阳性软组织颗粒细胞瘤作阳性对照,用PBS代替一抗作阴性对照。
1.3 结果判断染色强度进行半定量分级,根据TFE3在肿瘤细胞核中呈黄色、棕黄色颗粒为阳性。观察每张切片10个具有代表性的高倍视野,计算肿瘤细胞数,阳性结果评分标准:0~5%为(-),6%~50%为(+),51%~100%为()。
1.4 统计学分析所有数据均采用SPSS 17.0软件进行统计学分析。抗体在胰腺SPN和非SPN中阳性率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床特点32例胰腺SPN中,男性5例,女性27例;年龄18~34岁,中位年龄24岁,平均27岁;肿瘤直径4.6~8.5 cm;其中肿瘤位于胰头6例、胰体16例、胰尾10例;4例发生出血、囊性变;5例发生周围组织侵犯;3例发生转移。8例患者有腹痛、腹胀等症状,12例体检时被偶然发现。
2.2 病理检查32例胰腺SPN包括28例经典型和4例透明细胞变异型。经典型SPN见肿瘤境界清楚,肿瘤组织与正常胰腺组织被纤维组织分隔;部分病例可见肿瘤组织伸入周围正常的胰腺组织。肿瘤主体由实性区、假乳头区及退变区按不同比例构成(图1)。实体区见肿瘤细胞呈巢片、条索及腺管状排列,被纤维血管分隔,未见促纤维反应。肿瘤细胞呈圆形或椭圆形,大小形态一致,胞质少,核圆形,未见异型、可见核沟。假乳头区见肿瘤细胞排列成单层或多层,围绕纤维血管轴心形成假乳头状结构,细胞形态与实体区相似,其中6例完全缺乏假乳头状区。退变区可见陈旧性出血、坏死、胆固醇结晶沉积及退变引起的囊性变。透明细胞变异型SPN见肿瘤细胞被玻璃样变的纤维组织分隔成梁状、条索状及巢片结构,缺乏假乳头状结构,细胞质透明,其内见大小不一的胞质空泡(图2),空泡不含糖原、脂类及黏蛋白。
2.3 免疫表型32例胰腺SPN和40例胰腺非SPN均不同程度表达CK、vimentin、Syn、CD56、AR、PR、β-catenin(图3)、CD10(图4)。CK在诊断胰腺SPN中的敏感性为50.0%,特异性为22.5%;vimentin的敏感性为78.1%,特异性为67.5%;Syn的敏感性为75.0%,特异性为55.0%;CD56的敏感性为84.4%,特异性为50.0%;AR的敏感性为75.0%,特异性为70.0%;PR的敏感性为68.8%,特异性为62.5%;β-catenin的敏感性为96.9%,特异性为92.5%;CD10的敏感性为96.9%,特异性为85.0%。所有标志物在胰腺SPN和非SPN之间的阳性率,差异均有显著性(P均<0.05,表1)。
2.4 胰腺肿瘤中TFE3的表达TFE3的阳性信号位于肿瘤细胞核(图5、6),32例胰腺SPN中有28例呈弥漫强阳性,4例呈局部阳性,阳性率为100.0%(32/32);40例胰腺非SPN中TFE3多呈阴性,仅3例NET、1例NEC和1例ACC中TFE3呈阳性,阳性率为12.5%(5/40);TFE3在两组间的差异有显著性(P<0.001),TFE3对诊断SPN的敏感性和特异性分别为100.0%和87.5%。在胰腺SPN中联合检测TFE3+β-catenin,两者同时为阳性的比率为96.9%(31/32);在胰腺非SPN中,两者同时为阳性的比率为5%(2/40),两组间差异有显著性(P<0.001),对诊断胰腺SPN的敏感性和特异性分别为96.9%和95.0%。在胰腺SPN中联合检测TFE3+CD10,两者的阳性率为96.9%(31/32);在胰腺非SPN中,两者的阳性率为2.5%(1/40),两组间的差异具有显著性(P<0.001),对诊断胰腺SPN的敏感性和特异性分别为96.9%和97.5%。在胰腺SPN中联合检测TFE3+β-catenin+ CD10,三者的阳性率为93.8%(30/32);在胰腺非SPN中,三者的阳性率为0(0/40),三者在两组间的差异有显著性(P<0.001),对诊断胰腺SPN的敏感性和特异性分别为93.8%和100.0%(表1)。
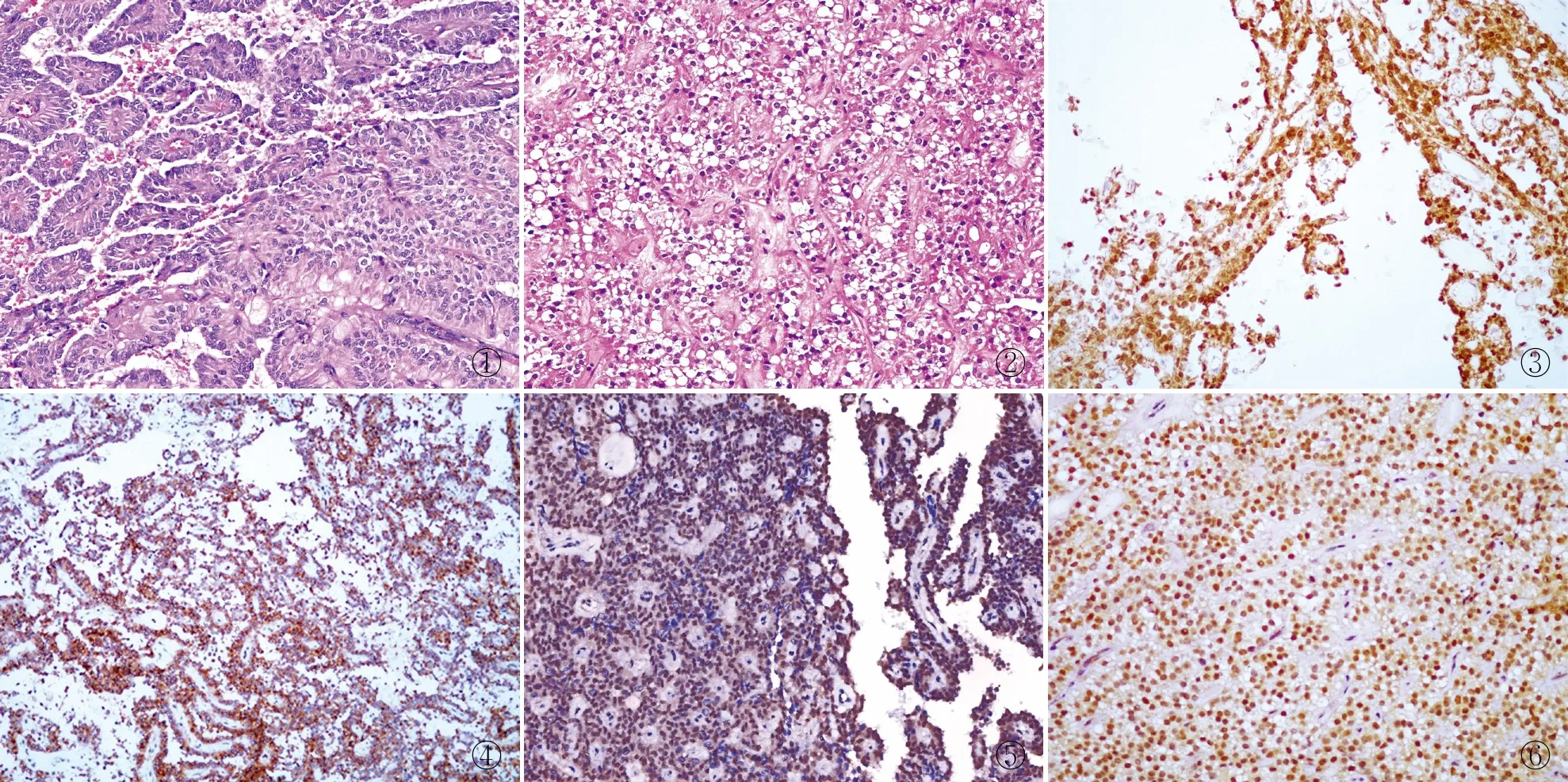
图1 经典型实性-假乳头状肿瘤由假乳头区和实体区构成 图2 透明细胞型实性-假乳头状肿瘤由实体区构成,胞质透明,内见大小不一的胞质空泡 图3 肿瘤细胞β-catenin呈阳性,EnVision两步法 图4 肿瘤细胞CD10呈阳性,EnVision两步法 图5 乳头状区TFE3呈阳性,EnVision两步法 图6 实体区TFE3呈阳性,EnVision两步法
3 讨论
1959年胰腺SPN由Frantz首先报道,是一种具有恶性潜能的少见肿瘤。WHO(2010)消化系统肿瘤分类将该肿瘤正式命名为胰腺SPN[1]。WHO(2019)消化系统肿瘤分类正式加入SPN伴高级别癌亚型[2]。SPN发病率低,约90%的患者为年轻女性(20~30岁),男性罕见[2-3]。临床症状不明显,多为体检偶然发现。其可发生于胰腺的任何部位,常被误诊为胰腺无功能NET。患者多表现为孤立性病变不伴转移,少数为多发,以胰尾多见。手术切除后5年生存率大于95%。虽然WHO(2010)消化系统肿瘤分类将SPN定义为低度恶性潜能的肿瘤,但是越来越多的研究表明其具有肿瘤异质性[4]。胰腺SPN约18.3%的成人患者和43.1%的青少年患者,易发生周围器官侵犯和远处转移的恶性行为,目前仍缺乏预测恶性行为的诊断标准[5]。治疗方式以手术切除为主,转移患者术后辅以多学科综合治疗方式仍可获得满意的效果,总体预后优于NET[6],后者的生物学行为比胰腺SPN更差,恶性程度较高,易发生复发和转移。
典型的胰腺SPN由实性区、假乳头状区及退变区按不同比例构成。SPN的细胞形态呈一致性圆形或卵圆形,形状与NET肿瘤细胞类似。SPN中的假乳头状结构及腺样结构与NET中的腺样结构、假菊形团结构、菊形团及DACC中的乳头状结构、筛网状结构也极为相似。SPN中的实体区与NET中的梁状结构、脑回结构以及ACC中的实体形态难以鉴别。部分ACC也可表达AAT和神经内分泌标记,因此与SPN免疫表型有重叠。少数SPN病例则完全缺乏典型的假乳头状区增加了误诊率。透明细胞亚型SPN主要由实体区构成,而缺乏假乳头状区,肿瘤细胞质透明,含有多个大小不一的胞质空泡,空泡内不含糖原、脂类及黏蛋白,被认为是由经典型SPN转化而来,但是形成机制尚未完全阐明;免疫表型与经典型SPN类似,表达CK、CD10、CD56、CD99、Syn、CgA和β-catenin等标志物。透明细胞变异型SPN与含有透明细胞形态的NET较难鉴别,透明细胞变异型SPN与透明细胞亚型DACC、转移性肾细胞癌及异位肾上腺肿瘤也易混淆,部分免疫表型类似。因此,需采用高敏感性和特异性的免疫组化标志物进行鉴别。
WHO(2000)消化系统肿瘤根据病理和遗传学特征将SPN分为胰腺外分泌肿瘤的上皮肿瘤,有学者认为其可能来源于胰腺导管、内分泌腺及原始的胰腺细胞,但发生机制尚不清楚。分子生物学研究表明:约90%的SPN发生CTNNB1基因中的外显子3发生突变,上调的基因激活Wnt/β-catenin、Notch、Hedgehog和雄激素受体信号通路,它们参与SPN的形成,并由上皮-间质细胞转化,同时向神经嵴细胞分化[2,7]。本组对32例胰腺SPN和40例胰腺非SPN同时检测上皮、间质、神经内分泌及性激素标志物:CK、vimentin、Syn、CD56、AR及PR,结果显示它们均可在SPN中呈一定程度的表达,支持上述SPN的组织学转化及分化。CTNNB1基因表达的β-catenin蛋白被认为是Wnt/β-catenin信号通路的黏附分子,采用免疫组化检测β-catenin在SPN呈核/质表达有助于诊断,仅有少数的NET和胰母细胞瘤也可以呈β-catenin核/质表达。本实验结果显示:β-catenin在胰腺SPN中的阳性率为96.9%(31/32);而在胰腺非SPN中的阳性率为7.5%(3/40);提示Wnt/β-catenin是SPN独特的信号通路。文献报道[8]已经证实起黏附作用的紧密连接蛋白Claudin5和Claudin7,有助于鉴别SPN和NET。
TFE3属于转录因子中的(microphthalmia-associated transcription factor, MiT)家族成员,包括4个癌基因:MITF、TFEB、TFE3和TFEC,其中TFE3基因还参与溶酶体、自噬体的生物合成以及细胞碎片的清除[9]。通过免疫组化检测TFE3,可与Xp11.2移位/TFE3基因融合的肾细胞癌、腺泡状软组织肉瘤、血管周上皮样细胞肿瘤及软组织颗粒细胞瘤进行鉴别。有多项研究表明MiT家族成员参与肿瘤的Wnt/β-catenin细胞信号转导。在黑色素瘤细胞系中,MITF和TFE3的过表达改变溶酶体合成途径,抑制肿瘤细胞衰老,并且通过增加Wnt信号的负调节蛋白 —— 破坏复合部件蛋白Axin1和GSK3在多囊体(multivesicular bodies, MVB)中的固存来增强Wnt细胞信号,导致MITF的稳定性提高[10-11]。ASPL-TFE3基因融合的腺泡状软组织肉瘤和Xp11.2移位/TFE3基因融合的肾细胞癌中,TFE3的过表达可能也有Wnt/β-catenin信号参与[12]。近期有学者发现TFE3在胰腺SPN中呈过表达,阳性率为94.7%,其中78.7%呈中等阳性或强阳性,而23.5%的NET和14.3%的DACC呈局部弱阳性,ACC均未见TFE3阳性信号,SPN与其他肿瘤的阳性率差异有显著性(P<0.05)[13]。有学者发现TFE3在SPN中的敏感性为97%、特异性为90%,17例SPN均未见TFE3基因扩增[14]。本实验TFE3在胰腺SPN中呈肿瘤细胞核阳性,阳性率为100%(32/32),其中28例呈弥漫强阳性,4例呈局部阳性;胰腺非SPN中,TFE3在3例NET、1例ACC和1例NEC中呈阳性,阳性率为12.5%(5/40);TFE3在两组间比较,差异有显著性(P<0.001),TFE3对诊断SPN的敏感性和特异性分别为100.0%和87.5%。本组还发现:在胰腺SPN中,联合检测TFE3+β-catenin+CD10共阳性率为93.8%(30/32);在胰腺非SPN中,三者共阳性率为0(0/40),两组间比较差异有显著性(P<0.001),TFE3+β-catenin+CD10对诊断胰腺SPN的敏感性和特异性分别为93.8%和100.0%。联合检测TFE3+β-catenin,对诊断胰腺SPN的敏感性和特异性分别为96.9%和95.0%;联合检测TFE3+CD10,对诊断胰腺SPN的敏感性和特异性分别为96.9%和97.5%。本实验结果显示联合检测TFE3+ β-catenin+CD10,其敏感性和特异性均较高,是理想的免疫组化标志物组合。
综上所述,TFE3在胰腺SPN中呈肿瘤细胞核阳性是其独特的免疫表型,联合检测β-catenin+CD10可以提高其敏感性和特异性,联合检测TFE3+β-catenin+CD10可以作为诊断胰腺SPN的重要标记。
