结直肠腺癌中TKT的表达及临床意义
2021-04-01高婉婉张伟璇李佳嘉
张 伟,高婉婉,宋 红,张伟璇,李佳嘉,张 帆
2018年全球癌症报告显示,结直肠癌约1 810万新发病例和960万死亡病例,位居癌症发病率的第3位,病死率的第2位[1]。随着经济增长和生活水平提高,结直肠癌已严重威胁人类生命健康。目前,手术切除和辅助化疗是结直肠癌的主要治疗方法,结直肠癌中相关分子靶向治疗进展缓慢,肿瘤的复发和转移仍是导致患者死亡的主要原因。因此,迫切需要深入探索结直肠癌的分子机制,寻找有效的诊断和治疗靶点。近年,肿瘤能量代谢异常引起广泛关注。转酮醇酶(transketolase, TKT)是戊糖磷酸途径(pentose phosphate pathway, PPP)非氧化阶段的关键酶。TKT参与多种恶性肿瘤的发生、发展,如在肝细胞癌[2]、食管癌[3]、卵巢癌[4]、子宫颈癌[5]等肿瘤中均检测出高表达。现阶段TKT在结直肠癌组织中的表达及与临床病理特征的关系尚不清楚。本文通过Oncomine及GEO数据库分析TKT基因在结直肠腺癌和癌旁组织中的表达,采用qRT-PCR和Western blot法检测结直肠腺癌组织和细胞样本中TKT的表达量,运用免疫组化检测结直肠腺癌石蜡组织中TKT的表达,着重探讨其与临床病理特征的相关性及临床意义。
1 材料与方法
1.1 材料收集2019年10月~2020年10月皖南医学院第一附属医院/弋矶山医院病理科行结直肠腺癌根治术的92例浸润性腺癌及配对癌旁正常组织石蜡标本,其中男性51例,女性41例,患者年龄21~86岁,中位年龄52岁。所有病例均经两位高年资病理医师阅片确诊。
1.2 方法
1.2.1数据库分析 利用Oncomine(https://www.oncomine.org/resource/)数据库分析TKT在肿瘤(包括结直肠腺癌)中的表达;利用GEPIA(http://gepia.cancer-pku.cn/detail.php)数据库大样本分析TKT在结直肠腺癌组织和癌旁组织中表达差异;应用GEO公共数据库(https://www.ncbi.nlm.nih.gov/gds/)分析17例结直肠腺癌组织及配对癌旁组织中TKT的表达。
1.2.2RNA提取和qRT-PCR 使用TRIzol试剂(日本Takara公司)提取总RNA,根据说明书利用Takara逆转录试剂盒进行逆转录。使用SybrGreen qPCR Mix(德国DBI公司)试剂盒,在ABI 7500荧光定量仪完成27例新鲜结直肠腺癌组织及配对癌旁组织的qRT-PCR检测。以Folds=2-△△Ct表示组间相对倍比关系,以GAPDH为内参。qRT-PCR引物序列:TKT正向引物:5′-GAAGATCAGCTCCGACTT GG-3′,反向引物:5′-GTCGAAGTATTTGCCGGTGT-3′;GAPDH正向引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,反向引物:5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.2.3Western blot检测 收集8例新鲜结直肠腺癌组织及配对癌旁组织,7株常见人结直肠癌细胞株(SW480、LOVO、HCT116、RKO、Caco2、SW620、DLD1)及人正常结肠黏膜上皮细胞株(FHC)。用RIPA裂解缓冲液(江苏凯基生物公司)提取蛋白,使用BCA蛋白定量试剂盒(江苏凯基生物公司)测定蛋白浓度。利用10%SDS-PAGE分离蛋白,将蛋白电转致PVDF膜上。将PVDF膜置于含5%脱脂牛奶的PBST溶液中封闭1 h,加入一抗TKT(11039-1-AP)在4 ℃孵育过夜,再加入二抗室温孵育1 h,用PBST洗涤30 min。使用ECL发光液(杭州弗德生物公司)进行化学发光。
1.2.4免疫组化 标本均经10%中性福尔马林固定,常规石蜡包埋后切片。免疫组化染色采用EliVision两步法,兔抗人TKT(11039-1-AP)抗体购自武汉三鹰生物公司,工作浓度1 ∶200;四种错配修复(mismatch repair deficent,MMR)蛋白(MSH2、MSH6、MLH1、PMS2)抗体及EliVision试剂盒均购自福州迈新公司;具体操作步骤严格按试剂盒说明书进行。用人肝脏组织中TKT染色为阳性对照,PBS代替一抗作空白对照,DAB显色,苏木精复染。免疫组化判读由两位高年资病理医师采用双盲法阅片。
1.3 结果判断TKT阳性判断标准[6]:(1)按细胞阳性百分比进行评分:阳性细胞数<1%为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;(2)按细胞着色强度进行评分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;将两项得分的乘积进行分组:>4分为高表达组,≤4分为低表达组。MMR蛋白判断标准:有任何比例和强度的癌细胞核着色为阳性,癌细胞核均未着色为阴性;四种MMR蛋白均阳性为正常,任一种MMR蛋白阴性为缺失。
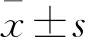
2 结果
2.1 数据库分析结直肠癌中TKT的表达应用Oncomine数据库在线分析TKT在结直肠腺癌中的表达,入选标准:TKT在肿瘤组织和正常组织间差异倍数>2、基因排位<10%、P<0.001。结果显示:符合入选标准的数据库有13个(图1),通过GEPIA工具在线分析TCGA芯片数据库(367例结直肠癌样本)显示TKT表达上调(图2A)。利用GEO公共数据库(GDS4382/208699)分析17例新鲜配对结直肠腺癌组织中TKT表达,结果显示:TKT在结直肠癌组织中的表达明显高于正常组织(图2B)。上述分析结果提示TKT在结直肠癌的发生、发展中可能起促癌作用。
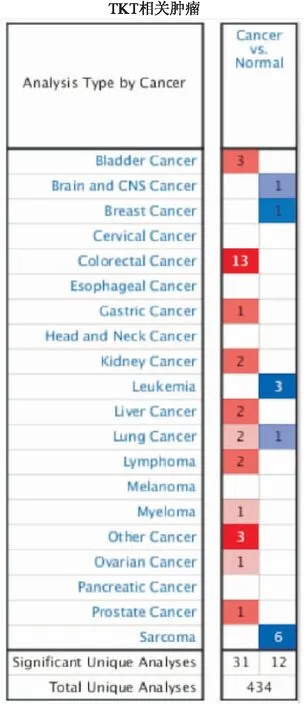
图1 Oncomine数据库中TKT在结直肠腺癌中的表达:蓝色为表达下调;红色为表达上调;颜色深浅为数据库数量所占位次
2.2 结直肠腺癌中TKT mRNA表达及诊断价值应用qRT-PCR检测27例新鲜结直肠腺癌及配对癌旁正常组织中TKT mRNA的相对表达量,结果显示结直肠腺癌组织中TKT mRNA水平比癌旁组织明显升高,差异有统计学意义(P<0.001,图3A、B)。利用结直肠腺癌和癌旁正常组织中TKTmRNA相对表达量制作受试者工作特征曲线(receiver operating characteristic curve, ROC)评价TKT诊断价值,结果显示:ROC曲线下面积(area under curve,AUC)为0.877,敏感性为0.784,特异性为0.970(图3C)。AUC越接近1越具有诊断价值,表明检测TKT mRNA表达可以鉴别正常组织与结直肠腺癌组织,TKT具有作为结直肠腺癌诊断标志物的潜在价值。
图2 A.GEPIA在线分析TKT在TCGA数据库结直肠腺癌标本中表达:T.肿瘤组织;N.癌旁组织;B.GEO数据库中TKT在结直肠腺癌与配对癌旁正常组织中的表达
2.3 Western blot法检测结直肠腺癌中TKT蛋白的表达Western blot法检测8例新鲜配对结直肠腺癌组织和常见结直肠癌细胞株,结果显示:8例结直肠腺癌组织中TKT蛋白表达明显高于癌旁组织(图4A);在7株人结直肠癌细胞株(SW480、LOVO、HCT116、RKO、Caco2、SW620、DLD1)中TKT蛋白表达显著高于人正常结肠黏膜上皮细胞株FHC(图4B)。
2.4 免疫组化检测结直肠腺癌中TKT蛋白的表达92例配对结直肠腺癌及癌旁正常石蜡组织中TKT有60.9%(56/92)呈高表达,在癌旁组织中仅26.1%(24/92)呈高表达,两组间高表达率差异有显著性(P<0.001,图5)。

图3 A.qRT-PCR检测27例新鲜结直肠腺癌组织与配对癌旁正常组织中TKT表达量的倍比关系:T.结直肠腺癌组织;N.配对癌旁正常组织;B.qRT-PCR检测27例新鲜结直肠腺癌组织与配对癌旁正常组织中TKT相对表达量的比较;C.ROC曲线评估TKT的诊断价值
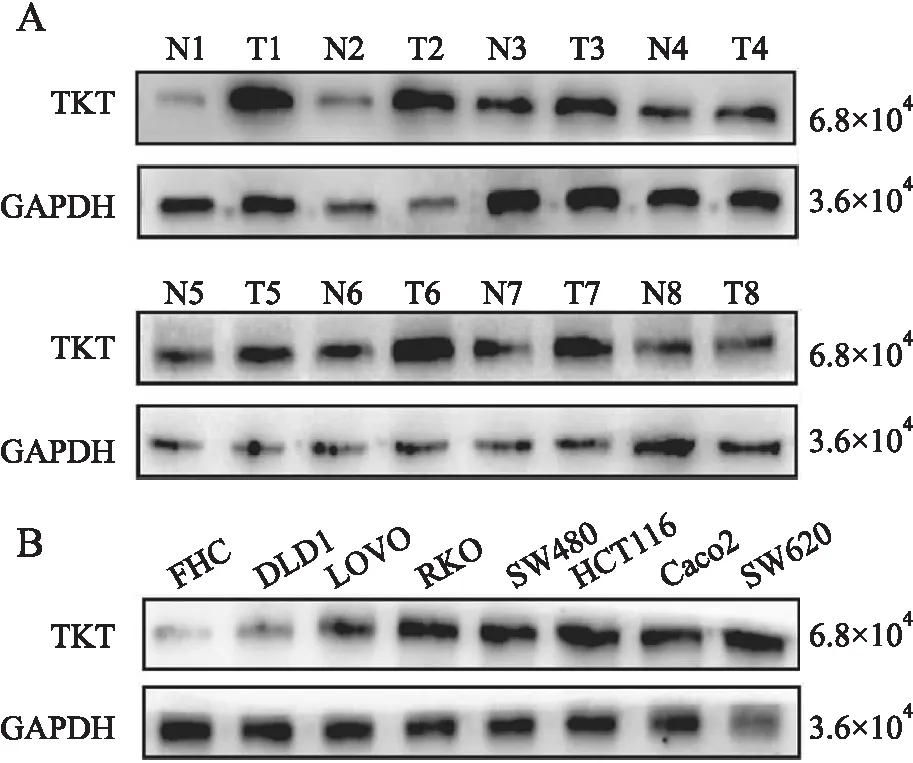
图4 A.Western blot检测结直肠腺癌中TKT蛋白的表达:N.配对癌旁正常组织;T.结直肠腺癌组织;B.Western blot检测结直肠腺癌细胞株及正常结肠黏膜上皮细胞株中TKT的表达
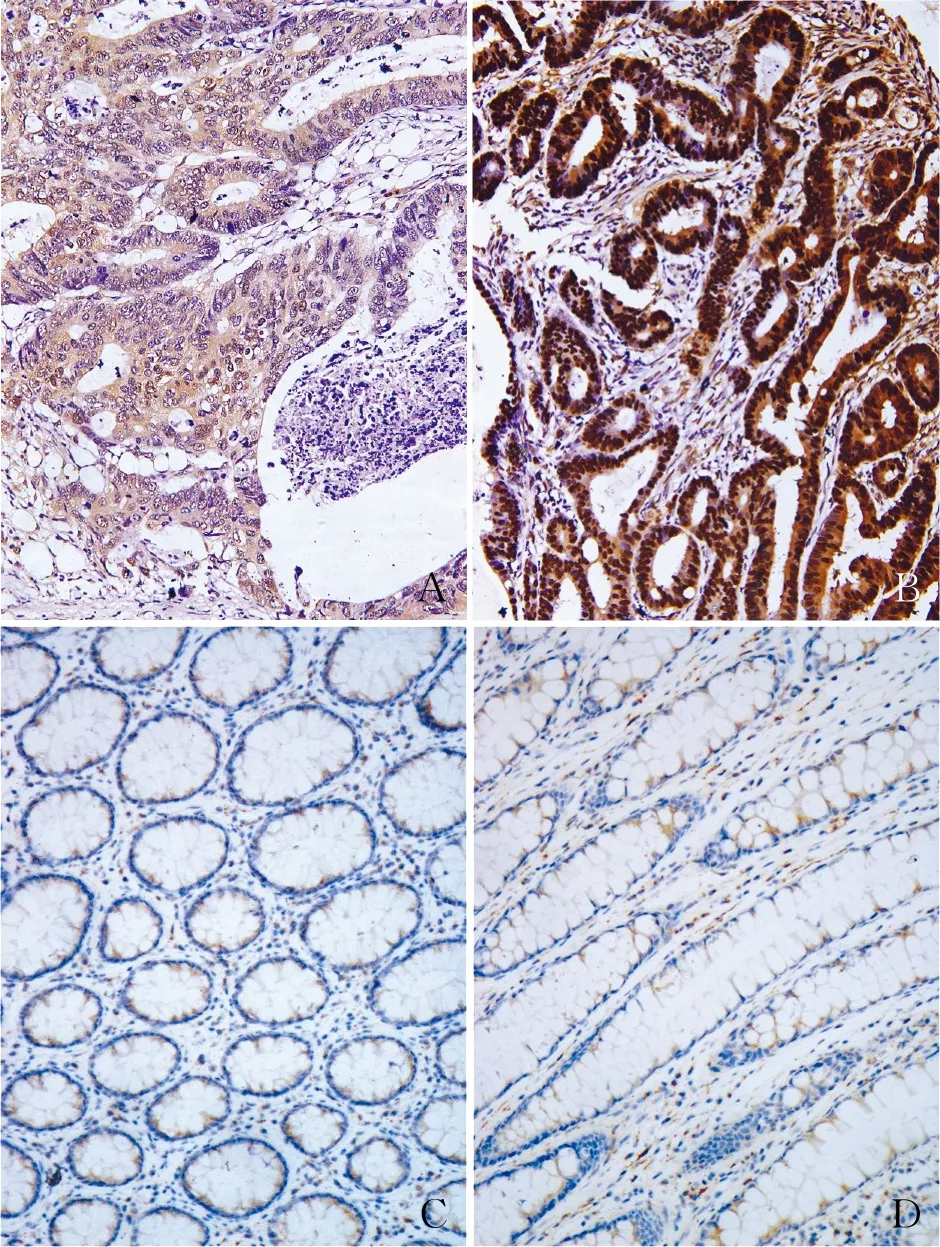
图5 结直肠腺癌中TKT的表达,EliVision两步法:A.TKT在直肠腺癌组织中低表达;B.TKT在结肠腺癌组织中高表达;C.TKT在直肠配对癌旁正常组织中不表达;D.TKT在结肠配对癌旁正常组织中低表达
2.5 结直肠癌中TKT蛋白表达与临床病理特征的关系92例结直肠腺癌中,TKT蛋白高表达与肿瘤大小、脉管侵犯、淋巴结转移以及肿瘤T分期有相关性(P<0.05),即肿瘤直径大、有脉管侵犯、有淋巴结转移及T分期较晚者,TKT表达率更高;TKT高表达与患者年龄、性别、分化程度、神经侵犯、发生部位及MMR蛋白表达均无相关性(表1)。
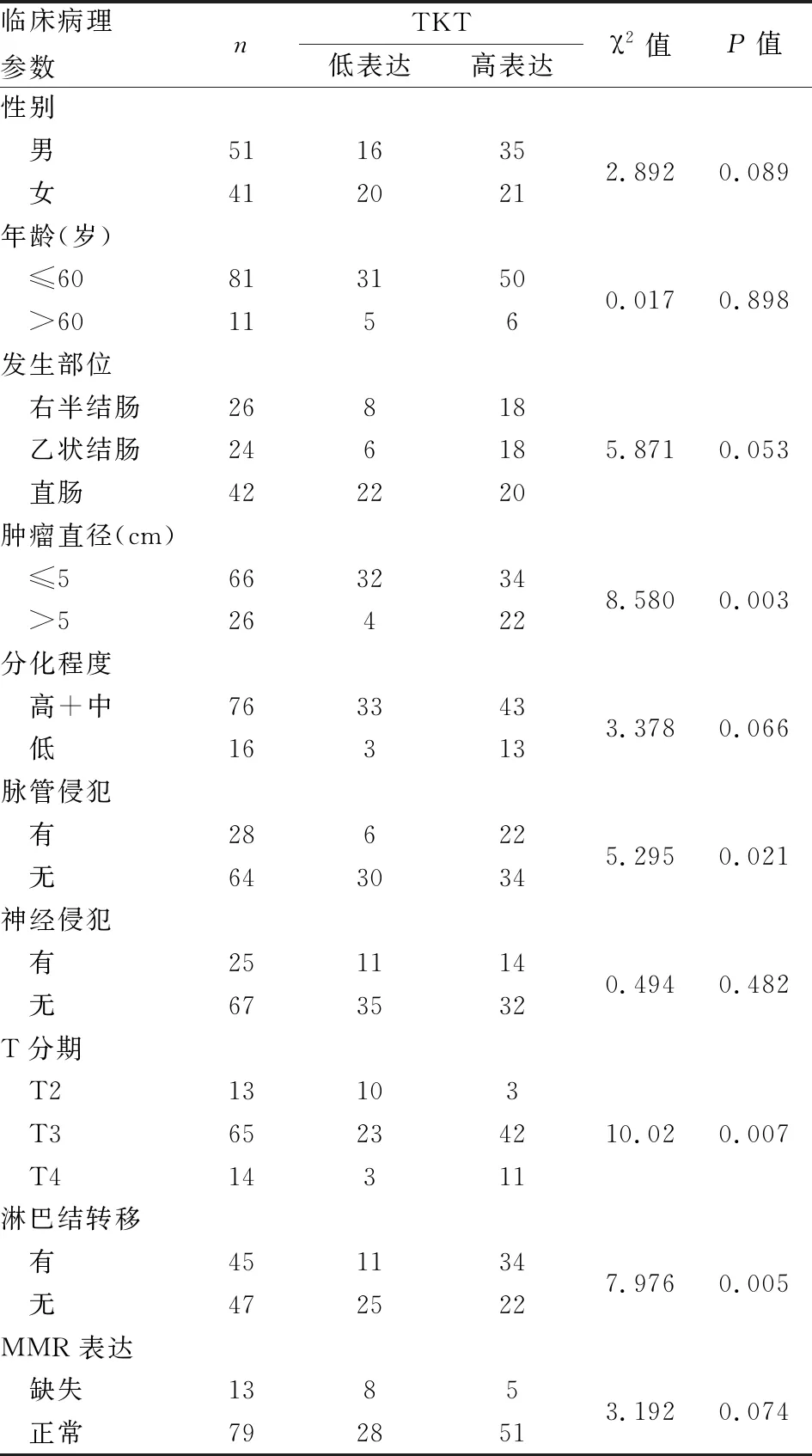
表1 结直肠腺癌中TKT表达与临床病理特征的相关性
3 讨论
2011年Hanahan和Weinberg重新定义了恶性肿瘤的十大特征,肿瘤能量代谢异常是其中之一[7]。目前,研究显示肿瘤细胞的能量代谢异常主要体现在Warburg效应和合成代谢增强等方面。快速增殖的肿瘤细胞需通过各种方式增加戊糖磷酸途径活性来满足自身能量供应。TKT是硫胺二磷酸依赖性酶,戊糖磷酸途径非氧化阶段的限速酶,该基因定位于3p14.3,蛋白全长623个氨基酸,相对分子质量为6.8×104,在生物进化过程中高度保守,真核生物各组织器官均有分布[8-9]。人类基因组研究还发现,TKT同家族基因转酮醇酶样基因1(transketolase-like1, TKTL1)和转酮醇酶样基因2(transketolase-like 2, TKTL2)在结构和功能上具有一定的相似性;TKTL1基因位于肿瘤和细胞周期激活基因Xq28区域,在肿瘤发生中起重要作用[8]。目前,有研究报道TKTL1在乳腺浸润性导管癌中高表达,与肿瘤的浸润、转移有一定的相关性[10]。
TKT在多种恶性肿瘤中表达上调,其过表达与不良临床预后特征密切相关。Corona等[11]对肝癌的代谢组学研究发现,与癌旁组织相比,TKT在肝癌中表达明显上调。Xu等[2]研究显示,与癌旁组织相比,肝癌组织中TKT mRNA和蛋白表达均显著上升,且TKT过表达与静脉侵犯、肿瘤卫星结节形成、癌肿直径大和肿瘤缺乏包膜的侵袭性特征密切相关。Ogusawska等[12]研究显示TKT过表达与肾细胞癌分期晚和生存期短显著相关。Zhao等[4]报道,与正常卵巢组织相比,卵巢癌组织中TKT过表达,且TKT转录本的过表达与浆液性病理类型及TP53突变型卵巢癌患者的无进展生存期差相关。目前,国外仅报道1篇,国内尚未见TKT在结直肠癌组织中的报道,本组在Oncomine和TCGA样本库的分析结果均显示TKT在结直肠癌组织中表达上调;利用qRT-PCR和Western blot法检测新鲜配对结直肠腺癌组织及癌旁组织和细胞中TKT mRNA和蛋白的表达,结果与数据库一致。本组27例新鲜结直肠腺癌组织中TKT mRNA表达量显著高于配对癌旁组织;8例新鲜结直肠腺癌组织中TKT蛋白表达显著高于配对癌旁组织;常见结直肠癌细胞株中TKT蛋白表达显著高于FHC细胞株。综上所述,在结直肠腺癌组织和细胞中TKT mRNA和蛋白表达均上调。本组对92例结直肠腺癌标本进行检测,结果显示TKT高表达与肿瘤直径大、脉管侵犯、淋巴结转移及肿瘤T分期晚有相关性(P均<0.05),TKT可能是结直肠癌预后不良因子。微卫星不稳定(microsatellite instability, MSI)是结直肠癌发生、发展中的重要分子事件,免疫组化检测MMR蛋白是筛查MSI的重要方法[13]。谢仲鹏等[14]研究显示MMR蛋白表达缺失与结直肠癌临床病理特征相关。本组分析TKT与MMR蛋白表达的相关性,结果显示61.5%(8/13)的MMR蛋白表达缺失结直肠腺癌组中TKT低表达,差异无统计学意义,但应扩大样本进一步分析。
目前,TKT在结直肠癌中发挥促癌的作用已初见端倪,其具体分子机制尚需深入研究。Tseng等[15]报道敲低TKT可激活琥珀酸脱氢酶和富马酸水合酶,下调HIF-1α使乳腺癌转移受抑制。Xu等[2]研究显示TKT经由氧化应激途径促进肝癌进展,TKT基因敲除或TKT抑制剂(Oxythiamin)能增加肝癌细胞对索拉非尼的疗效。TKT抑制剂有可能会使肿瘤患者获益。
综上所述,本组结果表明结直肠腺癌中TKT mRNA和蛋白水平均显著升高,并发现TKT高表达与侵袭转移临床病理特征密切相关,提示其可能参与结直肠腺癌的发生、发展;TKT有望成为结直肠腺癌预后标志物或潜在的治疗靶点。
