Notch1/Hes1信号通路在调控低分化胃腺癌细胞钙离子和侵袭能力中的作用
2021-04-01张竞文黄菱燕吕怀盛
张竞文,黄菱燕,秦 憬,吕怀盛,景 丽
胃癌是人类常见的恶性肿瘤,其预后与肿瘤分化程度、转移等密切相关。低分化胃腺癌与高分化胃腺癌相比,侵袭性更强、预后更差[1-4]。近年研究提示,细胞内钙离子水平影响细胞周期、能量摄取,并且参与调节癌细胞的增殖、浸润、转移等[3,5]。钙依赖性钙蛋白酶家族(Calpain)是调控细胞钙离子的重要成分,该家族包括Calpain-1与Calpain-2[3,6]。研究显示,Calpain-1高表达可促进口腔鳞状细胞癌浸润和转移[6]。Hes1基因是Notch1信号通路的靶基因,在维持细胞的未分化状态、分化方向中发挥重要作用[1,4,7]。已有研究显示,Notch1信号通路参与胃癌细胞增殖能力的调节[1];Hes1在胃癌浸润和转移过程中发挥作用,胃癌组织浸润深度、淋巴结转移及肿瘤分期均与Hes1高表达相关[1-2];在进展期胃癌以及侵袭能力强的胃癌细胞系也有比较高的Hes1表达[7]。目前,Hes1基因参与胃癌进展的分子机制尚不清楚,Notch1/Hes1对胃癌细胞钙离子的影响有待于进一步分析。本文采用免疫组化、基因沉默、Transwell、Flou-4、Western blot法检测低分化胃腺癌、MGC-803胃癌细胞中Notch1/Hes1蛋白表达及其对钙离子水平的影响,探讨Notch1/Hes1对胃癌细胞钙离子水平及侵袭力的影响。
1 材料与方法
1.1 材料收集2016~2018年宁夏医科大学总医院收治的低分化胃腺癌及癌旁正常组织各32例。MGC-803人低分化胃癌细胞株购自北京北纳生物公司。实验所用试剂购自北京中杉金桥公司和武汉博士德公司,主要包括Notch1、Hes1、Calpain-1(Abcam 公司),vimentin、E-cadherin、β-actin兔多克隆抗体(Proteintech 公司),RPMI 1640培养基、青链霉素、胰蛋白酶-EDTA消化液、胎牛血清(HyClone公司),Flou-4 AM钙离子检测试剂盒(Thermo Fisher Scientific公司),总蛋白提取试剂盒(索莱宝公司),Transwell小室(Corning公司),Lipofectamine 2000 Transfection Reagent(Invitrogen公司),ECL超敏发光液(Thermo Fisher Scientific公司),Matrigel基质胶(BD公司)。
1.2 方法
1.2.1分组 32例低分化胃腺癌为胃癌组,32例癌旁正常组织为对照组。标本均经10%中性福尔马林固定,常规取材,石蜡包埋、切片。MGC-803人低分化胃癌细胞株分为对照组、Lipofectamine 2000组、Notch1 siRNA组、Hes1 siRNA组。
1.2.2免疫组化 采用免疫组化SP法进行染色,主要步骤如下:(1)切片经脱蜡,水化;(2)柠檬酸缓冲液微波抗原修复;(3)一抗4 ℃孵育过夜,Notch1(1 ∶200)、Hes1(1 ∶500)、Calpain-1(1 ∶500)、E-cadherin(1 ∶200);(4)二抗37 ℃孵育1 h,DAB显色;(5)苏木精复染,脱水,透明,封固。以PBS代替一抗作为阴性对照,光镜观察,≥10%的癌细胞阳性着色为阳性。
1.2.3Notch1 siRNA和Hes1 siRNA转染 本组参考Lipofectamine 2000转染试剂说明书操作,主要步骤如下:(1)无血清培养24 h,Lipofectamine 2000与对应siRNA预混配置成工作液,工作浓度为100 nmol/L,室温孵育25 min;(2)取对数增殖期的MGC-803细胞,按每孔8×105个细胞平铺在6孔板中,稳定培养24 h;(3)待生长融合度约50%时,更换siRNA预混工作液,继续孵育24 h;(4)更换含血清培养基工作液,继续培养24 h;(5)收集和检测各组中Notch1、Hes1的蛋白表达。Notch1 siRNA正向引物5′-GAAUUUGGGAGCUGUUUAUTG-3′,反向引物5′-AUAAACAGCUCCCAAAUUCTG-3′;Hes1 siRNA正向引物5′-GAAUUUGGGAGCUGUUUAUTG-3′,反向引物5′-AUAAACAGCUCCCAAAUUCTG-3′。
1.2.4Flou-4 AM检测 取对数增长期细胞,接种于6孔板中(5×105个/孔),37 ℃、48 h。加入1 mL培养基工作液和1 mL Flou-4 AM染色工作液,37 ℃、20 min。吸除上清,Flou-4 AM染色缓冲液(1×)洗涤2次,加入2 mL细胞培养液。荧光显微镜下观察拍照,IPP 6.0软件进行结果分析。
1.2.5Transwell实验 Matrigel预包被Transwell小室;将细胞接种于Matrigel预包被Transwell小室的上室(5×105个/室),加无血清培养液,下室加含血清液培养,37 ℃、48 h。标本经4%多聚甲醛固定10 min,棉签拭去上层未转移的细胞,下层结晶紫染色并细胞计数。
1.2.6Western blot检测 取对数生长期的MGC-803低分化胃癌细胞,各组细胞经预处理后,应用全蛋白提取试剂盒提取蛋白。提取前30 min配裂解液,4 ℃放置5 min,剧烈震荡30 s,合计5个循环,离心去除细胞碎片及杂质,分装蛋白。应用蛋白含量检测试剂盒测OD值,100 ℃、10 min,上样。1×SDS蛋白上样缓冲液进行SDS-PAGE电泳,转移至NC膜,用5%脱脂奶粉37 ℃封闭1 h。一抗Notch1(1 ∶1 000)、Hes1(1 ∶1 000)、Calpain-1(1 ∶500)、vimentin(1 ∶1 000)、E-cadherin(1 ∶1 000)、和β-actin(1 ∶3 000)4 ℃孵育过夜。二抗(1 ∶3 000)37 ℃孵育1 h。采用ECL化学发光显影剂显影并曝光保存。应用Image J软件测量条带灰度值,以β-actin作为内参,以两者灰度值的比值表示相对蛋白表达量。

2 结果
2.1 临床特点32例低分化胃腺癌中男性23例,女性9例,年龄36~77岁,中位年龄56岁。其中黏膜下层以内的早期胃癌3例(9.38%),中晚期胃癌29例(90.62%)。32例均符合低分化腺癌的组织学特征,癌细胞形成条索状(图1A)、团块状、小片状癌巢,可见不规则腺管样结构,浸润性生长。癌旁黏膜组织主要为幽门腺(图1B)和胃体腺,可见肠上皮化生及不典型增生。免疫组化结果显示,本组32例均表达腺癌的阳性指标CK20(图1C),Ki-67增殖指数为26.64%±6.83%(图1D),证实为低分化胃腺癌。
2.2 免疫表型本组癌旁正常腺体可见少数细胞出现Notch1、Hes1表达,低分化胃腺癌组织中Notch1、Hes1表达明显增多,主要表达于细胞质,少数细胞为细胞核表达。在癌旁正常腺体可见少数细胞有Calpain-1蛋白表达,主要表达于细胞膜,低分化胃腺癌组织中Calpain-1蛋白强表达,定位于细胞质和细胞核。癌旁组织中E-cadherin弥漫表达,低分化胃腺癌组织中E-cadherin偶见阳性细胞。经χ2检验,Notch1、Hes1、Calpain-1、E-cadherin蛋白在低分化胃腺癌组织(阳性率分别为93.75%、96.88%、96.88%和25.0%)与癌旁组织(阳性率分别为21.88%、18.75%、25.0%和93.75%)的表达差异有显著性(P<0.05),低分化胃腺癌组织中Hes1、Notch1、Calpain-1表达明显高于癌旁正常组织(P<0.05),E-cadherin表达明显低于癌旁正常组织(P<0.05,图2)。
2.3 Notch1和Hes1 siRNA检测将Notch1 siRNA和Hes1 siRNA干扰序列转染MGC-803细胞,培养48 h后,Western blot检测细胞中Notch1和Hes1的蛋白表达(图3A),结果显示Notch1和Hes1的蛋白表达明显降低(图3B),提示干扰成功。
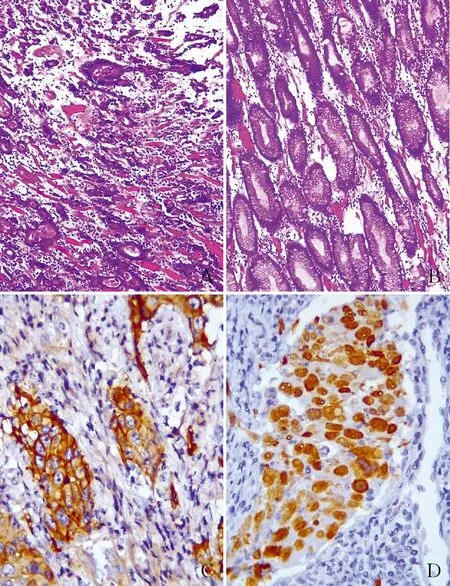
图1 A.胃低分化腺癌,癌细胞排列呈条索状; B.癌旁正常黏膜组织,为幽门腺;C.胃低分化腺癌中CK20呈阳性,SP法;D.胃低分化腺癌中Ki-67呈阳性,SP法
2.4 Transwell检测培养48 h 后,在对照组和Lipofectamine 2000组均可见多量癌细胞迁移(图4A、B),而Notch1 siRNA组和Hes1 siRNA组癌细胞迁移明显减少(图4C、D);对照组、Lipofectamine 2000组[每视野分别为(340±46)个细胞和(348±63)个细胞]与Notch1 siRNA组和Hes1 siRNA组迁移细胞数量[每视野分别为(95±22)个细胞和(63±26)个细胞]差异有统计学意义(P<0.05),Notch1 siRNA和Hes1 siRNA转染均可显著减少MGC-803胃癌细胞的迁移。
2.5 胃癌细胞钙离子水平检测本组经Flou-4检测不同分组MGC-803细胞钙离子水平结果显示,在对照组和Lipofectamine 2000组,癌细胞钙离子分别为0.39和0.38(图5A、B);与对照组和Lipofectamine 2000组比较,Notch1 siRNA组(0.11)和Hes1 siRNA组(0.14)胃癌细胞钙离子水平明显降低(P<0.05,图5C、D);而Notch1 siRNA与Hes1 siRNA两组间癌细胞的钙离子水平,差异无统计学意义(P>0.05)。
2.6 Western blot检测本组Western blot结果显示,在对照组、Lipofectamine 2000组、Notch1 siRNA组和Hes1 siRNA组均可见Calpain-1、vimentin、E-cadherin蛋白表达(图6A);与对照组和Lipofectamine 2000组比较,Notch1 siRNA组和Hes1 siRNA组Calpain-1、vimentin的表达均降低,而E-cadherin表达明显增加;经蛋白相对表达量分析,Notch1 siRNA和Hes1 siRNA转染可降低vimentin和Calpain-1、E-cadherin的表达(P<0.05),增加E-cadherin的表达(P>0.05,图6B)。Notch1 siRNA与Hes1 siRNA两组间差异无统计学意义(P>0.05)。
3 讨论
胃癌是病死率较高的恶性肿瘤之一,其侵袭能力和转移是影响患者生存的主要因素[1,5]。已有研究提示,有多种因素能够影响癌细胞的增殖以及浸润[4,8]。本组32例低分化胃腺癌组织中Notch1、Hes1、Calpain-1表达明显增多,E-cadherin表达明显低于癌旁组织;与以往报道基本一致[2,4],Notch1和Hes1蛋白高表达参与低分化腺癌的侵袭能力调控[2,4-5]。本组低分化胃腺癌组织Calpain-1表达明显高于癌旁组织,与口腔鳞状细胞癌研究结果基本一致[6],提示低分化胃腺癌涉及钙离子水平的异常变化[3,6]。
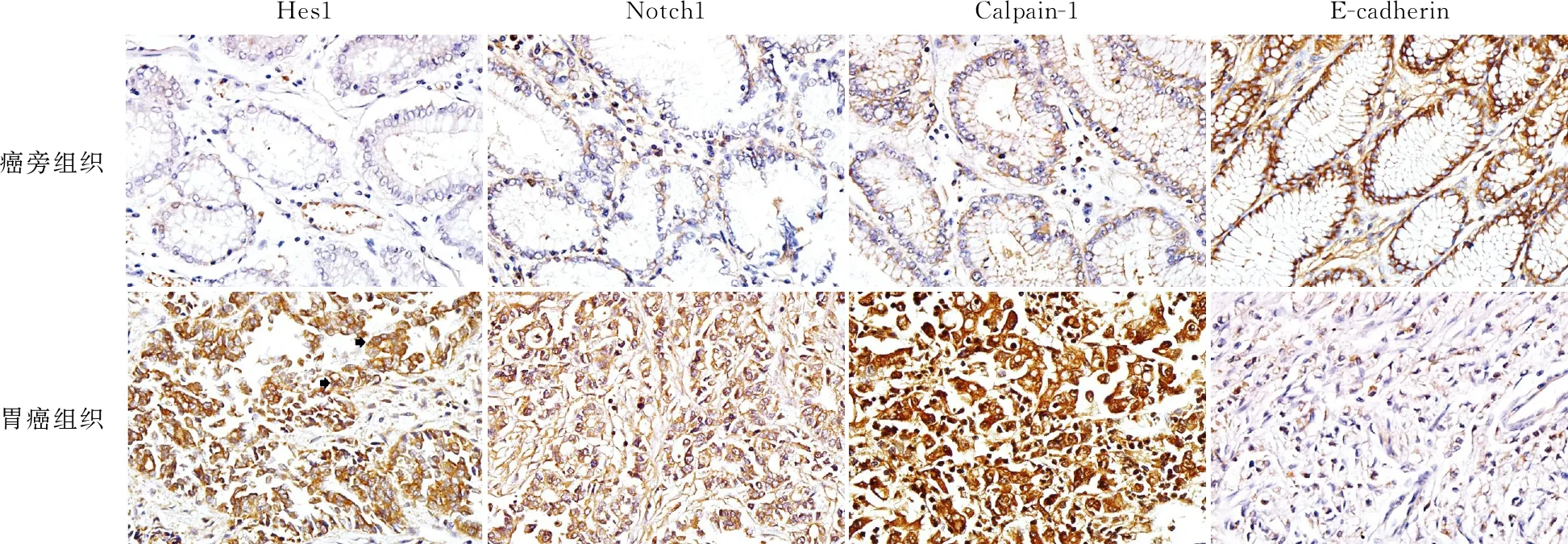
图2 癌旁组织和胃癌组织中蛋白免疫组化染色:癌旁组织中少数细胞Notch1、Hes1和Calpain-1蛋白呈阳性,E-cadherin呈弥漫阳性,SP法;胃癌组织中癌细胞Notch1、Hes1和Calpain-1蛋白均呈弥漫阳性,癌细胞偶见E-cadherin呈阳性,SP法
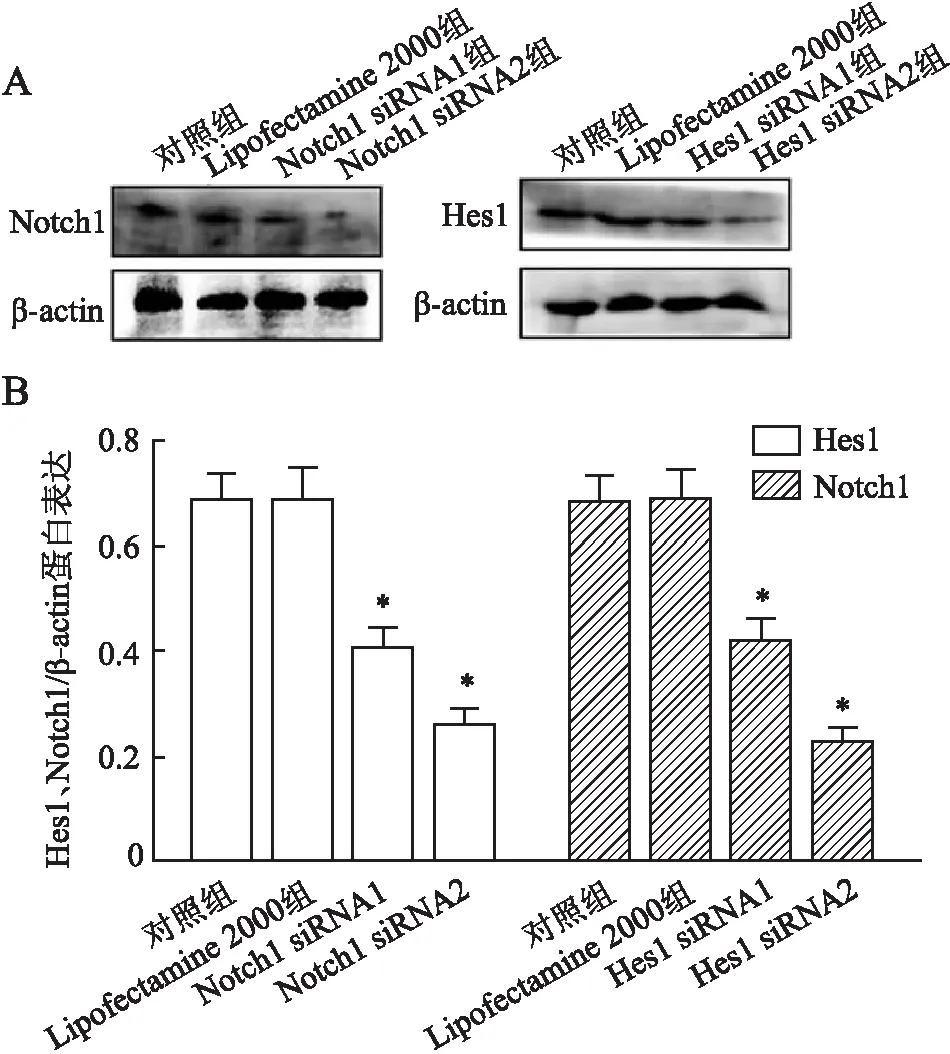
图3 Notch1 siRNA和Hes1 siRNA干扰效果:A.Western blot检测Hes1、Notch1蛋白表达;B.相对灰度值统计分析;与对照组、Lipofectamine 2000组比较,*P<0.05
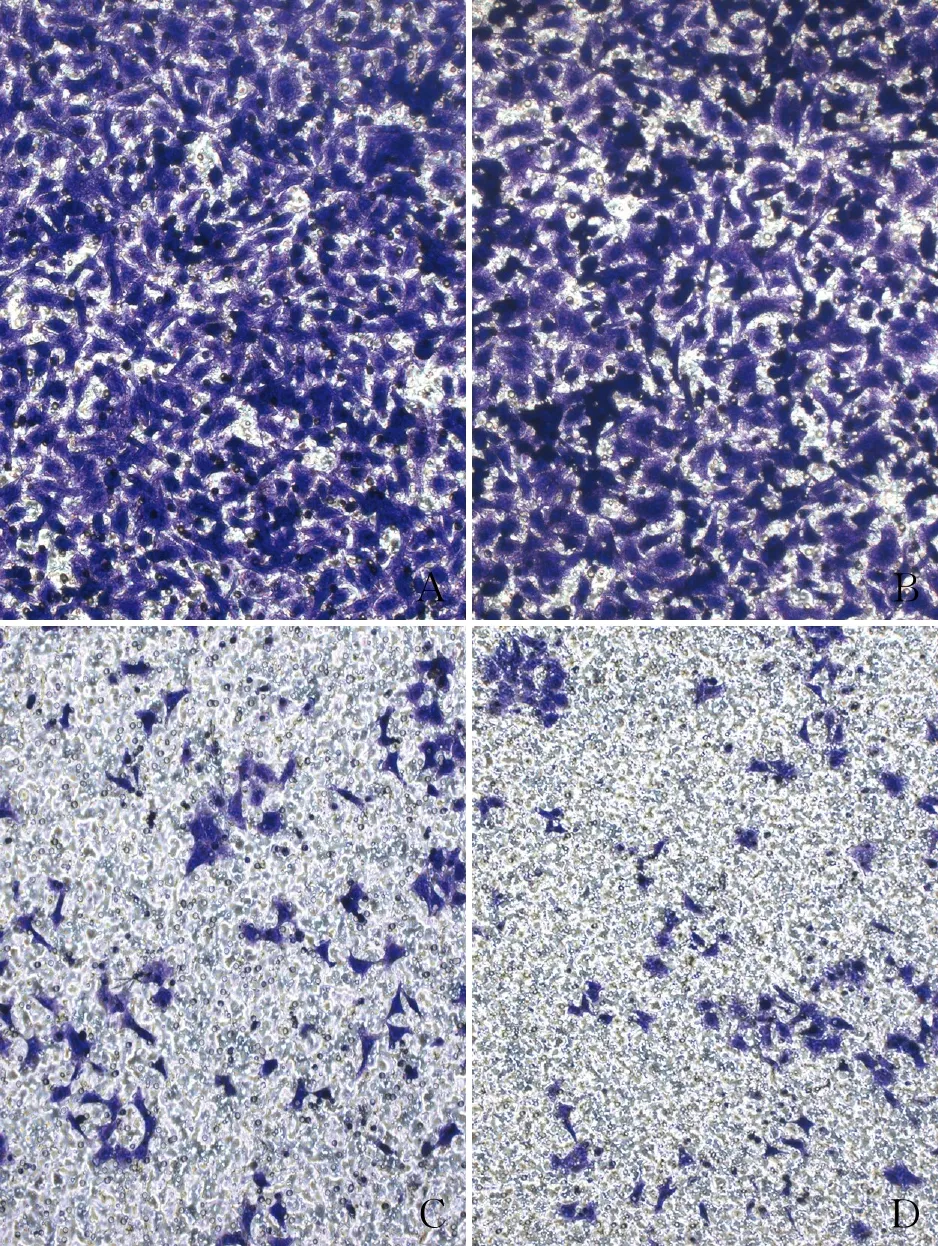
图4 Transwell检测细胞迁移:A.对照组,癌细胞密集; B.Lipofectamine 2000组,癌细胞丰富;C.Notch1 siRNA组,癌细胞减少;D.Hes1 siRNA组,癌细胞减少
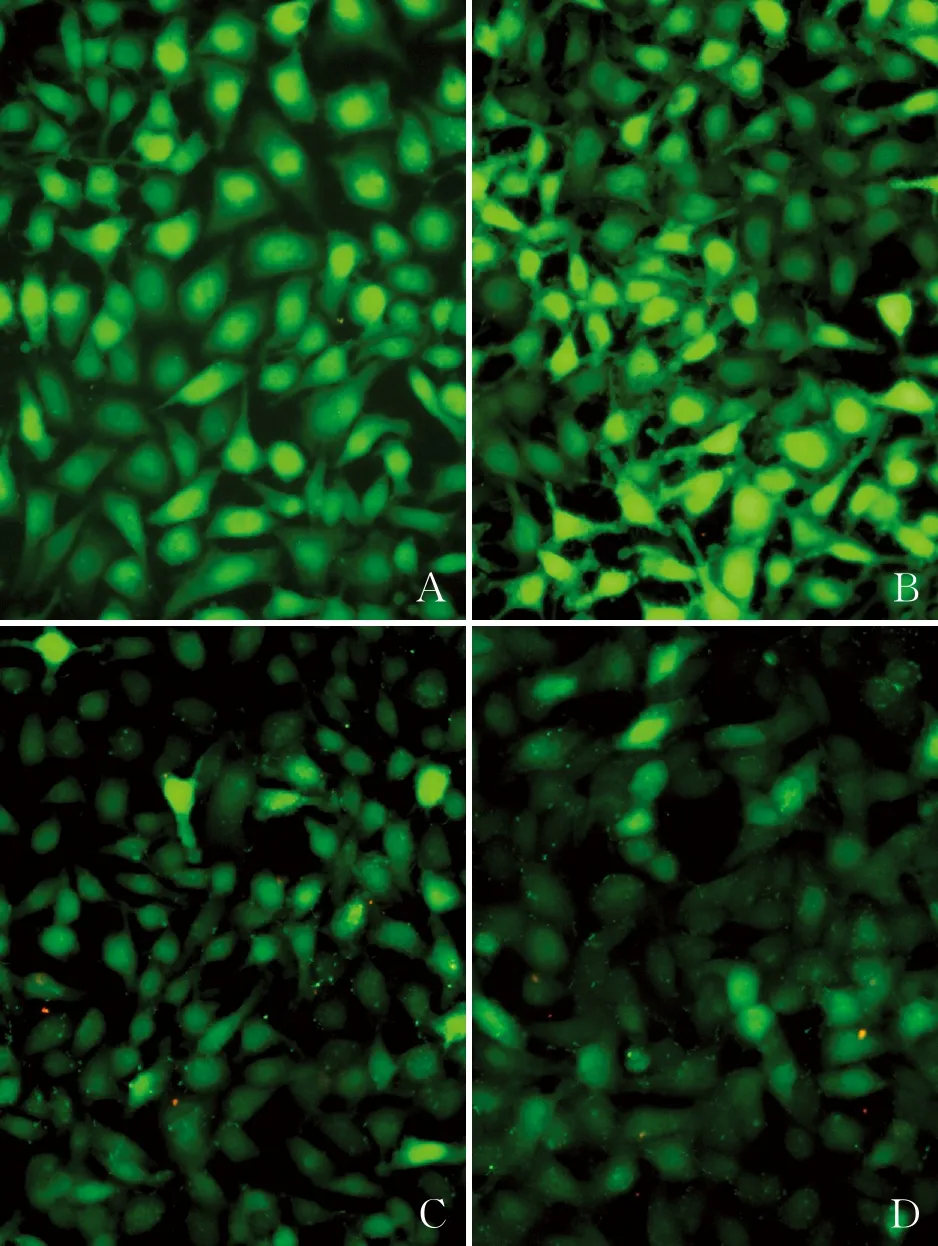
图5 Flou-4检测细胞钙离子水平:A.对照组,钙离子信号增强; B.Lipofectamine 2000组,钙离子信号弥漫增强;C.Notch1 siRNA组,钙离子信号减少;D.Hes1 siRNA组,钙离子信号减少
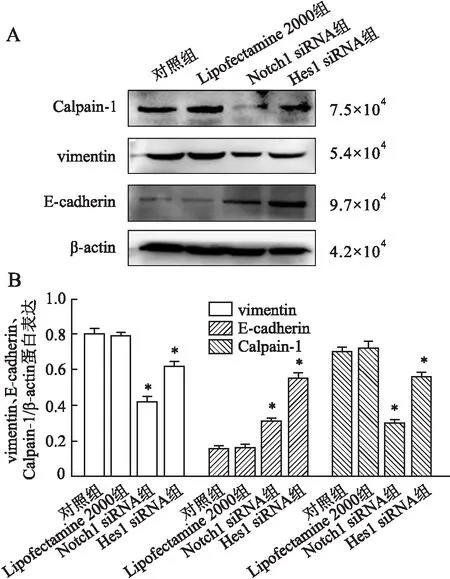
图6 Western blot检测:A.Western blot检测vimentin、E-cadherin、Calpain-1蛋白表达;B.相对灰度值统计分析;与对照组和Lipofectamine 2000组比较,*P<0.05
已有研究证明,在胃癌发生、发展过程中,可有多种基因发挥调节作用[1,3,8]。Hes1属于DNA结合蛋白,受Notch1信号调节,Notch1/Hes1信号调节通路在组织分化过程中发挥重要作用[1,7,9]。本组结果显示,在MGC-803胃癌细胞进行Notch1 siRNA和Hes1 siRNA转染后,Notch1和Hes1蛋白表达明显降低,并可显著减少癌细胞的迁移,再次提示Notch1/Hes1信号调节蛋白在胃癌细胞侵袭过程中发挥重要作用[1,2,4]。有研究提示,抑制Notch1/Hes1信号通路可显著降低裸鼠结肠癌移植瘤的生长[10]。在人胃腺癌组织和小鼠胃种植瘤模型中可见,Notch1/Hes1和mTORC1信号通路显著增强,促进胃癌细胞增殖[1]。体外研究提示,通过抑制Notch1/Hes1信号通路可减少癌细胞集落形成,降低胃癌细胞的侵袭能力[11]。
Calpain包括Calpain-1与Calpain-2,是调控细胞钙离子的重要成分[6]。有文献报道在癌细胞增殖、转移过程中,均涉及钙离子和钙离子相关蛋白的作用[12-13]。本组结果显示,低分化胃腺癌组织和MGC-803胃癌细胞中Calpain-1表达明显增多,Notch1和Hes1基因沉默后,MGC-803胃癌细胞钙离子水平以及其迁移能降低,并伴Calpain-1表达降低;提示高表达Calpain-1可能与癌细胞钙离子水平升高及其迁移能力增加有关[12-13]。关于Notch1/Hes1信号通路在Calpain-1调控细胞钙离子过程中的作用尚不清楚。Squecco等[12]报道细胞钙离子水平与Notch1表达相互作用,参与调节乳腺癌MCF-7细胞的增殖和侵袭。Calpain-1高表达可增加癌细胞侵袭能力和耐药性,抑制Calpain-1表达可促进癌细胞凋亡,逆转顺铂耐药性[14]。Ren等[6]报道口腔鳞状细胞癌中高表达的Calpain-1能够促进癌细胞浸润和转移。本组前期研究显示胃癌发生过程中可出现Hes1高表达,并与C-myc和p53基因变化及CEA表达相关[4]。本组结果显示,胃癌细胞侵袭能力与Notch1/Hes1蛋白高表达有关,同时伴Calpain-1高表达及细胞钙离子水平升高;反之亦然,提示Notch1/Hes1信号通路参与Calpain-1相关的MGC-803细胞钙离子水平调节[8,12,14]。
本实验结果可见,低分化胃腺癌组织E-cadherin表达明显降低,MGC-803细胞Notch1和Hes1基因沉默也可显著降低vimentin和提高E-cadherin的表达;提示Notch1/Hes1信号通路还可通过细胞黏附、上皮-间质转化参与胃癌细胞侵袭能力的调控[2,15]。Notch1/Hes1信号通路可能与细胞内钙离子调控机制存在串扰关系,其最终作用可能涉及复杂的细胞信号网络[1,3,15]。本实验仅在单一类型的胃癌及其细胞株进行相关观察,关于Notch1/Hes1蛋白参与细胞钙离子水平调节的作用及其机制,尚需更深入的研究。
