出芽短梗霉菌PA-2脂肽类物质抑菌活性及其发酵条件优化
2021-04-01岳登高郭青云
岳登高,程 亮,郭青云
(青海大学农林科学院,青海省农业有害生物综合治理重点实验室,农业农村部西宁作物有害生物科学观测实验站,青海 西宁 810016)
近年来由于抗生素的大量使用,使病原菌耐药性问题变得日趋严峻[1]。对革兰氏阳性菌具有显著抗性的脂肽类物质便成为众多学者研究的热点之一。脂肽(lipopeptide)又名脂酰肽(acylpep-tide),是一类由脂肪链和肽链组成的具有两亲结构的微生物次级代谢产物[2]。脂肽类抗菌物质包括表面活性素(surfcatin)、伊枯草菌素(iturin)和芬荠素(fengycin)三大类[3],其具有抗细菌[4]、真菌[5]、病毒和支原体的功能[6],在农业[7]、工业[8]和生物医药[9]等方面有着很高的利用价值。然而高成本低产量限制了抗菌脂肽的工业化生产,因此急需对产肽菌株的发酵条件进行优化,从而降低发酵成本,提高脂肽产量。目前关于产抗菌脂肽的菌株研究主要集中于芽孢杆菌属。高兆建等[10]从凝结芽孢杆菌XZQ-16发酵液中分离得到抗菌脂肽化合物。吴艳清等[11]通过对枯草芽孢杆菌WL2的次生代谢产物研究发现,它可产生对致病疫霉有抑制作用的脂肽类物质。关于出芽短梗霉菌的次生代谢产物有胞外多聚糖、胞外酶、黑色素、嗜铁素和短梗霉素A,其中短梗霉素A是从出芽短梗霉菌NR106的液体培养基中分离得到的一种环状脂肽类抗生素[12-13],这为本文出芽短梗霉菌PA-2的产肽研究提供了依据。当前关于出芽短梗霉菌PA-2产生抗菌脂肽类物质并以脂肽产量为响应值进行发酵条件优化的研究还未曾报道。基于此,本研究通过分析出芽短梗霉菌PA-2脂肽类物质对致病菌的抑菌活性及发酵条件优化,为该菌株及其脂肽类物质的进一步开发和应用提供理论基础和科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
出芽短梗霉菌(Aureobasidiumpullulans)PA-2菌株由青海省农业有害生物综合治理重点实验室分离和保存。
供试靶标菌:金黄色葡萄球菌(Staphylococcusaureus)ATCC6538、酿酒酵母菌(Saccharomycescerevisiae)ATCC9098、大肠埃希菌(Escherichiacoli)ATCC8739、白色念珠菌(Candidaalbicans)ATCC10231均来自山东鲁微科技有限公司。樱桃球腔菌(Mycosphaerellacerasella)LD-2、大麦网斑病(Pyrenophorateres)HZ-2保存于青海省农业有害生物综合治理重点实验室。
1.1.2 培养基
出芽短梗霉菌PA-2的平板培养和斜面保存采用PDA培养基,出芽短梗霉菌PA-2的种子液制备采用PDB液体培养液。出芽短梗霉菌PA-2的发酵培养采用培养基(葡萄糖 20 g·L-1,(NH4)2SO45 g·L-1,K2HPO41.5 g·L-1,MgSO4·7H2O 0.5 g·L-1,CaCl20.1 g·L-1,NaCl 0.1 g·L-1,FeCl30.5 mg·L-1,ZnSO40.5 mg·L-1); 靶标菌(细菌和酵母菌)的培养和抑菌活性检测采用LB培养基(蛋白胨10 g·L-1,肉提取物3 g·L-1,乳糖5 g·L-1,溴麝香草酚兰0.024 g·L-1,琼脂粉16 g·L-1);靶标菌(真菌)的培养和抑菌活性检测采用PDA培养基。
1.1.3 仪器
SQ 510C型立式蒸汽灭菌锅,重庆雅玛拓科技有限公司;SW-CJ-2D型超净工作台,莱特科学仪器有限公司;ZWY-1102型恒温振荡培养箱,上海智城分析仪器制造有限公司;TGL-50型台式离心机,常州金坛良友仪器有限公司;D-6000-VN型旋转蒸发仪,河北中硕仪器科技有限公司;SHB-3型循环水式多用真空泵,郑州长城科工贸有限公司;HX-1050型恒温循环器,北京博医康实验仪器有限公司;KQ-250E型超声波清洗器,昆山市超声仪器有限公司。
1.2 方法
1.2.1 PA-2脂肽粗提物的制备
将活化的PA-2菌株接种于装液量为150 mL的液体培养基中,接种量为每50 mL接种1个菌饼(Ф=1.0 cm),于25 ℃、180 r·min-1的条件下振荡培养5 d后,在4 ℃、10 000 r·min-1条件下离心10 min,收集上清液。用6 mol·L-1的HCl将上清液调pH至2.0,在4 ℃冰箱中静置24 h。然后在4 ℃、10 000 r·min-1的条件下离心10 min,收集沉淀[14-15]。沉淀经冻干处理后用适量甲醇反复抽提3次,合并抽提液,然后经旋转蒸发仪蒸干得到淡黄色晶体。并用适量甲醇溶解晶体,浓度为0.1 g·mL-1,经 0.22 μm微孔滤膜过滤,于4 ℃冰箱保存备用。
1.2.2 脂肽粗提物的定性检测
通过原位酸水解-茚三酮显色法[16]对脂肽粗提物进行定性检测。首先取a、b两块硅胶板分别在距离上下沿1.5 cm处用铅笔划线,然后用毛细管蘸取粗提物点样于硅胶板下沿划线处,待点样位置完全干燥后将硅胶板置于展开剂为氯仿/甲醇/水体积比60∶30∶4的层析杠中进行层析。当展开剂上升至硅胶板上沿划线处时取出硅胶板,待a板晾干后喷洒茚三酮显色剂,最后置于65 ℃烘箱中约30 min。将取出的b板置于密闭容器(内含小烧杯乘有的浓盐酸)中,在110 ℃烘箱中进行原位酸水解1 h,之后再喷洒茚三酮显色剂,置于65 ℃烘箱中约30 min。
1.2.3 PA-2脂肽粗提物的抑菌活性测定
以金黄色葡萄球菌、酿酒酵母菌、大肠埃希菌、白色念珠菌、樱桃球腔菌和大麦网斑病为指示菌,通过琼脂打孔扩散的方法测定粗提物的抑菌活性[17-18]。首先制备靶标菌的平板培养基,然后将靶标菌活菌数调整到2.0×107CFU·mL-1,其次在平板上均匀的涂布200 μL,待平板晾干后,用打孔器(Ф=1.0 cm)在平板上打孔。最后将100 μL脂肽类提取物注入到不同靶标菌对应的孔中作为处理组,每个处理重复3次。以在平板孔中注入甲醇为阴性对照,注入已经灭菌但未接种PA-2菌株的液体发酵液作为阳性对照。经25 ℃条件下培养3~5 d,观察抑菌圈情况并测定抑菌圈直径大小,用以表示抑菌活性高低。
1.2.4 响应面法优化出芽短梗霉菌PA-2产抗菌脂肽的发酵条件
种子液的制备。从PDA斜面上挖取一块菌块接种于PDA平板中,活化培养7 d后,用打孔器(Ф=1.0 cm)打取菌饼1个,接种于盛有50 mL PDB培养液的三角瓶中(规格300 mL),在25 ℃、180 r·min-1的条件下振荡培养48 h作为种子液。
脂肽含量测定。发酵液经上述1.2.1节中脂肽粗提物的制备方法处理后得到固态粗提物,固态粗提物质量为旋蒸瓶旋蒸甲醇抽提液前(m1)后(m2)质量之差,最后用未发酵之前的培养液体积(V)求脂肽浓度,即ρ粗提=(m2-m1)·V-1。
单因素试验设计。根据刘畅[19]对出芽短梗霉菌发酵条件优化的研究从影响微生物生长的温度、装液量、接种量、培养基初始pH和转速5个条件进行单因素试验。分别设定接种量为3.0%、5.0%、7.0%、9.0%、11.0%,转速为100、130、160、190、220 r·min-1,温度为21、23、25、27、29 ℃,装液量为50、100、150、200、250 mL,初始pH为5、6、7、8、9,每个处理3次重复。从而确定单个因素的最佳发酵条件,为中心组合设计提供中心点。
响应面优化发酵条件试验设计。利用软件Design-Expert 10.0.3,以上述单因素试验确定的最佳条件为中心点,以脂肽类物质产量(Y)为响应值,接种量(A)、转速(B)、温度(C)、装液量(D)、培养基初始pH(E)为自变量进行通用旋转中心组合设计,试验因素水平设计如表1所示。
2 结果与分析
2.1 脂肽粗提物的定性检测
按照1.2.2节中的方法对PA-2粗提物进行定性检测,结果如图1所示。a板层析结束后直接喷洒茚三酮其结果不显色。b板经酸水解后喷洒茚三酮,发现硅胶板上出现明显条带。
由于茚三酮能与所有氨基酸及具有游离氨基的脂肽发生颜色反应,因此,a板未显色说明粗提物中不含氨基酸及具有游离氨基的脂肽,b板经酸水解后喷洒茚三酮出现明显条带说明粗提物中环状脂肽经酸水解后产生游离氨基酸,所以初步判定粗提物为环状脂肽类物质。
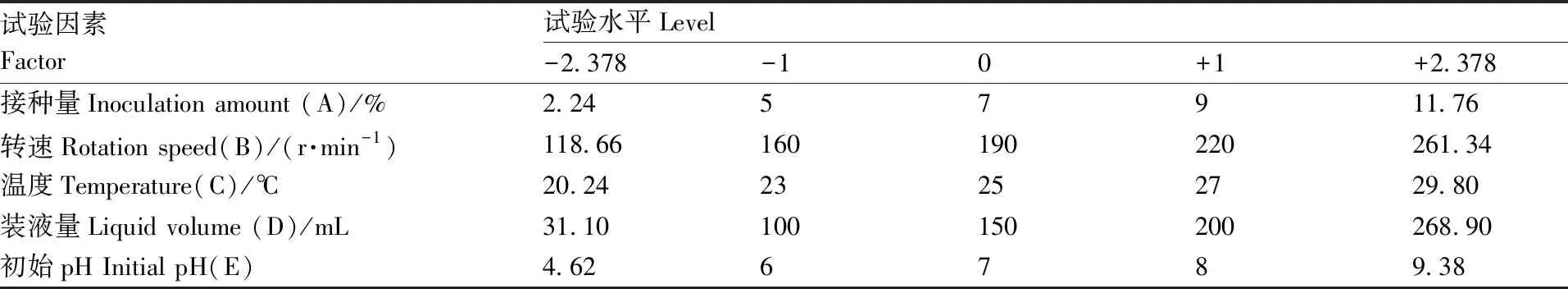
表1 响应面法-通用旋转中心组合设计因素及水平

图1 PA-2粗提物显色结果Fig.1 Color development results of PA-2 crude extract
2.2 PA-2脂肽类物质抑菌活性测定
金黄色葡萄球菌、酿酒酵母菌、大肠埃希菌、白色念珠菌、樱桃球腔菌和大麦网斑病脂肽粗提物的抑菌活性测定结果如图2所示,脂肽粗提物对金黄色葡萄球菌、酿酒酵母菌、大肠埃希菌、樱桃球腔菌和大麦网斑病都有抑制效果,抑菌圈直径分别为3.65、1.95、2.15、1.35、2.18 cm(表2)。而白色念珠菌培养皿中没有抑菌圈的出现,这说明脂肽粗提物对这种细菌无抑制效果。
2.3 单因素试验结果
2.3.1 接种量对脂肽产量的影响
按照接种量分别为3%、5%、7%、9%、11%,其他条件均保持不变,对发酵液进行接种,脂肽产量结果如图3-A所示。单因素方差分析结果表明,接种量为7%、9%、11%时的脂肽产量显著高于接种量为3%、5%时的脂肽产量(P<0.05)。

A,金黄色葡萄球菌;B,酿酒酵母;C,大肠埃希菌;D,白色念珠菌;E,樱桃球腔菌;F,大麦网斑病;CK-,阴性对照;CK+,阳性对照。A, Staphylococcus aureus; B, Saccharomyces cerevisiae; C, Escherichia coli; D, Candida albicans; E, Mycosphaerella cerasella; F, Pyrenophora teres; CK-, Negative control; CK+, Control.图2 脂肽类物质对不同菌株的抑制效果Fig.2 Inhibitory effect of crude lipopeptide on different strains

表2 脂肽粗提物对不同细菌的抑菌直径
且接种量为7%时脂肽产量最大。7%、9%、11%的接种量下脂肽产量两两之间差异不显著,并且3%的接种量和5%的接种量下的脂肽产量差异不显著。
2.3.2 转速对脂肽产量的影响
按照转速为100、130、160、190、220 r·min-1,其他条件均保持不变的条件下对液体培养基进行发酵,脂肽产量结果如图3-B所示。单因素方差分析结果表明,转速为190、220 r·min-1时脂肽产量显著高于转速为100、130、160 r·min-1时的脂肽产量(P<0.05),且当转速为190 r·min-1时脂肽产量最大。转速在100、130、160、190 r·min-1的条件下脂肽产量两两之间差异显著,转速为190、220 r·min-1时的脂肽产量之间无显著差异。
2.3.3 温度对脂肽产量的影响
按照温度为21、23、25、27、29 ℃,其他条件均保持不变的条件下对液体培养基进行发酵,脂肽产量结果如图3-C所示。在温度为23、25、27 ℃条件下的脂肽产量显著高于21和29 ℃条件下的脂肽产量(P<0.05),且25 ℃时脂肽产量最大。温度为21、23、25、27 ℃条件下脂肽产量两两之间差异显著。温度为21 ℃下的脂肽产量与温度为29 ℃下的脂肽产量无显著差异。这说明菌株的产肽量在21~27 ℃这个范围内对温度变化非常敏感,但低于21 ℃或高于29 ℃时菌株的产肽量会骤减,且会对温度变得不敏感。
2.3.4 装液量对脂肽产量的影响
按照装液量为50、100、150、200、250 mL,其他条件均保持不变的条件下对液体培养基进行发酵,脂肽产量结果如图3-D所示。当装液量为50、100、150 mL时脂肽产量两两之间差异显著,150 mL时脂肽产量最大。当装液量为150、200 mL时脂肽产量无显著差异,当装液量为150、250 mL时脂肽产量间有显著差异。这表明最适装液量范围为150~200 mL。
2.3.5 发酵液初始pH对脂肽产量的影响
按照初始pH为5、6、7、8、9,其他条件均保持不变的条件下,对液体培养基进行发酵,脂肽产量结果如图3-E所示。当pH为5、6、7时脂肽产量两两间有显著差异,且当pH为7时脂肽产量最大。当pH为6、8时脂肽产量间无显著差异,pH为5、9时脂肽产量间亦无显著差异。说明酸性环境和碱性环境均不利于菌株产生脂肽类化合物。
综合以上单因素试验结果最终确定以接种量7%,转速190 r·min-1,温度25 ℃,装液量150 mL,初始pH 7为中心点进行中心组合实验设计。
2.4 响应面优化实验结果与分析
2.4.1 回归方程的建立与合理性分析
基于以上单因素实验的研究结果和中心组合设计(CCD)采样原理,以接种量(A)7%,转速(B)190 r·min-1,温度(C)25 ℃,装液量(D)150 mL,初始pH(E)7为中心点进行5因素5水平的中心组合试验。中心组合设计及实验结果见表3。
利用Design-Expert 10.0.3软件对实验数据进行分析,得到二次多项回归方程:Y=0.8624+0.0057A+0.1082B+0.0257C-0.0254D+0.0095E-0.0019AB-0.0281AC-0.0075AD-0.0106AE+0.0225BC-0.0244BD-0.0088BE-0.0781CD-0.0038CE+0.0019DE-0.0756A2-0.0517B2-0.0729C2-0.0985D2-0.0959E2(编码制)。根据回归方程方差分析表4进行分析。其中,F值可用来检验各变量对响应值影响的显著性高低,F值越大,则相应变量的显著程度越高。当模型的显著性检验概率P<0.05时,认为该模型具有统计学意义。从表4中可以看出,各实验因素对脂肽化合物产量影响大小顺序为:转速(B)>温度(C)>装液量(D)>pH(E)>接种量(A),其中转速(B)、温度(C)、装液量(D)对脂肽浓度影响极显著。在交互项中AC、BC、BD、CD对脂肽浓度影响极显著。模型的决定系数R2为0.984 0,说明模型具有较高显著性,同时调整相关系数R2(Adj)=0.973 0,能够解释实验97.30%的响应值变异,且与预测相关系数R2(Pred)=0.952 4也接近,说明此实验模型与真实数据拟合程度良好,具有实践指导意义,因此可以用该模型分析和预测脂肽化合物产量的最优发酵条件。

图3 不同因素对出芽短梗霉菌PA-2脂肽粗提物产量的影响Fig.3 Effect of different factors on the yield of crude extract of Aureobasidium pullulans PA-2 lipopeptide
2.4.2 响应面结果与分析
基于表4方差分析,得出各因素显著交互作用对脂肽类物质产量影响的三维响应曲面图如图4所示。由图4-A可知,接种量-温度交互作用曲面具有良好的对称性,表明二者在交互作用中的贡献相当,对脂肽类物质产量的影响相当,表现为:脂肽类物质产量随接种量和温度的增加先增加后减小,且变化较为平缓。仅考虑二者影响下的发酵条件为:接种量7%、温度25.5℃水平附近值的组合最为合适。
由图4-B可知,转速-温度交互作用对脂肽类物质产量的影响呈倾斜拱形曲面分布,且转速方向纵向跨度较大,为影响脂肽类物质产量的敏感因素。实际发酵条件中应优先满足转速处于205~220 r·min-1此时对促进脂肽类物质生成最为有利。
由图4-C可知,转速-装液量在交互作用中脂肽浓度与转速呈正相关关系,而与装液量则呈现先增后减的变化趋势,且转速对目标产物影响大于装液量的影响。所以转速205~220 r·min-1、装液量120~160 mL时,有利于获得更高的脂肽类物质产量。
由图4-D可知,在装液量-温度交互曲面中,曲面随温度变化波动幅度更大,表明温度较装液量影响显著。当装液量小于140 mL时,脂肽类物质产量与装液量呈正相关关系,而当装液量大于140 mL时,其相关关系发生转折,装液量在140 mL附近取值时为脂肽类物质产量的最高点,温度的临界最佳参数为26 ℃左右。
为协同考虑各因素之间的交互作用对脂肽化合物产量的影响,进一步确定全局最优发酵条件,以最大脂肽化合物产量为优化目标,根据Design-Expert 10.0.3 软件运行结果,脂肽类物质产量在多因素共同影响下的最优发酵条件为:接种量6.85%、转速216.24 r·min-1、温度25.80 ℃、装液量124.87 mL、pH 7.17,在此条件下模型预测的脂肽类物质产量为0.94 g·L-1。
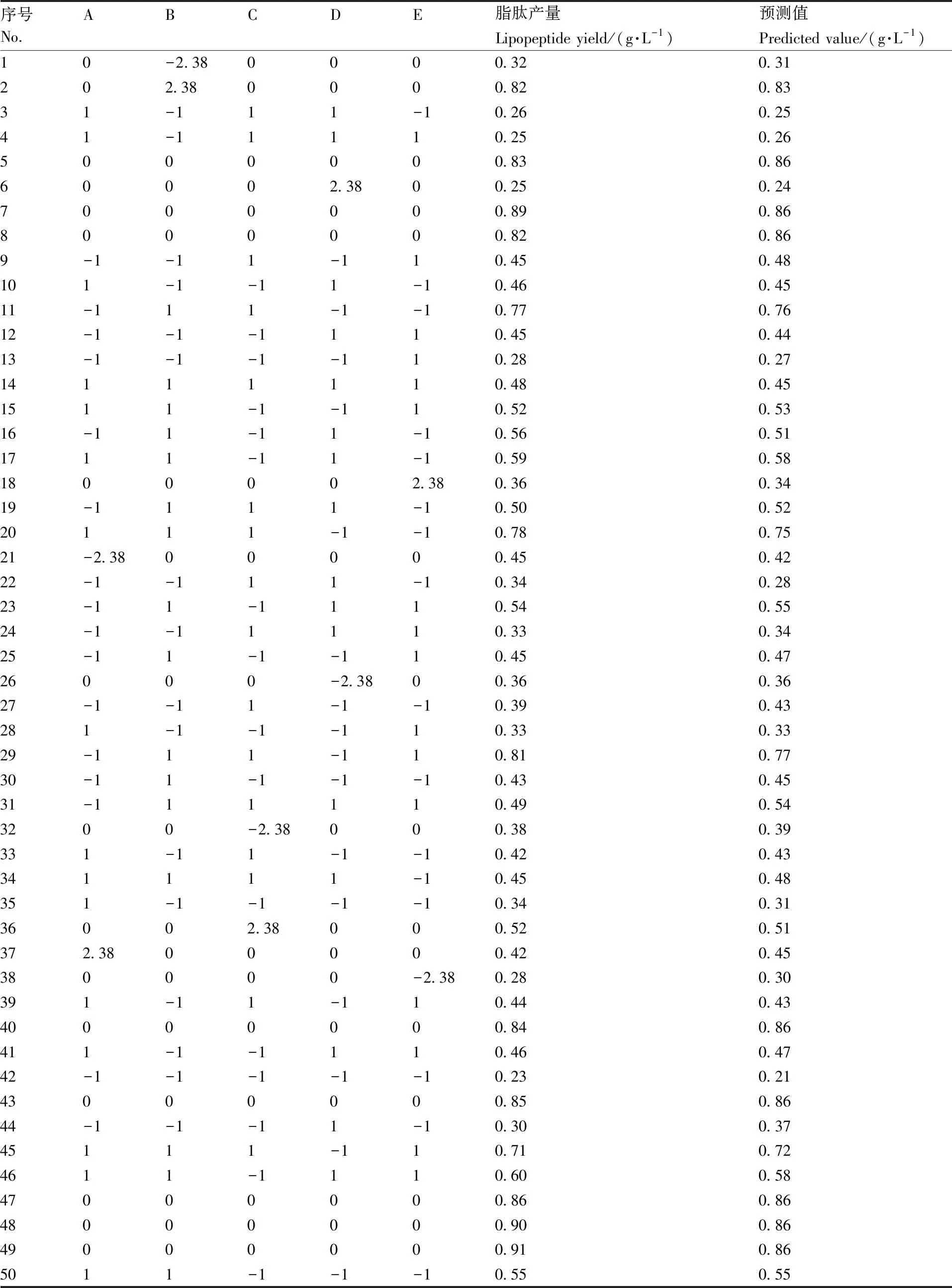
表3 中心组合试验结果及预测

表4 拟合回归方程的方差分析结果
根据软件预测结果,结合实际发酵条件的可行性,取接种量6.8%、转速216 r·min-1、温度26 ℃、装液量125 mL、pH 7进行发酵。实验重复3次,最后平均脂肽类物质产量为0.92 g·L-1,与模型预测结果接近,且比原来的0.61 g·L-1提高了近51%,说明基于该响应面模型分析优化脂肽类物质产量的发酵方法有一定的可行性。
3 结论与讨论
脂肽类物质是一类重要的抗生素,其抑菌种类与抑菌活性强弱直接决定其应用范围。本文中所提取的脂肽类化合物主要对金黄色葡萄球菌、大肠埃希菌这2种细菌和酿酒酵母菌有明显的抑制效果,对丝状真菌樱桃球腔菌和大麦网斑病在试验第3天会出现明显抑菌圈,但之后抑菌圈会逐渐变小直至消失,这说明脂肽粗提物对这2种丝状真菌的抑制作用有限。脂肽类物质按结构主要分为伊枯草菌素、表面活性素和丰原素。伊枯草菌素具有很强的溶血性及抑制真菌活性,只有一定抑制细菌和病毒的能力[20-21],伊枯草菌素的抑菌谱与本实验中脂肽粗提物的抑菌谱不同,故本实验中脂肽粗提物不可能是伊枯草菌素。表面活性素是目前认为较好的生物表面活性剂,具有很强的乳化和发泡作用,可以破坏细胞膜,猜测是其三维结构在起作用,具有很好的抗病毒、溶血、抗支原体和抗细菌的作用,对真菌没有太大的抑制作用[22-23]。这一结论与本实验中脂肽粗提物的抑菌测定结果基本相同,故脂肽粗提物的结构很可能与表面活性素结构相似。丰原素只对丝状真菌具有抑菌活性且有一定的溶血性[24],这一说法与本实验结论也不相符,说明本文中的脂肽粗提物也不可能是丰原素。

图4 各交互作用显著因素对脂肽浓度影响的三维响应曲面Fig.4 Three-dimensional response surface of the effect of various interaction factors on lipopeptide yield
目前有关出芽短梗霉菌的发酵条件优化都是以产糖量、产酸量或产孢量为响应值,本文以脂肽产量为响应值,接种量、转速、温度、装液量、培养基初始pH为自变量进行发酵条件优化,得到最适发酵条件为:接种量6.8%、转速216 r·min-1、温度26 ℃、装液量125 mL、pH 7.17,这一结果与杨莹等[25]以产孢量为响应值对出芽短梗霉菌发酵条件的优化结果相比除pH条件相近外其它条件均有所不同。李睿颖等[26],何太波等[27]以产酸量为响应值对出芽短梗霉菌发酵条件的研究结果基本与本文研究结果相一致。沈琦等[28]以产糖量为响应值对出芽短梗霉菌发酵条件进行优化的研究结果除pH与本文结论相近外其他条件也均有较大差异。综上所述,无论是以产糖量、产酸量或产孢量哪一种物质为响应值,出芽短梗霉菌发酵条件的pH都是中性环境,而其他条件会因目标产物的不同而有所差异。在本实验中转速、温度、装液量对脂肽浓度影响极显著,pH与接种量对脂肽浓度影响不显著,这一结论与杨洁[29]报道的关于枯草芽孢杆菌E1R-j产抗菌脂肽的发酵条件结果相吻合。
综上所述,出芽短梗霉菌PA-2的脂肽类物质对金黄色葡萄球菌(Staphylococcusaureus)、酿酒酵母菌(Saccharomycescerevisiae)、大肠埃希菌(Escherichiacoli)、樱桃球腔菌(Mycosphaerellacerasella)和大麦网斑病(Pyrenophorateres)的生长均有抑制作用,抑菌圈分别为3.65、1.95、2.15、1.35、2.18 cm;该类物质在接种量6.8%、转速216 r·min-1、温度26 ℃、装液量125 mL、pH 7条件下发酵,产量达到0.92 g·L-1,比优化前的产量(0.61 g·L-1)提高了51%,为后期的发酵放大实验提供了基础数据。
